液相色谱串联质谱法测定大米中多菌灵残留量的不确定度分析
李菊颖,何 健,孔德洋,单正军*
(环境保护部南京环境科学研究所,江苏 南京 210042)
液相色谱串联质谱法测定大米中多菌灵残留量的不确定度分析
李菊颖,何 健,孔德洋,单正军*
(环境保护部南京环境科学研究所,江苏 南京 210042)
建立液相色谱串联质谱法测定粮谷中的多菌灵的不确定度分析方法。根据JJF 1059—1999《测量不确定度评定与表示》中有关规定,建立不确定度评定的数学模型,分析不确定度的来源,并对不确定度分量进行量化和合成。评定结果表明,标准曲线拟合、标准溶液配制和体积量取所产生的不确定度分量较大;大米中多菌灵含量为0.033 5 mg/kg 时,其扩展不确定度为0.002 2 mg/kg(k=2)。
液相色谱串联质谱;多菌灵;不确定度;大米
多菌灵是一种广谱内吸性杀菌剂,是我国最常用的杀菌剂之一,在食品中使用广泛,范围包括谷物、油料油脂、蔬菜、水果、坚果、糖料、饮料和调味品等[1]。近年来,多菌灵的内分泌干扰性[2-3]、生殖毒性[4-6]和致畸性[7-8]已引起国外广泛关注,但国内不断的有多菌灵在各类食品残留检出的报道[9-12]。粮谷是我国主食,成分复杂,较蔬菜、水果中的农药残留分析难度大。笔者在长期检测各类粮谷中农药残留时发现,多菌灵的阳性率很高。为了确保检测结果的可信度,必须进行测量不确定度的评定。测量不确定度分析评定是日常检测工作中的重要技术组成部分,对于质量控制也具有重要意义。目前有关气相色谱法[13-15]、液相色谱法[16]和气相色谱-质谱法[17-20]的不确定度评价方法较多,而液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS)法的相关研究基本空缺。本研究参照相关标准[21-23],通过GB/T 20770—2008《粮谷中486种农药及相关化学品残留量的测定:液相色谱-串联质谱法》[24]评定大米中多菌灵残留量的不确定度,为实验室质量控制提供科学、准确的依据,同时为测量其他农药残留量的不确定评定提供参考。
1 材料与方法
1.1 材料与试剂
多菌灵标准品(纯度(98.6±0.4)%) 德国Dr. Ehrenstorfer GmbH公司;甲苯、乙腈(均为色谱纯)德国Merck公司。
1.2 仪器与设备
AB SCIEX Triple Quad 4500超高效液相色谱-三重四极杆串联质谱仪 美国AB公司;CPA224S电子天平(0.1 mg) 美国赛多利斯公司。
1.3 方法
1.3.1 前处理
按照GB/T 20770—2008的要求,称取10 g大米试样(精确至0.01 g),放入盛有15 g无水硫酸镁的具塞离心管中,加入35 mL乙腈,3 800 r/min离心5 min,取上清液通过装有无水硫酸钠的筒形漏斗,收集于梨形瓶中,残渣再用30 mL乙腈提取一次,合并提取液,40 ℃水浴中旋转浓缩至约0.5 mL,加入5 mL乙酸乙酯-正己烷(1∶1,V/V)溶液进行溶剂交换,重复2 次,最后使样品体积为5 mL,待净化。
1.3.2 凝胶渗透色谱净化
净化柱:400 mm×25 mm(内径);填料:BIOBeads S-X3;检测波长254 nm;流动相:乙酸乙酯-正己烷(1∶1,V/V)溶液;流速5 mL/min;进样体积5 mL;开始收集时间22 min;结束收集时间40 min。
净化:将上述提取液转移至10 mL容量瓶中,用5 mL乙酸乙酯-正己烷溶液分2 次洗涤梨形瓶,并转移至上述10 mL容量瓶中,定容摇匀,0.45 μm滤膜过滤,收集溜分于梨形瓶中,旋转蒸发至0.5 mL,乙腈-水(3∶2,V/V)溶液定容至1 mL,过0.22 μm滤膜,待LCMS-MS测定。
1.3.3 LC条件
Agilent C18色谱柱(2.7 mm×75 mm,2.7 μm);柱温40 ℃;流动相:A:乙腈,B:0.01%甲酸溶液,流速0.3 mL/min;梯度洗脱程序为0.00 min,1% A;3.0 min,30% A;4 min,50% A;4.3 min,90% A,4.6 min,1% A;5 min,1% A;进样量5 μL。
1.3.4 MS条件
正离子扫描方式,多反应检测;离子源喷雾器电压4 800 V;离子源温度540 ℃;窗帘气压力30.00 psi;雾化气压力50 psi;辅助加热气压力55 psi;碰撞气压力5.00 psi;定性离子对为192.1/160.1和192.1/132.1;定量离子对192.1/132.1;去簇电压80 V;碰撞能量为15 V和20 V。
1.4 数学模型的建立
被测物残留量X按公式(1)计算:

式中:X为试样中被测物残留量/(mg/kg);C0为从标准工作曲线得到的试样溶液中被测组分的质量浓度/(mg/L);V为样液最终定容体积/mL;m为试样溶液所代表试样质量/g。
2 结果与分析
2.1 C0引入的不确定度u1(C)
C0的不确定度由2 个部分组成,一部分是由5 种标准溶液的质量浓度——吸收率拟合的直线求得C0时测量所产生的不确定度,另一部分是由标准储备液配制成5 种质量浓度标准溶液时对C0的测量带来的不确定度。
2.1.1 标准工作曲线拟合产生的不确定度u(C-1)
标准工作曲线拟合产生的不确定度分别取以上5 种不同质量浓度的标准溶液5 μL重复测定2 次,通过Excel软件[25]得到相应的色谱峰面积A,拟合而成的线性回归方程为A=B1C+B0(B0为截距,B1为斜率),测定数据及计算结果如表1所示。取一阳性样品,进行3 次重复检测,其测定结果见表2,则由标准工作曲线拟合所产生的不确定度如式(2)所示:
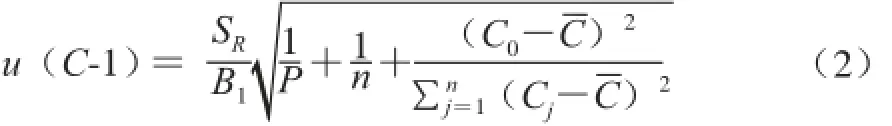
式中:SR为标准溶液峰面积残差的标准差,计算方法为:B0=31 485;B1=4 191 749;P=3(对C0进行3 次测量);n=10(5个质量浓度进行2次测量,共2×5=10);为标准溶液的平均质量浓度,
带入式(2),则u(C-1)=0.003 83 mg/L,
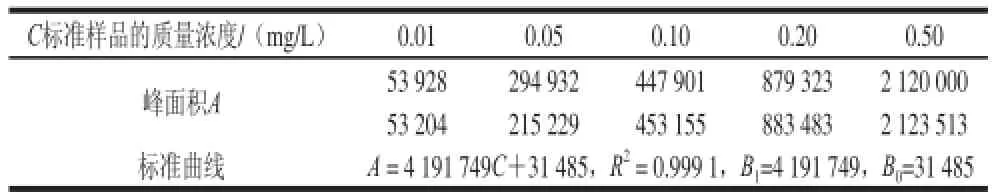
表1 标准曲线数据Table1 Analytical results of standard samples
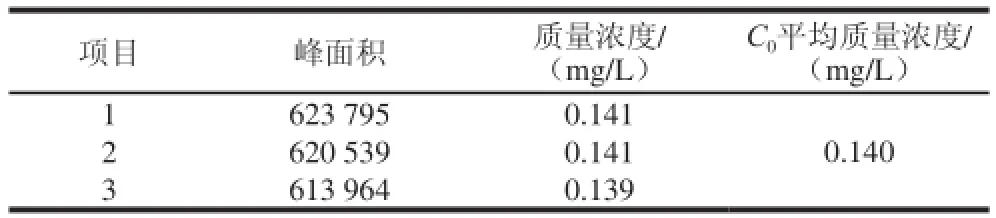
表2 阳性样品测量数据Table2 Analytical results of positive sample
2.1.2 由储备液配制所产生的不确定度u(C-2)
多菌灵标准储备液(500 mg/L)的不确定度称取50.7 mg多菌灵标准品(纯度98.6%),用甲苯定容至100 mL。根据标准证书,多菌灵标准品的纯度误差为±0.4%,按照均匀分布计算,由纯度引起的不确定度和相对不确定度分别为:u(p)=0.4%/=0.231%;urel(p)=0.231%/98.6%=0.002 34。
据检定证书,实验所用天平允许误差为±0.1mg,按均匀分布计算,由称量标准品引入的不确定度和相对不确定度分别为:u(m1)=0.1/=0.057 8 mg;urel(m1)= u(m1)/m1=0.057 8/50.7=0.001 14。
100 mL容量瓶定容体积引入的不确定度[26]:A级单标线100 mL容量瓶(V1)容量允许差是±0.1 mL,按矩形分布计算,其标准不确定度是:u(V1)=0.1/= 0.057 8 mL。实验室的温度为(20±5)℃,甲苯的体积膨胀系数为1.12×10-3℃-1,故100 mL容量瓶由温度引起的变化为±0.56 mL。假设温度变化为均匀分布(k=),则u(V2)=0.56/=0.323 mL。如表3所示,合成100 mL容量瓶定容体积引入的相对不确定度为
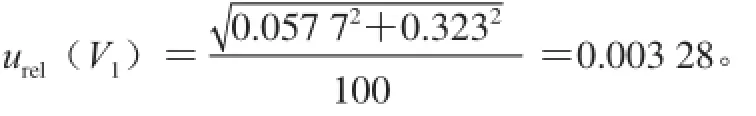
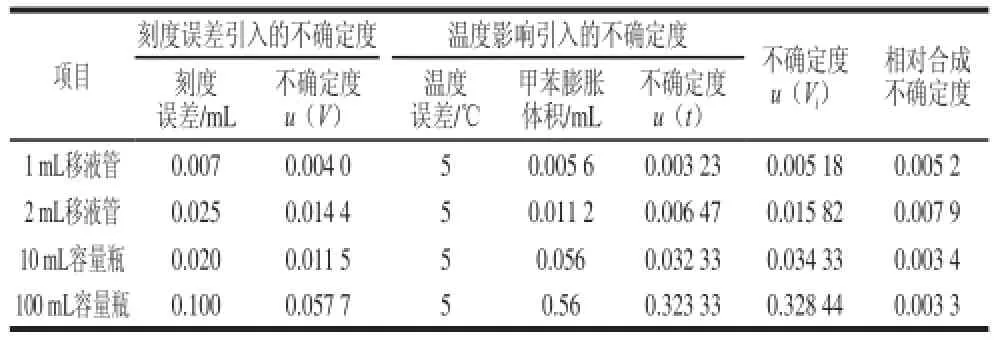
表3 移液管和容量瓶引入的不确定度Table3 Uncertainty arising from pipettes and volumetric fl asks
2.1.3 母液稀释过程产生的不确定度u(C-3)
1 mL多菌灵标准储备液(500±1)mg/L移入10 mL容量瓶(A级)中,用甲苯定容至刻度,得到50 mg/L的标准溶液(1∶10稀释),2 mL多菌灵50 mg/L的标准溶液移入100 mL容量瓶(A级)用甲苯定容至刻度,得到1 mg/L的标准溶液(1∶50稀释)。

式中:C1为1 mg/L的溶液质量浓度/(mg/L);Cstock为储备液质量浓度/(mg/L);f为稀释因子,为稀释前体积/mL;Vi为稀释后体积/mL。
其中:
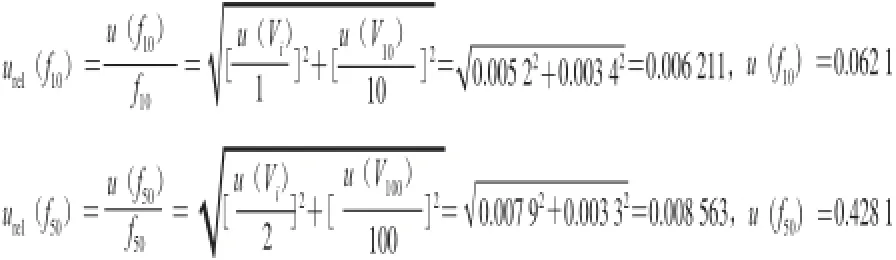
质量浓度1 mg/L的标准溶液为的不确定度u(1)由储备液不确定度u(stock)和稀释过程中的不确定度[u(1∶10)和u(1∶50)]组成。将储备液的不确定度1 mg/L转化成标准不确定度,按均匀分布有0.577 mg/L,各项结果如表4所示。

表4 稀释过程引入的不确定度Table4 Uncertainty arising from dilution
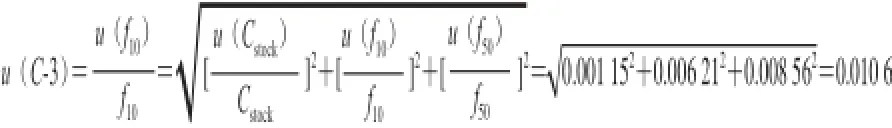
2.1.4 标准曲线配制过程产生的不确定度u(C-4)
配制标准曲线,使用1、2 mL和5 mL分度吸量管移取0.1、0.5 mL和1 mL,2mL和5 mL标准溶液(1 mg/L)于一系列10 mL容量瓶中,定容至刻度,得到质量浓度分别为0.01、0.05、0.10、0.20、0.50 mg/L的标准溶液,结果如表5所示。各稀释过程产生的不确定度如表6所示。
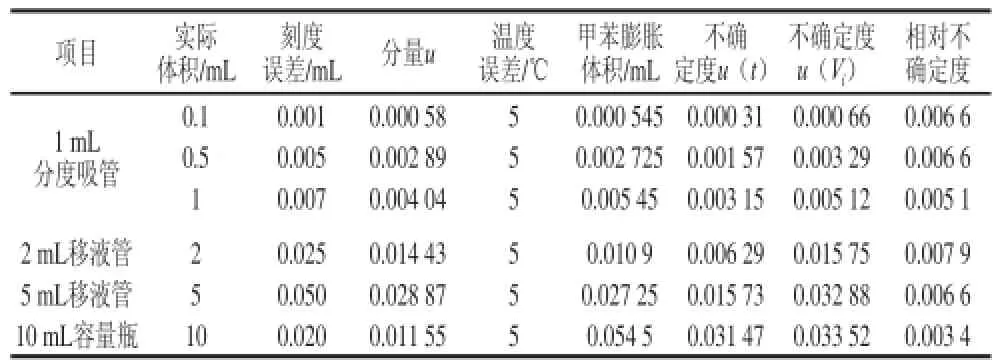
表5 移液管和容量瓶引入的不确定度Table5 Uncertainty arising from pipettes and volumetric fl asks
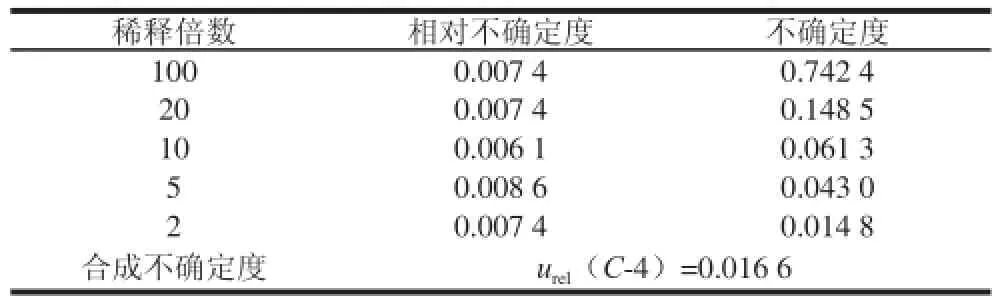
表6 稀释过程引入的不确定度Table6 Uncertainty arising from dilution

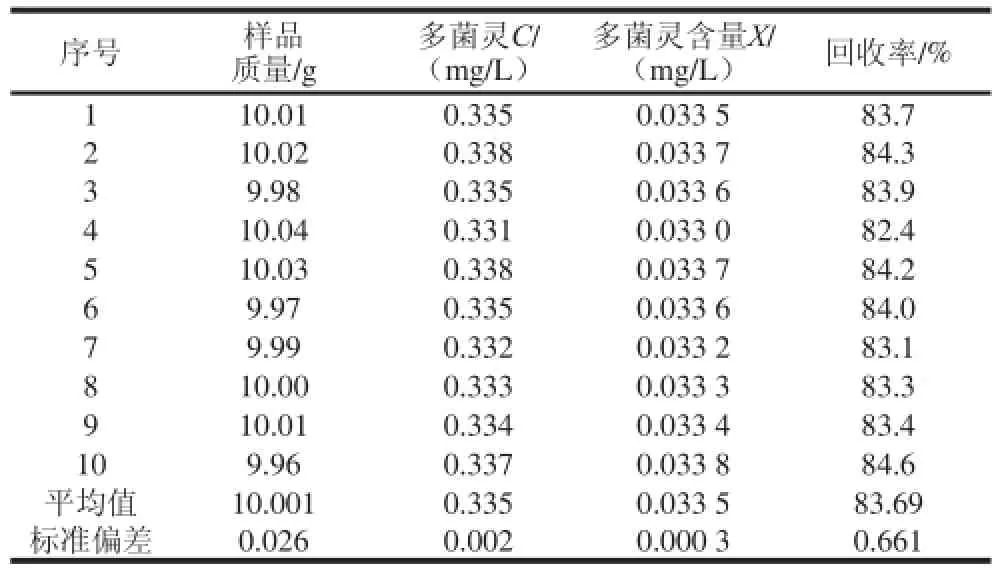
表7 大米中多菌灵含量测定结果Table7 Parallel measurements of carbendazim residues in rice
2.3 回收率产生的不确定度u(R)
测量回收率结果列于表7,按A类评定,其引入的标准不确定度和相对标准不确定度为:u(R)=S(R)/= 0.209;urel(R)=u(R)/=0.209/83.69=0.002 47。
2.4 样品称质量产生的不确定度u(m)
称取10 g大米样品,所用天平最大允许误差为±0.01 g,按照矩形分布计算,其标准不确定度和相对标准不确定度分别为:u(m)=0.01/=0.005 8 g;urel(m)= 0.005 8/10=0.000 58。
2.5 体积量取产生的不确定度u(V)
量取体积产生的不确定度主要由定容体积和进样体积不确定度组成,属B类不确定度。
2.5.1 定容容量产生的不确定度
样品经过有萃取、净化后用刻度试管定容至V1为1 mL,其体积允许误差为±0.008 mL,按照矩形分布计算,其标准不确定度是:u(V1)=0.008/= 0.000 46 mL;因温度变化产生的乙腈容积变化最大值为:u(V1温)=1×5×1.37×10-3=0.006 85 mL,按照矩形分布计算,其标准不确定度是:u(V1温)= 0.006 85/=0.003 95 mL。
定容时引入的不确定度为u(V1)==0.003 98;0.003 98。
2.5.2 LC-MS-MS联用进样体积产生的不确定度
LC-MS-MS自动进样器配置的进样体积V2为5.0 μL,进样针容积的相对标准偏差为±1%,按照矩形分布计算,则其相对不确定度urel(V2)=1%/=0.005 7。
2.6 合成标准不确定度
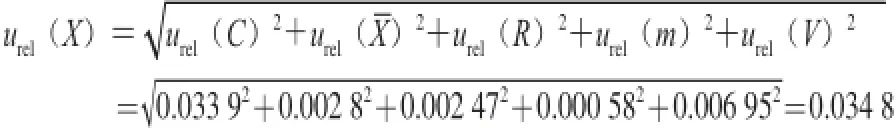
2.7 相对扩展不确定度
u(X)=urel(X)×X=0.034 8×0.033 5=0.001 1
2.8 不确定度分析结果
取包含因子k=2,多菌灵含量的扩展不确定度U(u(X)×k)为0.002 2 mg/kg,故LC-MS-MS法测定大米中多菌灵含量的结果表示为(0.033 5±0.002 2)mg/kg,k=2。
3 结 论
实验过程中,称量、提取、净化、MS测定等过程均会引入不确定度,本实验通过对实验室温度、玻璃仪器、溶液配制、稀释、重复测定、回收率、质量、体积等因素的考虑,发现LC-MS-MS法测定粮谷中的多菌灵方法中,标准曲线拟合过程和标准溶液配制所产生的不确定最大,其次为体积量取引入的不确定度分量。在日常检查过程中,应尽量保持LC-MS-MS仪器较高的灵敏度,并定期对所涉仪器进行检定和提高操作人员的熟练水平,从而减小测量不确定度。
[1] 魏中华, 徐娟, 郭明霞, 等. 国内多菌灵的研究进展[J]. 安徽农业科学, 2015, 43(3): 125-127; 141.
[2] World Health Organization. Environmental health criteria 149: Carbendazim[R]. Geneva: WHO, 1993.
[3] GOVINDASSAMY P, TIROUMAVALAVANE M, MARCELLINE S O, et al. Toxic influence of endocrine disruptor, carbendazim, on brain biochemical and haematological changes in the fresh water fi sh, Cyprinuscarpio[J]. Toxicology Letters, 2011, 205: 125.
[4] LIM J, MILLER M G. The role of the benomyl metabolite carbendazim in benomyl-induced testicular toxieity[J]. Toxicol APPI Pharmacol, 1997, 142(2): 401-410.
[5] NAKAI M, MOORE B J, HESS R A, et al. Epithelial reorganization and irregular growth following carbendazim-induced injury of the efferent duetules of the rat testis[J]. The Anatomical Record, 1993, 235(1): 51-60.
[6] ELKIANE M R, SIMONE B, MI LENE L V, et al. Reproductive and possible hormonal effects of carbendazim[J]. Regulatory Toxicology and Pharmacology, 2014, 69: 476-486.
[7] LUDWIKOWSKA A, BOJARSKI B, SOCHAAL M. The influence of the fungicide carbendazim on the embryonic development and hatching success of Prussian carp (Carassius gibelio)[J]. Reproductive Biology, 2013, 21(4): 367-371.
[8] 周韧, 程薇, 冯艳, 等. 应用胚胎干细胞试验对多菌灵胚胎毒性的初步评价[J]. 毒理学杂志, 2014, 28(2): 128-131.
[9] 杨群华, 徐伟松, 姜艳玲, 等. 液相色谱法和液相色谱-串联质谱法测定蔬菜中多菌灵等15 种农药残留量的研究[J]. 安徽农业科学, 2014, 42(25): 8593-8597.
[10] 陈婷. 超快速液相色谱串联质谱法测定水果中多菌灵等7 种农药残留量[J]. 西藏农业科技, 2014, 36(4): 37-41.
[11] 周晓洁, 赵忠良, 夏湘, 等. 在线净化固相萃取高效液相色谱法测定柑橘中多菌灵痕量残留量[J]. 食品安全质量检测学报, 2014, 5(11): 3691-3698.
[12] 廖涛, 杨玉平, 程薇, 等. 苹果中多菌灵、噻菌灵和甲基托布津的高效液相色谱法分析[J]. 分析测试技术与仪器, 2010, 16(4): 257-261.
[13] 胡贝贞, 宋伟华, 董文洪, 等. 茶叶中联苯菊酯等4 种农药残留测定结果的不确定度评定[J]. 现代测量与实验室管理, 2012(1): 29-32.
[14] 崔雁娜, 赵汉取, 韦肖杭, 等. 气相色谱法测定有机氯含量的不确定度评定[J]. 广东化工, 2012, 39(5): 200-202.
[15] 李松, 饶竹. 气相色谱法测定地下水中六六六结果的不确定度评定[J].岩矿测试, 2008, 27(4): 295-298.
[16] 陈嘉文, 彭虹. 液相色谱法测定土壤中甲萘威的不确定度评定[J].环境科学与管理, 2010, 35(7): 120-127.
[17] 蒋万枫. 气相色谱质谱联用法测定蔬菜中毒死蜱农药残留量的不确定度评定[J]. 现代农业科技, 2012(4): 354-355; 357.
[18] 王吉祥, 张学忠, 王亚琴, 等. 气相色谱法和气相色谱-质谱法测定茶叶中联苯菊酯的不确定度评定[J]. 食品科学, 2014, 35(12): 200-203.doi: 10.7506/spkx1002-6630-201412041.
[19] 赖添财, 蔡恩兴. GC-MS内标法测定苹果中哒螨灵残留量不确定度的评定[J]. 山西农业科学, 2013, 41(9): 959-962.
[20] 丁立平. 气相色谱-质谱联用仪测定茶叶中氟虫腈的不确定度评定[J].分析测试技术与仪器, 2011, 17(3): 149-154.
[21] 国家质量技术监督局. JJF 1059—1999 测量不确定度评定与表示[S].北京: 中国计量出版社, 1999.
[22] 中国合格评定国家认可委员会. CNAS—GL06 化学分析中不确定度的评估指南[S/OL]. (2009-03-12)[2011-12-20]. htttp://www.simt. com.cn/art/2009/3/12/art_1903_6021.html.
[23] 合格评定国家认可委员会. CNAS—CL01 检测和校准实验室能力认可准则(ISO/IEC 17025: 2005)[S].
[24] 庞国芳, 刘永明, 范春林, 等. GB/T 20770—2008 粮谷中486 种农药及相关化学品残留量的测定: 液相色谱-串联质谱法[S]. 北京: 国家标准化委员会, 2008.
[25] 范巧成. Excel在线性回归法测量不确定度评定中的应用[J]. 理化分析: 化学分册, 2005, 41(9): 678-680.
[26] 国家技术监督局. GB 12806—1991 实验室玻璃仪器单标线容量瓶[S].北京: 中国标准出版社, 1991.
Uncertainty Evaluation for the Determination of Carbendazim in Rice by Liquid Chromatography-Tandem Mass Spectrometry
LI Juying, HE Jian, KONG Deyang, SHAN Zhengjun*
(Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection of the People’s Republic of China, Nanjing 210042, China)
A methodology of uncertainty evaluation for the determination of carbendazim residues in rice by liquid chromatography-tandem mass spectrometry (LC-MS-MS) was proposed. According to the Evaluation and Expression of Uncertainty in Measurement (JJF 1059-1999), the mathematical model of uncertainty was establis hed. The sources of uncertainty were analyzed and each component of uncertainty was quantifi ed individually and then combined. The results showed that the curve fi tting, preparation of standard solution and volumetric measurement were the main sources of uncertainty, and the expanded uncertainty was 0.002 2 mg/kg (k = 2), and the residue of carbendazim in rice was 0.033 5 mg/kg.
liquid chromatography-tandem mass spectrometry; carbendazim; uncertainty; rice
O657.7
A
1002-6630(2015)22-0169-04
10.7506/spkx1002-6630-201522032
2015-03-03
李菊颖(1988—),女,研究实习员,硕士,研究方向为农药残留检测。E-mail:lijuying1988@126.com
*通信作者:单正军(1963—),男,研究员,博士,研究方向为农药及有机污染物对生态环境影响。E-mail:sszjnies@163.com

