应激对反流性食管炎模型大鼠免疫功能的影响
康丽丽,唐艳萍,王 瑞,刘思邈,弓艳霞
应激对反流性食管炎模型大鼠免疫功能的影响
康丽丽,唐艳萍,王瑞,刘思邈,弓艳霞
目的:观察应激对反流性食管炎(RE)模型大鼠食管黏膜免疫功能的影响,探讨应激对RE的作用及可能机制。方法:健康雄性Wistar大鼠,随机分为对照组、应激组、模型组、应激模型组,每组15只。采用改良部分贲门肌切开术加外置幽门部分结扎术制备大鼠RE模型。造模后7 d,应激组和应激模型组采用束缚水浸方法行应激实验。实验结束后,观察各组食管下段黏膜病理改变,并检测单位面积内肥大细胞(MC)数量、脱颗粒率及黏膜SIgA、血清IgA水平。结果:与对照组比较,模型组大鼠食管下段黏膜肉眼观察及病理表现积分均增加,MC数量[(14.25±1.26)个]及脱颗粒率[(31.07±7.53)%]均升高,黏膜SIgA[(44.86±8.13)mg/L]、血清IgA[(13.64±4.19)×10-2g/L]水平均下降(P<0.01);与模型组相比,应激模型组食管下段黏膜肉眼观察及病理表现积分升高(P<0.05),MC数量[(24.91±1.93)个]及脱颗粒率[(48.60±5.22)%]升高,黏膜SIgA[(31.61±7.29]mg/ L)、血清IgA[(5.73±4.04)×10-2g/L]水平下降(P<0.01)。结论:应激加重RE模型大鼠食管黏膜损伤,其机制可能包括影响机体免疫功能。
反流性食管炎;束缚水浸应激;肥大细胞;免疫球蛋白A;大鼠
反流性食管炎(reflux esophagitis,RE)是食管抗反流防御机制减弱和反流物对食管黏膜攻击共同作用的结果,但确切机制至今尚未完全阐明。在临床研究工作中发现,不少患者除典型的反酸、烧心等消化道症状外,尚合并焦虑、紧张、抑郁等情绪障碍。这些不良心理应激会使患者的消化道症状加重或复发,部分患者单纯使用抑酸药和/或促动力药疗效不佳,而联合抗焦虑抑郁等情绪障碍的药物及心理疏导疗法往往事半功倍,提示精神心理应激在RE的发生、发展及转归中可能发挥重要作用[1-2]。本实验通过观察应激对RE模型大鼠免疫功能的影响,探讨应激在RE发生发展中的作用及可能的相关机制。
1 材料与方法
1.1动物及分组健康雄性Wistar大鼠60只,体质量250~280 g(购于北京维通利华动物实验有限责任公司)。恒温(25℃左右)环境饲养,每天光照和黑暗各12 h交替,自由进食水。适应环境7 d,按数字随机表法随机分为对照组、应激组、模型组、应激模型组,每组15只。
1.2模型制备
1.2.1造模方法采用改良部分贲门肌切开术加外置幽门部分结扎术[3]制备大鼠RE模型,操作步骤如下:大鼠术前禁食不禁水24 h,10%水合氯醛按3 mL/ kg腹腔注射进行麻醉后,腹正中切开约25 mm,在食管胃交界处,将贲门肌纵行切开5 mm,分离至黏膜层,以使贲门松弛压力减低,增加胃反流。分离前缝扎胃左动脉分支(横过胃食管交界处),以预防贲门肌切开出血。后行幽门半结扎:将金属棒(直径0.4 cm)与幽门一起结扎,注意避开血管,最后将金属棒抽出。关腹前腹腔注入庆大霉素2万U预防腹腔感染,缝合后予碘伏消毒创口。手术过程严格无菌操作。术后禁食24 h,可饮糖盐水,而后半量饲料(15 g/d)3 d,之后全量饲料(30 g/d)。
1.2.2应激方法采用束缚水浸方法[4]进行应激实验,大鼠禁食不禁水24 h,乙醚轻度麻醉,捆绑四肢,力度均等固定在鼠板上。浸入(20±1)℃水槽内,水面浸至剑突部位,持续4 h后取出大鼠,立即剖腹观察实验指标。
1.3检测指标
1.3.1食管黏膜大体标本观察分别处死大鼠,切取下段食管并纵行剖开,用生理盐水清洗食管,观察大体变化。采用1999年12月中华医学会消化内镜学会颁布RE诊断标准进行分级[5]。
1.3.2食管黏膜病理学观察自食管下段截取2 cm左右,纵行剖开,生理盐水清洗后,10%福尔马林中固定,石蜡包埋,常规苏木精-伊红(HE)染色及光镜(BX60型Olympus)观察。采用1999年12月中华医学会消化内镜学会颁布RE诊断标准进行病理分级[5]。
1.3.3食管黏膜肥大细胞(mast cell,MC)的测定自食管下段截取食管黏膜组织2块,常规石蜡包埋、切片、HE染色。另取切片行甲苯胺蓝改良法染色(MC染色液购自上海酶联生物科技有限公司),计数并观察MC数量及形态。计数方法:每张切片随机选取3个视野,置于Olympus BH2显微镜高倍镜(×400)下观察,取3个视野的平均值,计数每张切片MC数量,并计算MC的脱颗粒率。
1.3.4血清免疫球蛋白A(immunoglobulin A,IgA)测定取0.05 mL血清,按照试剂盒说明书采用免疫投射比浊法测定其中IgA的含量(IgA ELISA试剂盒购自上海研辉生物科技有限公司)。
1.3.5食管黏膜表面分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)测定游离食管,用2 mL生理盐水反复冲洗3次后吸出,按照试剂盒说明书采用放射免疫法测定SIgA含量(试剂盒由北京北方生物技术研究所提供)。
1.4统计学处理以SPSS11.5统计软件包进行数据处理,计量资料用均数±标准差(±s)表示。按照P<0.05(P<0.01)作为检验水准,组间差异用q检验。
2 结果
2.1大鼠一般情况对照组大鼠被毛紧密贴身,色白光泽,两眼有神,活动敏捷,食量较多,大便呈颗粒状。造模大鼠术后均有不同程度的行动迟缓、精神减弱、对外界刺激淡漠、被毛松散、毛色光泽减弱、饮水量及食量下降,体重下降等,多数大鼠嘴边可见反流物流出,出现便溏及拉尾现象。应激实验大鼠捆绑初期可见其挣扎、嘶叫、反抗、呼吸急促、心跳加快,实验中逐渐由兴奋进入抑制,呼吸相对平稳,体温减低,对外界刺激感觉降低,可见实验动物四肢出现轻度瘀血和缺血表现。应激组死亡1只,模型组死亡2只,应激模型组死亡3只,死亡原因为窒息、幽门梗阻、炎症、肠梗阻等,造模成功率90%(54/60)。
2.2食管下段黏膜大体观察对照组大鼠食管下段黏膜红润、光滑,无损伤;应激组黏膜呈红色,可见点片状糜烂、粗糙、充血,部分严重者有溃疡形成;模型组黏膜呈红色,可见点片状糜烂、粗糙、充血,严重者可见溃疡,部分有增生白斑;应激模型组黏膜明显充血水肿,病变广泛,黏膜糜烂、粗糙,部分黏膜上附血痂,拭去血迹后见溃疡、糜烂形成。见表1。
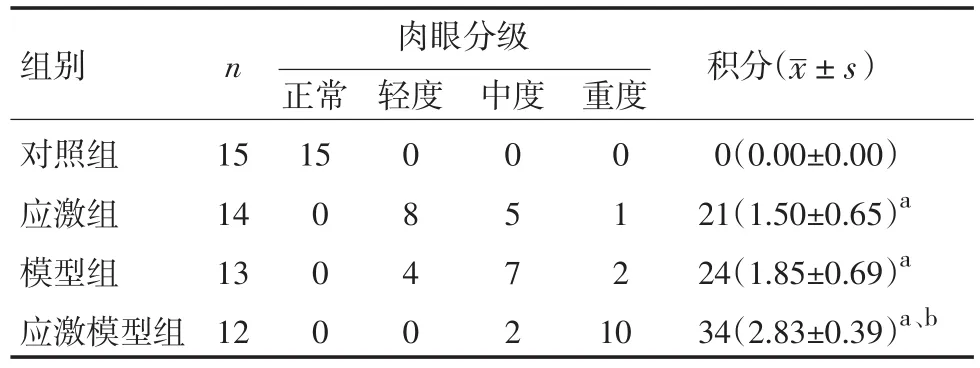
表1 各组食管黏膜肉眼表现分级比较
2.3食管下段黏膜光镜下观察对照组光镜下偶见上皮细胞层内炎性细胞浸润。应激组可见斑块状、弥漫性黏膜充血,基底层细胞增生;鳞状上皮黏膜固有层乳头伸长,延向上皮质;固有层可见水肿及少量嗜中性粒细胞浸润,部分黏膜可见溃疡或糜烂。模型组鳞状上皮细胞水肿,基底层细胞增生;鳞状上皮黏膜固有层乳头延长至上皮表层下;固有层可见水肿及较多嗜中性粒细胞浸润,部分黏膜可见溃疡或糜烂。应激模型组黏膜坏死、水肿明显,部分可见脱落、溃疡,溃疡可深至黏膜肌层,呈火山口样改变;固有层可见水肿及较多嗜中性粒细胞浸润。病理分级积分:轻度为1分,中度为2分,重度为3分,正常则为0分。
与对照组比较,模型组大鼠食管黏膜肉眼观察及光镜下病理表现分级积分均升高,说明造模使食管黏膜出现炎症损伤,证实造模成功;与模型组相比,应激模型组食管黏膜肉眼观察及光镜下病理分级积分明显升高,表明应激可造成或加重食管黏膜损伤。见表2。
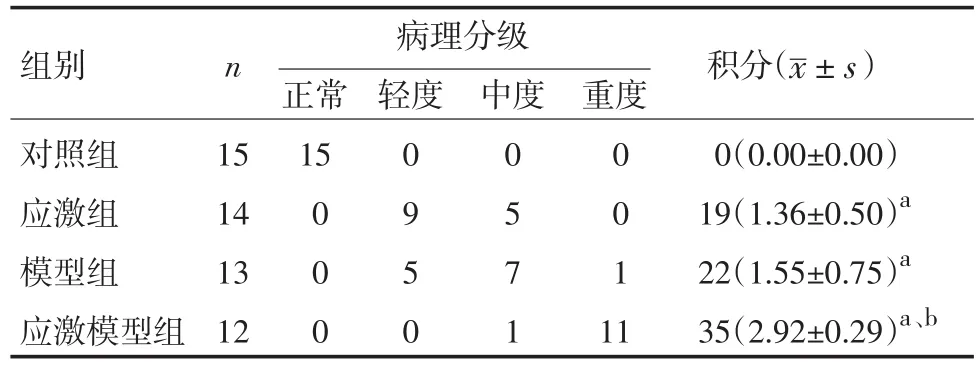
表2 各组食管黏膜病理分级比较
2.4MC数量及脱颗粒率测定与对照组比较,各组大鼠食管单位黏膜MC数量及脱颗粒率升高;与模型组相比,应激组和应激模型组MC数量及脱颗粒率明显升高,差异有统计学意义。见表3,图1~4。
表3 各组大鼠食管单位黏膜MC数量及脱颗粒率(±s,%)

表3 各组大鼠食管单位黏膜MC数量及脱颗粒率(±s,%)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别对照组应激组模型组应激模型组n 15 14 13 12 MC总数(个)5.31±1.52 16.77±1.91a、b14.25±1.26a24.91±1.93a、c脱颗粒率(%)13.50±5.52 36.85±6.35a、b31.07±7.53a48.60±5.22a、c
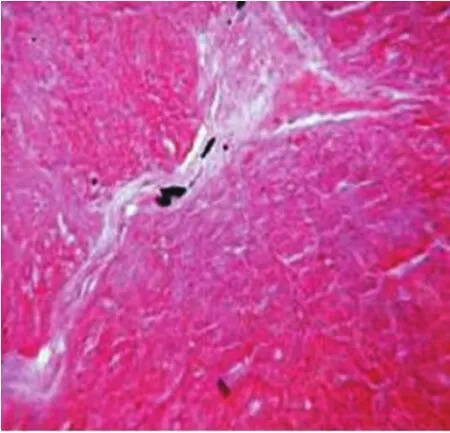
图1 对照组甲苯胺蓝染色显示的肥大细胞颗粒呈蓝紫色,细胞大小不一,呈圆形、卵圆形等(×400倍)
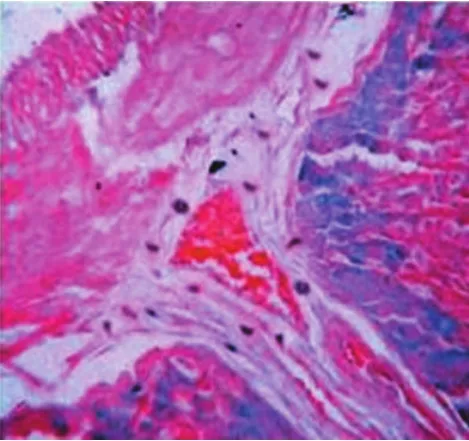
图2 应激组肥大细胞数量增多,多沿血管分布。胞质内充满嗜碱性蓝紫色颗粒,颗粒多而密集(×400倍)

图3 模型组肥大细胞数量增多,形态大小不一,胞质内嗜碱性蓝紫色颗粒多而密集(×400倍)
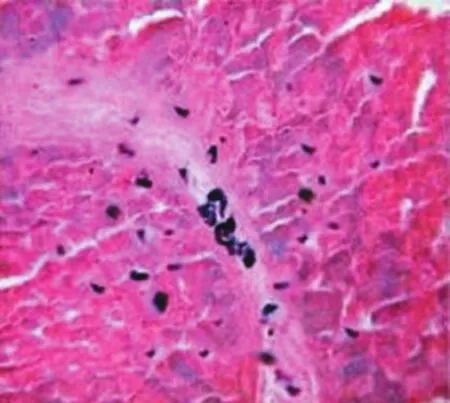
图4 应激模型组肥大细胞未脱颗粒者细胞完整,胞质均匀,胞膜清晰,脱颗粒者则胞膜破溃,颗粒涌出胞膜,细胞形状不规则(×400倍)
2.5血清中的IgA测定与对照组比较,各组大鼠血清IgA水平下降;与模型组比较,应激组和应激模型组血清IgA水平均下降,差异有统计学意义。见表4。
2.6食管黏膜表面SIgA测定与对照组比较,各组大鼠食管黏膜SIgA水平下降;与模型组比较,应激组和应激模型组黏膜SIgA水平均下降,差异有统计学意义。见表5。
表4 各组大鼠血清IgA水平(±s,g/L)

表4 各组大鼠血清IgA水平(±s,g/L)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别对照组应激组模型组应激模型组n 15 14 13 12 IgA(×10-2) 18.01±6.27 10.17±4.11a、b13.64±4.19a5.73±4.04a、c
表5 各组大鼠黏膜SIgA水平(±s,mg/L)
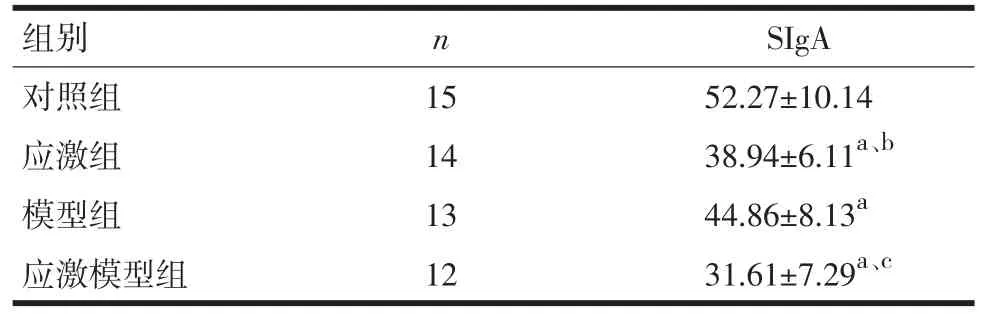
表5 各组大鼠黏膜SIgA水平(±s,mg/L)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别对照组应激组模型组应激模型组n 15 14 13 12 SIgA 52.27±10.14 38.94±6.11a、b 44.86±8.13a31.61±7.29a、c
3 讨论
应激是机体对内外环境中各种刺激因素的一种不协调反应。研究表明,应激可通过神经-内分泌-免疫网络系统即下丘脑-垂体-肾上腺皮质(hypothalamic-pituitary-adrenal axis,HPA)轴和交感-肾上腺髓质(sympathetic-adrenal medulla axis,SAM)轴调节免疫应答,应激时HPA轴和SAM轴均处于激活状态,使糖皮质激素分泌增多,β2肾上腺素能受体兴奋,通过各种机制,最终诱导免疫抑制[6]。胃肠道是人体外周最大的免疫器官,肥大细胞(mast cell,MC)是消化道重要的免疫调节细胞,广泛分布于消化道,部分MC与神经纤维伴行[7],这一联系为中枢神经系统和胃肠道的双向信息传递提供了生理媒介。各种应激因素包括心理应激可通过脑肠轴诱发MC活化脱颗粒释放多种生物活性介质如TNF-α,IL-1b、组胺、血管活性肠肽、5-HT等,使胃肠道内脏敏感性增强、运动功能改变、黏膜通透性增加,甚至导致炎症反应发生[8]。
研究报道,急性应激可造成肠黏膜屏障破坏与肠道MC脱颗粒释放炎性介质有关[9];老年RE患者食管下段黏膜炎症程度与MC数量、脱颗粒率增加正相关[10],本研究结果表明,应激导致正常大鼠食管黏膜损害,加重RE大鼠黏膜炎症,同时使食管黏膜MC数量及脱颗粒率均增加,MC活化程度升高。表明应激可诱发或加重食管炎,其机制可能与应激诱导MC功能活化有关。Zhong等[11]研究也显示,与MC缺陷大鼠相比,慢性束缚应激使正常大鼠MC数量及其活化程度升高,MC类蛋白酶和蛋白酶激活受体PAR2增加,紧密连接蛋白表达下降,细胞间隙增宽。说明MC在应激诱导的食管上皮功能障碍中发挥重要角色。
人体IgA主要来源于肠黏膜固有层的浆细胞,分为血清型IgA及分泌型SIgA,主要以SIgA执行黏膜免疫功能。SIgA通过黏附病原微生物、过敏原等有害物质,降低或抑制其对黏膜的毒性作用,防止机体变态炎症反应的发生,维持肠黏膜稳态,在保持消化道上皮完整性和维持消化道正常功能方面起重要的作用[12]。研究显示,应激性溃疡血清中IgA、胃液中SIgA均明显减少[6],考试应激时唾液SIgA水平降低[13],显示应激可造成机体局部及全身免疫功能下降。本研究结果表明,应激和造模均可使大鼠血清IgA及食管黏膜SIgA水平降低,且应激模型组血清IgA和食管黏膜SIgA水平下降最显著,食管黏膜炎症最重。表明应激导致机体免疫功能尤其是黏膜免疫功能下降是食管炎发生的重要机制。
我们的研究还观察到模型组大鼠的黏膜损伤程度高于应激组,但免疫功能的影响则应激组较模型组明显。考虑可能的原因为:(1)应激主要通过免疫机制影响食管的防御机制,造成黏膜屏障、运动功能损害等,而模型组同时加重了反流物对黏膜的直接攻击作用。(2)本实验采用束缚水浸方法制作应激模型,该模型心理应激因素突出,躯体应激因素小,而模型组则躯体应激因素更明显,不同的应激方式可能造成免疫应答反应不同。有研究报道,心理应激组大鼠与高强度运动组相比,胃排空率、脑肠肽下降更明显[14]。本研究初步探讨了应激在RE中的作用及其相关的免疫机制,但研究指标较局限,应激是否还与其他免疫因子、神经递质、激素水平相关、具体的作用途径及其相互之间的联系尚不明确,仍待今后进一步实验研究证实。
[1]徐丽洁,段丽萍,王琨,等.焦虑和抑郁与胃食管反流病症状发生的相关研究[J].中华医学杂志,2005,85(45):3210-3215.
[2]高彦,陈绳武,蓝宇.GRED患者的心理因素及综合治疗[J].世界华人消化杂志,2007,15(19):2148-2150.
[3]唐艳萍,弓艳霞,李淑红,等.改良酸反流性食管炎动物模型建立及比较研究[J].中华消化杂志,2011,31(9):632-633.
[4]孙敬方.动物实验方法学[M].北京:人民卫生出版社,2001:484.
[5]中华医学会消化内镜学会.反流性食管病(炎)诊断及治疗方案(试行)[J].中华消化内镜杂志,1999,16(6):326.
[6]唐艳萍,武成,李慧吉,等.应激状态对中枢神经递质及免疫功能的影响及干预[J].中国中西医结合消化杂志,2009,17(1):8-11.
[7]Dines KC,Powell HC.Mast cell interactions with the nervous sys⁃tem:relationship to mechanisms of disease[J].J Neuropathol ExpNeurol,1997,56(6):627-640.
[8]Wierzbicki M,Brzezińska-Błaszczyk E.The role of mast cells in the development of inflammatorybowel diseases[J].Postepy Hig Med Dosw(Online),2008,62:642-650.
[9]唐宇,马洪升.肥大细胞在急性应激性肠黏膜屏障损伤中的作用机制[J].胃肠病学,2013,18(5):296-300.
[10]余跃,丁西平,王巧民,等.老年反流性食管炎患者食管黏膜肥大细胞数量和功能的改变 [J].中华老年医学杂志,2008,27(4):273-275.
[11]Zhong CJ,Wang K,Zhang L,et al.Mast Cell Activation is in⁃ volved in Stress-induced Epithelial Barrier Dysfunction in Esopha⁃gus[J].J Dig Dis,2015,16(4):186-196.
[12]RafaelCampos-Rodríguez,MarycarmenGodínez-Victoria,Edgar Abarca-Rojano,et al.Stress modulates intestinal secretory immu⁃noglobulin A[J].Front Integr Neurosci,2013,7:86.
[13]闫慧,卢莉.考试应激对医学生心身反应唾液免疫球蛋白及皮质醇的影响[J].中国学校卫生,2014,35(6):813-816.
[14]徐伟,孙维峰,梁静,等.不同应激状态下大鼠胃排空及脑肠肽含量变化[J].中国中西医结合消化杂志,2010,18(6):359-361.
(收稿:2015-03-10修回:2015-08-10)
(责任编辑张淑坤)
Impact of Stress on Immune Function of Reflux Esophagitis Rat Model
KANG Li-li,TANG Yan-ping, WANG Rui,et al.Department of Gastroenterology,Tianjin Nankai Hospital,Tianjin(300100),China
Objective To observe the changes of esophageal mucosa and immunologic function of reflux esophageal rat model under stress and to investigate the role of stress on reflux esophagitis and its possible mech⁃anism.MethodsHealthy male wistar rats were randomly divided into 4 groups,control group,stress group, model group and stress and modeling group,15 rats in each group.Reflux esophagitis rat model was established by the method of improved part cardiac muscle incision and part outlay-pyloric ligation.Seven days after model⁃ing,both stress group and stress and modeling group underwent water immersion-restraint stress.After the text, each group’s esophageal mucosa samples and microscopic observation were compared,the number of mast cells (MC)in the unit area of esophageal mucosa,the rate of mast cell degranulation,the level of Secretory immunoglob⁃ulin A(SIgA)on esophageal mucosa and Immune globulin A(IgA)in serum were detected.ResultsAs com⁃pared with the control group,model group lower esophageal mucosa of rats macroscopic observation and patho⁃logical manifestations of integral increased,the MC number(14.25±1.26)and degranulation rate[(31.07±7.53)%] increased,while the level of SIgA on esophageal mucosa[(44.86±8.13)mg/L]and IgA in serum[(13.64±4.19]× 10-2g/L)decreased(P<0.01).Compared with model group,esophageal mucosa macroscopic observation and pathological manifestations of integral(P<0.05),the number of MC(24.91±1.93),the rate of mast cell degranu⁃ lation[(48.60±5.22)%]increased significantly in stress and modeling group,while SIgA on esophageal mucosa[(31.61±7.29)mg/L]and IgA in serum[(5.73±4.04)×10-2g/L]decreased(P<0.01).ConclusionStress can aggravate RE model esophageal mucosa injury in rats,the mechanism may include the affect of organism immune function.
Reflux esophagitis;water immersion-restraint stress;mast cell;immunoglobulin A;rats
Q95-33;R655.4
A
1007-6948(2015)05-0475-05
10.3969/j.issn.1007-6948.2015.05.011
天津市卫生局科技基金(2011KZ50)
天津市南开医院消化科(天津 300100)
唐艳萍,E-mail:cb1699@sina.com

