干热河谷地区牛角瓜不同叶位光合日变化特征
黄 北,刘惠民,王连春,刘 鹏,舒蛟靖
(西南林业大学,云南 昆明 650224)
干热河谷地区牛角瓜不同叶位光合日变化特征
黄 北,刘惠民,王连春,刘 鹏,舒蛟靖
(西南林业大学,云南 昆明 650224)
为给牛角瓜的优质栽培和田间管理提供依据,用LI-6400型光合测定仪于2014年5月观测了元江干热河谷不同牛角瓜叶位叶片光合特性的日变化特征,对牛角瓜不同叶位叶片光合能力进行了研究。结果表明:牛角瓜上下叶位叶片光合速率呈双峰曲线,中叶位呈单峰曲线,上叶位叶片有光合“午休”现象,气孔导度与净光合速率日变化趋势基本一致。各叶位叶片的净光合速率、蒸腾速率、气孔导度、气孔限制值日变化由高到低依次均为上叶位、中叶位、下叶位;胞间CO2浓度呈相反趋势,由高到低依次为下叶位、中叶位、上叶位。研究发现,牛角瓜不同叶位全天最大净光合速率值出现在9:00~10:00,光合“午休”主要是由于叶肉细胞羧化能力下降引起的;除光照因素外,气孔导度是影响光合速率的主要因子。
牛角瓜;叶位;日变化;净光合速率
干热河谷地区位于长江上游,由于该区太阳辐射较强,光热充足,干湿分明,全年蒸发量为降水量的6倍左右,是我国具有代表性的生态脆弱区和极端造林困难地带,是我国生态环境建设的核心[1]。因此耐干热适生树种的选择是维持该区生态的重要途径。
牛角瓜Calotorpis gigantea别名断肠草、羊浸树,为萝藦科牛角瓜属常绿灌木或小乔木。其外部形态和大牛角瓜极相似,一般高2 m,花为淡紫色。主要分布在广东、广西、四川和云南的低海拔向阳山坡、旷野和海边,具有耐干旱瘠薄,不怕洪水冲刷的特性,是干热河谷绿化的好树种[2]。茎皮纤维可制人造棉、纸、绳索等,种毛可做丝绒原料及填充物[3];乳汁中的多种苷和碱可被用于治疗皮肤癣、痢疾、风湿等疾病[4-6],具有强心[7]、保肝[8]、镇痛消炎[9]等功效。植物的光合特性不仅与自身的株高、地径等有关[10],还在较大程度上受生态环境的影响[11]。光合速率高低、光合功能期长短、光适应范围等均会影响到作物的生长状况和产量[12]。由于外界环境的不断变化和植物内部发育节律的调控,植物的光合生理特性也在不断变化[13]。对经济林树种的叶片进行光合特性指标的测定,有助于快速了解该林木的生长规律,从而能更有针对性地对林木进行常规的园地管理[14],从而更好地开发植物资源[15]。目前,对牛角瓜的研究主要集中在组织培养等方面[16],对牛角瓜光合生理方面的研究报道较少,且有关牛角瓜不同叶位光合特性差异的研究尚未见报道。因此,本试验中以1年生牛角瓜为试验材料,对不同叶位叶片光合特性的动态变化进行比较研究,以期为牛角瓜的高产优质栽培提供理论依据。
1 研究区自然概况
元江哈尼族彝族傣族自治县位于云南省的中南部,本次试验在元江自治县的种苗管理工作站内进行。地理坐标为东经 101°58′9.7″、北纬 23°36′3″,海拔380 m。元江自治县地处低纬度高原,是云南亚热带北部与亚热带南部的气候过渡地区,年平均气温为23.8 ℃,年平均降雨量3.148×109m3。县内旱季(11~4月)和雨季分明(5~10月),年内极端最高气温为42.5 ℃,极低气温为-7 ℃。
2 材料与方法
2.1 供试材料
试验材料为1年生牛角瓜实生苗,试验田地势平坦,栽培密度为2 m×3 m,常规水肥管理。
2.2 测定方法
试验在2014年5月连续多日晴朗无云的天气进行,牛瓜株高167cm左右,节间数15,采用LI-6400型便携式光合测定仪进行光合指标的测定。试验在连体条件下进行,选用开路气流法(气源引自地上空3 m处),自然光源,2cm×3cm透明叶室。选取大小、体形特征一致的植株5株,从上往下数第2位叶(上位叶)、第5位叶(上中位叶)、第8位叶(下位叶),每株按东、西、南、北4个方向各选4片成熟叶片,擦去背部绒毛,从当地时间8:00至18:00每隔1 h测1次净光合速率(Pn),同时测定叶片气孔导度(Gs)、叶室内的光合有效辐射强度(PAR)等相关指标,每个指标平行测定3次,剔除极值后取平均值作为结果。
本次试验中测定的叶片生理因子有净光合速率(Pn)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、气孔导度(Gs)等;环境因子有大气温度(Ta)、相对湿度(Hr)、光合有效辐射(PAR)、田间CO2浓度(Ca)等。气孔限制值(Ls)计算公式:Ls= 1-Ci/Ca。
2.3 数据处理
试验的原始数据采用Excel2007软件进行统计分析并作图,用SPSS11.0软件进行方差分析。
3 结果与分析
3.1 牛角瓜不同叶位生态因子的差异
牛角瓜不同叶位生态因子如图1所示。由图1可见,在 7:00~ 18:00期间牛角瓜冠层PAR的日变化有所不同,上叶位为“单峰”曲线,中叶位和下叶位PAR相似,均为“双峰”曲线。PAR的日变化波动范围为83.28~1 412.02 μmol·m-2,在 7:00 ~ 8:00 时间内,上叶位PAR急剧增加,8:00~9:00上升缓慢,9:00~ 10:00呈急剧上升趋势,PAR 在 11:00达到全天最高值1 412.02 μmol·m-2,之后呈下降趋势,18:00 降至 139.4 μmol·m-2。中叶位和下叶位在7:00~10:00期间呈上升趋势,均在 10:00 到达峰值 1 159.7 和 1 122.82 μmol·m-2,之后中叶位和下叶位PAR开始下降,中叶位12:00降 至 谷 值 828.59 μmol·m-2,12:00 ~ 13:00缓慢上升至1 139.4 μmol·m-2,过后呈下降趋势,至14:00有所回升,直至15:00达到第2峰值1 149.93 μmol·m-2后开始急剧下降。下叶位第1峰值过后逐渐下降,14:00至谷值662.58 μmol·m-2,过后有所回升,15:00 过后逐渐下降,18:00 达到全天最低值 83.28 μmol·m-2。
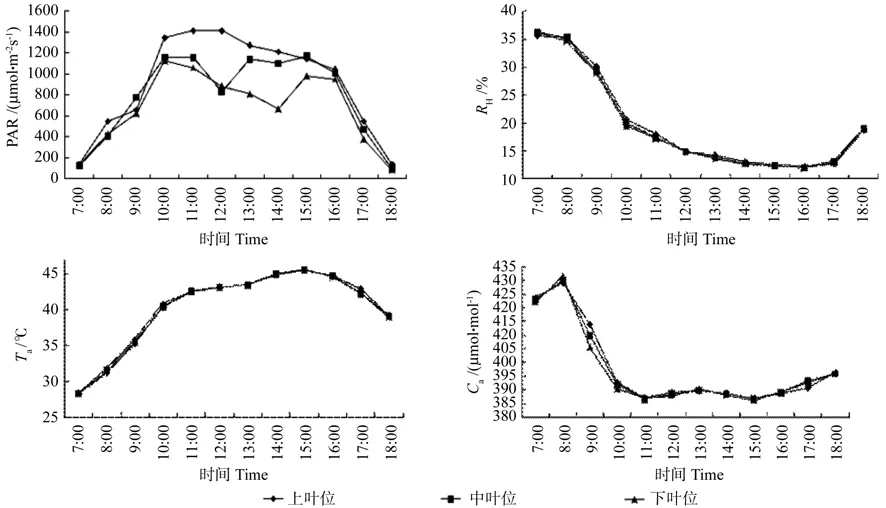
图1 牛角瓜试验地的环境因子日变化Fig. 1 Diurmal variations of environmental factors at C. gigantea test fi eld
在7:00~11:00期间,各叶位Ta由高到低依次为上部叶位、中部叶位、下部叶位,12:00~18:00期间Ta表现与上午恰好相反,表现为下部叶位Ta最大,上部叶位Ta最小。不同叶位Ta全天波动较小,变化局限在1 ℃以内。上、中、下叶位叶片Ta变化趋势基本一致,全天变动范围在28.32~45.55 ℃之间,7:00时最低,到15:00左右,达到最高温度45.5 ℃左右。
牛角瓜不同叶位叶片Hr的日变化趋势基本一致,呈“单谷”型曲线,Hr最高值出现在7:00,上、中、下叶位相差不大,分别为35.49%、36.13%、36.21%。此后随着Ta升高而下降,到16:00降到最低值11.92%~12.26%,之后Hr有所回升,至18:00上升到18.8%~19.02%,不同叶位Hr全天差异不大。
田间CO2浓度也呈现规律性变化。7:00~8:00呈逐渐上升趋势,8:00之后急剧下降,11:00降至全天最低值(386.7 ~ 387.07 μmol·mol-1),而后全天CO2浓度有所回升,13:00缓慢下降,15:00又开始升高。Ca日变化范围不大,7:00~8:00,各叶位Ca由低到高依次为上部叶位、中部叶位、下部叶位。8:00~ 15:00,各叶位Ca由高到低依次为上部叶位、中部叶位、下部叶位。16:00过后中叶位Ca值略大于上叶位和下叶位。
3.2 牛角瓜不同叶位叶片光合作用特征的差异
3.2.1 不同叶位叶片净光合速率(Pn)日变化特征
牛角瓜不同叶位叶片Pn的日变化如图2所示。由图2可知,牛角瓜不同叶位叶片光合日变化在7:00时相差无几,7:00~ 10:00上叶位和中叶位叶片Pn逐渐升高,并且在10:00达到全天峰值,分别为 19.93和 16.77 μmol·m-2s-1。下叶位叶片Pn峰值出现在 9:00,为 9.56 μmol·m-2s-1。上叶位、中叶位和下叶位叶片Pn峰值过后均呈现下降趋势,所不同的是上叶位11:00过后急剧下降,在 12:00 形成谷值 14.83 μmol·m-2s-1,过后逐渐回升,15:00继续下降;下叶位在15:00有所回升,16:00后下降。上叶位为双峰曲线,Pn第1峰值出现在 10:00,第 2 峰值出现在 15:00,12:00 出现低谷,中叶位叶片Pn峰值出现在10:00,过后呈缓慢下降趋势;下叶位第1峰值出现在9:00,第2峰值出现在10:00,15:00出现低谷。不同叶位叶片的Pn日平均值由大到小依次为上叶位(14.85 μmol·m-2s-1)、中叶位(10.77 μmol·m-2s-1)、下叶位(5.96 μmol·m-2s-1)。方差分析结果表明,上叶位、中叶位和下叶位叶片的Pn值之间存在极显著差异(p<0.01)。
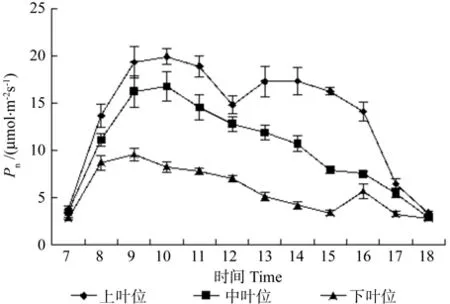
图2 牛角瓜不同叶位叶片净光合速率(Pn)的日变化Fig. 2 Diurnal variations of leaf net photosynthetic rate(Pn) at different C. gigantea leaf positions
3.2.2 不同叶位叶片蒸腾速率(Tr)日变化特征
牛角瓜不同叶位叶片Tr的日变化如图3所示。由图3可知,7:00过后,3个叶位叶片的Tr迅速上升,上叶位蒸腾速率呈现3峰曲线,第1峰值在11:00出现,第2峰值在14:00出现,第3峰值在16:00出现,分别为 12.37、15.13、12.58 mmol·m-2s-1。中叶位叶片Tr在11:00到达峰值10.24 mmol·m-2s-1后,开始逐渐下降,直至13:00开始回升,达到第2峰值10.39 mmol·m-2s-1,之后呈下降趋势。下叶位全天最高值出现在 12:00,为 6.62 mmol·m-2s-1,全天最低值在 13:00,为 4.93 mmol·m-2s-1。比较不同叶位的Tr日平均值,由大到小依次是上叶位(9.72 mmol·m-2s-1)、中叶位(7.78 mmol·m-2s-1)、下叶位(4.89 mmol·m-2s-1)。不同叶位之间差异极显著(p<0.01)。
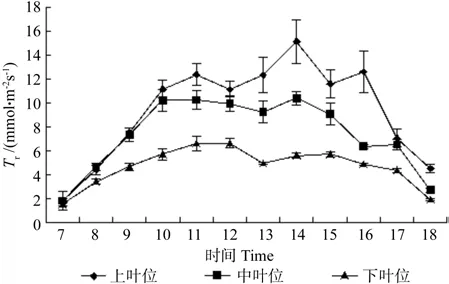
图3 牛角瓜不同叶位叶片蒸腾速率(Tr)的日变化Fig. 3 Diurnal variations of leaf transpiration rate (Tr) at different C. gigantea leaf positions
3.2.3 不同叶位叶片气孔导度(Gs)日变化特征
Gs一般随温度的上升而增大,温度对Gs的影响可能通过影响呼吸作用和光合作用,改变叶内CO2浓度而起作用。牛角瓜不同叶位叶片Gs的日变化如图4所示。由图4可知,各叶位叶片Gs由高到低依次为上叶位、中叶位、下叶位。
3.2.4 不同叶位叶片气孔限制值(Ls)日变化特征
牛角瓜不同叶位叶片Ls的日变化如图5所示。由图5可知,不同叶位叶片的Ls变化趋势基本一致,上、中、下叶位均呈现“3峰”,上、中叶位叶片Ls首峰均出现在 11:00,而下叶位出现在 10:00,3 个 叶 位 的 第 2、3峰 值 分 别 出 现 在 13:00、16:00。在 7:00 ~ 10:00 中,各叶位叶片Ls由高到低依次为上叶位、下叶位、中叶位。各叶位叶片Ls日平均值由高到低依次为上叶位(0.45%)、中叶位(0.43%)、下叶位(0.40%),与Ca相同,与Ci相反。
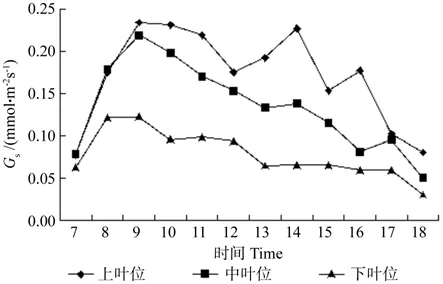
图4 牛角瓜不同叶位叶片气孔导度(Gs)的日变化Fig. 4 Diurnal variations of leaf stomatal conductance(Gs) at different C. gigantea leaf positions
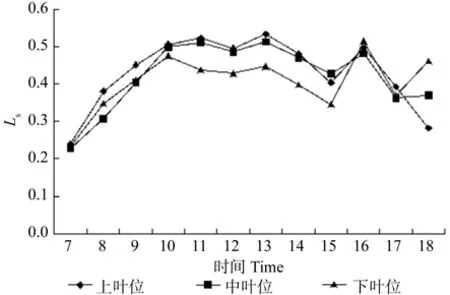
图5 牛角瓜不同叶位叶片气孔限制值(Ls)的日变化Fig. 5 Diurnal variations of leaf stomatal limited value(Ls) at different C. gigantea leaf positions
3.2.5 不同叶位细胞间隙CO2浓度(Ci)日变化特征
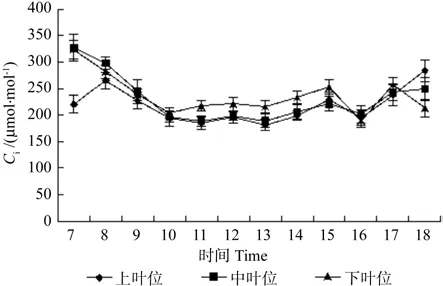
图6 牛角瓜不同叶位叶片细胞间隙CO2浓度(Ci)的日变化Fig. 6 Diurnal variations of leaf Inter cellular CO2 concentration(Ci) at different C. gigantea leaf positions
牛角瓜不同叶位叶片Ci的日变化如图6所示。由图6可知,中叶位和下叶位叶片Ci在7:00均高于上叶位,7:00~8:00过程中上叶位叶片胞间CO2浓度处于上升阶段,8:00过后下降,各叶位趋势基本一致,上、中叶位叶片Ci在10:00降至全天最低值,分别为 193.71、196.16 μmol·mol-1,下叶位最低值出现在 16:00,为 188.46 μmol·mol-1,各叶位10:00与16:00值相差不大。16:00过后,上、中、下叶位叶片Ci均呈上升趋势。从不同叶位叶片Ci日平均值看,由高到低依次为下叶位(239.58 μmol·mol-1)、中叶位(228.54 μmol·mol-1)、上叶位(211.99 μmol·mol-1)。不同叶位之间差异不显著。
4 讨 论
4.1 不同叶位牛角瓜叶片光合有效辐射变化趋势
影响植物生长的诸多生态因子之中,光因子是最重要的[17]。光不仅能促使叶绿素的形成,还调控植物叶片内光合酶的活性以及叶片表面的气孔导度。本研究中环境因子指标中上、中、下叶位叶片除PAR趋势不同,其它指标趋势基本一致。上叶位叶片受光条件好,全天无遮蔽,而中层和下层由于入射光角度的缘故,测定部位受临近叶片部分遮阴,叶片接受的光照相对于上层弱[18],树木冠层的叶片吸收红光和蓝光比较多,造成树冠下的光线绿光较多。对于植物的光合作用而言绿光是低效光,因而使本来就光照不足的树冠下层的叶片光合很弱,生长受到抑制[19],因此各叶位日均PAR由高到低依次为上叶位、中叶位、下叶位。
4.2 不同叶位牛角瓜叶片净光合速率变化趋势
植物光合能力的强弱取决于Pn的高低[20]。3个叶位叶片Pn存在明显差异,上叶位PAR呈稳定平滑曲线,仅有1个峰值,而光合速率有“午休”现象,中叶位的辐射出现谷值,并未导致光合速率大幅度下降,中下叶位叶片Pn呈现出平滑曲线。除了受PAR影响外,Pn还受叶龄,发育状况以及外部环境因素的影响,上部和中部叶片发育成熟,叶绿素含量高,下部属于老龄叶片,一些机能开始有所下降,因此,各叶位叶片日均Pn由高到低依次为上叶位、中叶位、下叶位。清晨随着光强度增高,田间CO2浓度和Hr逐渐降低,叶片吸收的光能增多,光化学反应速率随之加快,同化力增加,Pn明显升高,上叶位叶片在12:00出现低谷又回升。其原因为,干热河谷午间炎热,光照强烈,上叶位叶片受辐射强,叶片蒸腾失水加剧,此时土壤水分亏缺,植物失水大于吸水,叶片出现轻微的萎蔫,使叶片吸收CO2减少,产生“午休”现象,因此呈现出暂时下降之后回升的情况。14:00 ~ 15:00 时,Hr持续下降,Ta上升到全天最大值,从而加速了叶内酶的钝化和失活,光呼吸强度下降,是Pn形成第2个谷值的原因。中层和下层叶片光照没有上层多,因此没有“午休”现象。与高柱等对干热河谷牛角瓜光合特性[16]的研究基本一致。上午和下午光强相同的情况下,牛角瓜下午的光合速率要低于上午,这是因为上午光合产物有所积累,产生反馈抑制。PAR所差无几,PAR 上叶位 8:00 > 17:00、10:00 > 14:00;中叶位 10:00 > 15:00;下叶位 9:00 > 14:00。
4.3 不同叶位牛角瓜叶片光合速率降低原因
光合速率降低可能是气孔导度降低的结果,也可能是气孔导度降低的原因,必须依据叶肉细胞间CO2浓度变化来判断[21]。上叶位的Gs与Pn趋势基本一致,上叶位叶片在10:00~12:00和14:00~15:00过程中,Pn和Gs是下降趋势,且在12:00、15:00达到谷值,同时胞间CO2升高趋势,说明上叶位叶片光合速率2次降低并非气孔关闭引起的,导致了气孔导度降低。Pn降低并非气孔关闭引起的,主要原因是叶肉细胞光合活性降低。Farquhar的研究也表明,只有当净光合速率和胞间CO2浓度二者同时减小,且Ls增大时,Pn下降才可认为是由气孔关闭引起的,否则是叶肉细胞羧化能力的降低导致Pn下降[22]。由图4和图2、图5、图6对比所知,2次谷值的形成均是Pn下降,Ci上升,Ls上升后下降导致,说明Pn降低受非气孔因素引起。牛角瓜上、中、下叶位PAR下降时间分别是 12:00、11:00、10:00 之后,而上、中、下叶位叶片Pn下降时间是在上午 10:00、10:00、9:00过后,气孔导度均在9:00过后下降。PAR上升阶段,Pn和Gs却下降,证明Gs和Pn下降并非光抑制引起的。与此同时Ci上升,Ls上升后下降,证明Gs并非Pn的决定因素。因此上叶位光合速率迅速下降是由于羧化效率的降低导致的。
4.4 不同叶位牛角瓜叶片蒸腾速率
蒸腾速率是林木水分平衡的重要生理指标及重要水分的参数,它不仅能反映出树种在干旱环境下的适应能力,还能映出其调节自身水分损耗的能力[23]。田晶会等人对黄土半干旱区侧柏蒸腾作用及其与环境因子的关系进行研究发现,环境因子中气温对蒸腾作用影响较大[24]。将本研究中牛角瓜不同叶位叶片的Gs和Tr日变化曲线图进行对比,3个叶位叶片Gs和Tr谷值出现的时间点一样,3个叶位Tr在正午时间下降是因为午间辐射强,温度高,湿度低。牛角瓜在午间高温度和辐射的条件下,叶片气孔的选择性关闭是植物在干热河谷长期进化的结果,表现出与环境之间具有一定的相适性。
5 结 论
(1)牛角瓜上、下叶位Pn为“双峰”曲线,中叶位为“单峰”曲线。全天最大Pn,上、中叶位出现在10:00,下叶位出现在9:00。各叶位每一时段的Pn由高到低依次均为上叶位、中叶位、下叶位。
(2)牛角瓜上叶位叶片Pn存在“午休”是由于叶肉细胞羧化能力下降引起的,各叶位Ci日平均值由高到低依次为下叶位、中叶位、上叶位,各叶位之间相差不大。各叶位Ls日平均值由高到低依次为上叶位(0.45%)、中叶位(0.43%)、下叶位(0.40%),与Ca相同,与Ci相反。
(3)叶幕层间差异大小主要取决于光照,因此提高单叶Pn,延迟叶片衰老,降低光抑制现象是着手解决的问题,适时合理灌溉,增加田间湿度,促进植物蒸腾,从而达到降低温度的效果。
[1]赵 琳,郎南军,郑 科,等.云南干热河谷生态环境特性研究[J].林业调查规划,2006,31(3):114-117.
[2]许亚生.牛角瓜[J].中国水土保持,1990,(1):33.
[3]高 柱,王小玲.牛角瓜开发价值及栽培技术研究[J].北方园艺 ,2011,(18):22 - 206.
[4]Lhinhatrakool T, Sutthivaiyakit S. 19-Nor-andl8,20-Epoxy-cardenolides from the leaves ofCalotropis gigantea[J]. Journal of Nature Products, 2006,69(18):1249 - 1251.
[5]Kiuchi F, Fuakao Y, Obata T,et al.Cytotoxic Principles of a Bangladeshi Crude Drug, Akond Mul (Roots ofCalotropis giganteaL)[J]. Chemical Pharmaceutical Bulletin, 1998, 46:528-530.
[6]Quaquebeke E V, Simon G, AndreA,et al.Identification of a Novel Cardenolide (2-Oxovoruscharin) fromCalotropis proceraand the Hemisynthesis of Novel Derivaltives Displaying Potent in vitro Antitum or Activities and Highin VivoTolerance:Structure-activity Relationship Analyses[J]. J Med Chem, 2005, 48(3): 849 - 856.
[7]ARGAL A, PATHAK A K. CNS activity ofCalotropis gigantearoots[J]. Journal of Ethnopharmacology,2006,106(1):142 - 145.
[8]PADHY B M, SRIVASTAVA A, KUMAR V L.Calotropis proceralatex affords protection against carbon tetra chloride induced hepatotoxicity in rats [J]. Journal of Ethnopharmacology,2007,113(3):498 - 502.
[9]BASU A, NAG CHAUDHARI A K. Preliminary studies on the antiin fl ammatory and analgesic activities ofCalotropis proceraroot extract [J]. Journal of Ethnopharma cology, 1991, 31(3):319-324.
[10]杨雨华,宗建伟,杨风岭.不同生长势马尾松光合日变化研究[J].中南林业科技大学学报,2014,34(8):25-29.
[11]杨柳青,张 柳,廖飞勇,等.低温胁迫对南美天胡荽光合作用和叶绿素荧光的影响[J].经济林研究, 2014,34(4):99-102.[12]姜 武,沈志军,姜卫兵,等.不同季节水蜜桃品种光合特性生理指标的比较[J].江苏农业学报,2008,24(3):321-330.
[13]李映雪,谢晓金,李永秀,等.3种彩叶植物光合生理特性的差异[J].东北林业大学学报,2009,37(5):64-66.
[14]孟德悦,吴海勇,刘光斌,等.不同种源无患子光合与蒸腾速率差异分析[J].经济林研究,2013,31(2):48-53.
[15]梁文斌,刘卫东,聂东伶,等. 短梗大参的光合特性研究[J].中南林业科技大学学报, 2015,35(2):6-11.
[16]李克烈,罗联忠,陈 伟,等.牛角瓜的组织培养[J].广西农业生物科学,2007,26(3):247-249.
[17]殷东生,周志军,郭树平.光照对沙棘幼苗生长、生物量分配及光合特性的影响[J].经济林研究,2014,32(3):48-52.
[18]杨江山.樱桃叶片的光合特性研究[J].甘肃农业大学学报,2006, 41(4):49 - 51.
[19]李和生.现代植物生理学[M].北京:高等教育出版社, 2010:182-184.
[20]申文辉,李志辉,彭玉华,等.格木不同种源光合作用光响应分析研究[J].中南林业科技大学学报,2014,34(6):13-18.
[21]许大全.光合作用测定及研究中一些值得注意的问题[J].植物生理学通讯,2006,42(6):1163-1167.
[22]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Rev Plant Physiol,1982,33:317 - 345.
[23]段爱国,张建国,张守攻,等.干热河谷主要植被恢复树种蒸腾作用[J].生态学报,2009,29(12):6691-6701.
[24]黄 滔, 唐 红, 廖菊阳, 等. 长果安息香夏季光合蒸腾日变化与其环境因子的关系[J].中南林业科技大学学报,2015,35(7): 62 - 68.
Diurnal variations of photosynthetic characteristics at differentCalotropis gigantealeaf positions at dry-hot valley areas
HUANG Bei, LIU Hui-min, WANG Lian-chun, LIU Peng, SHU Jiao-jing
(Southwest Forestry University, Kunming 650224, Yunnan, China)
In order to provide a basis for high-quality cultivation and fi eld management ofCalotropis gigantea, diurnal variation of leaf photosynthetic characteristics at differentC. gigantealeaf positions were observed and determined by using portable LI-6400 photosynthesis system in may 2014 at dry-hot valley areas of Yuanjiang, and leaf photosynthetic ability at differentC. gigantealeaf positions were researched. The results showed that the curves of diurnal variation of net photosynthetic rate (Pn) of leaves at upper and lower leaf positions had double peaks, and that at mid-position had single peak. The leaves at upper leaf position had the midday depression of photosynthesis. The trend of diurnal variation of Stomatal conductance was consistent with that of net photosynthetic rate. All of the orders of leaf positions based on diurnal variations of net photosynthetic rate, transpiration rate, stomatal conductance and stomatal limited value from high to low, were the upper leaf positions, the mid-position, the lower leaf positions. Inter cellular CO2concentration showed a contrary trend, and the order was the lower leaf positions, the mid-position, the upper leaf positions from high to low. The results indicated that the maximum values of net photosynthetic rate (Pn) at different leaf positions appeared at 9:00-10:00, and the midday depression was mainly due to decreasing carboxylic ability of mesophyll cells; In addition to the illumination factor, stomatal conductance was the main factor affecting the rate of photosynthesis.
Calotropis gigantea; leaf position; diurnal variation; net photosynthetic rate
S66;Q945.11
A
1003—8981(2015)04—0038—06
10.14067/j.cnki.1003-8981.2015.04.006
2014-10-11
国家林业局公益性行业科研专项(201304810);西南林业大学云南省重点学科项目(xkz200906)。
黄 北,硕士研究生。
刘惠民,博士,教授,博士研究生导师。E-mail:hmliu@swfu.edu.cn
黄 北,刘惠民,王连春,等.干热河谷地区牛角瓜不同叶位光合日变化特征[J].经济林研究,2015,33(4):38-43.
[本文编校:闻 丽]

