血管内超声图像后处理综述
孙 正
(华北电力大学电子与通信工程系,河北 保定 071003)
血管内超声图像后处理综述
孙 正
(华北电力大学电子与通信工程系,河北 保定 071003)
血管内超声显像是目前临床常用的诊断血管病变的介入影像手段,可在活体中观察血管壁和管腔的形态,以及斑块的形态和成分。采用数字图像处理技术,对血管内超声图像序列进行自动或半自动地处理和分析,对于血管病变的计算机辅助诊断和制定最佳诊疗方案具有重要意义。本文就近年来血管内超声图像计算机后处理的研究现状进行综述,包括图像分割和组织标定、运动伪影的抑制、血管的三维重建、血管形态和血流动力学参数的测量、组织定征显像及与其他影像的融合等,评价了目前的研究情况,并对未来的研究提出了展望。
血管内超声;图像分割;运动伪影;三维重建;组织定征显像;图像融合
血管内超声(intravascular ultrasound, IVUS)是目前临床常用的微创血管内成像技术,能在活体中描述血管壁复杂的解剖结构。除了评估管腔狭窄程度之外,还可进一步检测粥样硬化斑块的易损性和斑块负荷。它在动脉粥样硬化的研究和临床评估中起着至关重要的作用[1],该技术在临床应用已超过15年,积累了大量临床研究资料[2]。
标准的IVUS成像系统获取的是单张横断面图像(B-模式)集合而成的图像序列,前后帧之间具有很强的相关性。如图1所示,血管壁在横向视图上呈现回声不同的三层环形结构[3]:超声导管始终位于图像中心,周围由内而外依次为管腔、血管壁内膜及内弹性膜(强回声亮环)、中膜(低回声暗区)、外膜和外弹性膜(较亮的强回声带)和毗邻结构。如图2所示,异常IVUS显像表现为4类不同成分的斑块[3]:①脂质斑块,透声性强,表现为低回声区;②纤维性斑块,回声强度与钙化性斑块相近,但其后无负性声影;③钙化性斑块,回声很强,强回声后有负性声影;④混合性斑块,同时具有两种以上斑块的声学特征。使用马达驱动的自动回撤系统回撤超声导管,可获得血管的纵向视图(L-模式)。由于心脏运动等因素,冠状动脉内超声的纵向视图中会出现“锯齿样”特征性的伪影[4]如图3所示。

图2 IVUS图像中不同的斑块组织

图3 IVUS纵向视图
IVUS图像序列的数据量巨大,且由于采用高频超声探头,图像受噪声污染严重,对比度低,存在多种影响视觉效果的伪影。若由医生手动完成对图像的分析和解读(包括找出存在病变的图像、提取血管壁内外膜(包含斑块)的边缘、对血管腔、血管壁和斑块组织的形态进行定量测量以及分析斑块成分等),则是一项非常繁琐的工作,而且结果易受操作者的专业知识和临床经验的影响。利用先进的计算机技术和图像处理技术,对IVUS图像进行自动分析和处理,可获得精确、客观、可重复性高的分析结果。
目前,对IVUS图像序列进行后处理的研究内容主要包括:图像的分割和组织标定、抑制运动伪影、定量测量血管形态和血流动力学参数、三维重建血管、血管组织定征显像,以及与其他影像的融合等。本文从上述几方面就近年来IVUS图像计算机后处理的国内外研究现状进行简要概述,并对该领域的发展方向进行展望。
1 图像的分割和组织标定
1.1 提取血管壁轮廓
对IVUS图像进行分割,提取出血管内腔-斑块边界和血管壁中-外膜边界,是定量测量血管形态和血流动力学参数、三维重建血管以及IVUS与其他影像融合的必要步骤和保证其精度的关键。
由于IVUS图像一般受噪声污染严重,包括斑点噪声、伪影和部分血管壁钙化阴影等的影响,常规的灰度图像轮廓提取方法,如微分法等,难以获得满意结果。
半自动方法包括图搜索[5]、活动轮廓模型及其相关改进算法[6]等,其分割效果较常规方法有很大提高,但仍需操作者一定程度的手动参与,可能延长处理时间或引入误差。
已提出的全自动分割方法包括:基于统计活动轮廓模型的方法[7]、基于模糊聚类的方法[8]、自动获得初始轮廓的 snake方法[9]、概率统计分割内腔的方法[10]、基于纹理分析的方法[11]、形状驱动方法[12]、多智能体方法[13]、基于 contourlet变换的snake方法[14]、二值形态学重建方法[15]、基于对中膜层整体解释的方法[16]和基于快速推进的方法[17]等。上述方法都是在二维空间中对横截面图像序列进行串行处理,即逐帧分割。
近年来,三维分割技术[18]成为该领域新的研究方向,如图4所示。与二维分割相比,其优势在于可以利用整个图像序列的信息,实现对序列的并行处理,提高处理效率。
对由超声信号重建出的灰度图像进行分割,其局限性在于重建出的灰度图像内容很大程度上取决于IVUS的系统参数设置[3]。为了克服该不足,近年来研究者开始探讨利用原始超声射频信号(radio frequency, RF)完成对IVUS图像的分割[19]。但是并非所有IVUS成像系统都允许对原始射频信号进行采集,因而限制了此类方法的临床应用。

图4 IVUS图像的三维分割示意图[18]
1.2 斑块的识别和分类
在完成血管壁内、外膜轮廓的提取之后,对异常图像中的斑块组织进行正确地自动识别和分类,对于评价斑块的易损性、预测其进展以及选择适当的治疗方案具有重要意义。根据所采用的数据类型的不同,现有的方法可分为2类:
(1) 基于图像的方法,即分析灰度图像的纹理特征变化,同时结合不同斑块特征的先验知识,完成对斑块组织的标定[20]。由于斑块的组织构成多变以及超声显像自身的局限性等诸多因素的影响,以IVUS灰阶图像判断斑块性质的准确性和可重复性较差,尚难以严格区分纤维性、脂质性和纤维脂质混合性斑块。
(2) 对超声导管采集的原始射频信号进行分类,完成对不同斑块组织的识别[21];或者在利用射频信号重建灰度图像的同时,通过分析纹理特征完成对血管壁组织的分类[22]。但是,如前所述,其局限在于并非所有临床使用的IVUS成像系统都允许采集原始射频信号。
1.3 小 结
考虑到IVUS图像序列的数据量巨大和图像质量差等因素,实现全自动的图像分割和组织标定是未来的发展方向。但是,由于医生在手动分割图像和标定斑块时使用了大量的专业知识和临床经验,所以没有任何一种自动分割和标定方法能达到人类视觉系统的水平。因而,结合手动操作的交互式方法仍然是目前的主要发展方向。
2 抑制运动伪影
在进行冠状动脉内超声成像的过程中,心脏运动和管腔内搏动的血流会导致位于导管顶端的超声传感器在管腔长轴方向产生纵向位移,且导管相对于管腔的角度也会有所改变。此外,血管的腔径在心动周期中亦呈现特征性变化[3]。在这些因素的共同作用下,连续回撤超声导管采集的血管腔横断面图像序列的灰度特征存在周期性变化,这种现象就是由心脏运动所致的运动伪影,在纵向视图中表现为血管壁边缘呈锯齿形,在横向视图中表现为相邻帧之间管腔横截面的错位,如图5所示。运动伪影是影响IVUS纵向视图的视觉效果、测量血管形态参数以及血管三维重建精度的主要因素。

图5 IVUS纵向和横向视图中的运动伪影[23]
2.1 心电门控
目前临床主要采用心电(electrocardiogram, ECG)触发技术减少运动伪影,包括2种方式:
(1) 前瞻性心电触发[24]:需要专门的ECG触发图像采集装置。与连续回撤导管的采集方式相比,图像采集时间延长至少三倍[25]。仅能获得一个特定心脏时相(通常是R波)的图像序列。
(2) 回顾性心电门控:根据同步记录的ECG信号,从连续回撤超声导管采集的图像序列中选取每个心动周期内预设定时相(通常是R波)的图像组成门控子序列。其缺点是:ECG与IVUS图像的采集不可能完全同步;目前没有一个公认的明确标准来确定采用心动周期中的哪一时刻作为最佳采样点,可获得最大帧间稳定度[26]。
2.2 基于图像的门控
考虑到 ECG门控技术在抑制运动伪影方面的上述不足,近年来,运用数字图像处理技术,通过分析IVUS图像灰度特征的周期性变化,从图像序列中选取在各心动周期的相同心脏时相(通常是R波)采集的图像,组成同步采样序列,即基于图像的门控(image-based gating)技术,如图6所示,逐渐成为解决该问题的热点方法[25-28]。该方法无需门控图像采集装置,也无需利用 ECG信号,虽然可以避免 ECG门控的缺点,但是由于每个心动周期只选择一帧,可能会丢失很多有诊断价值的信息。
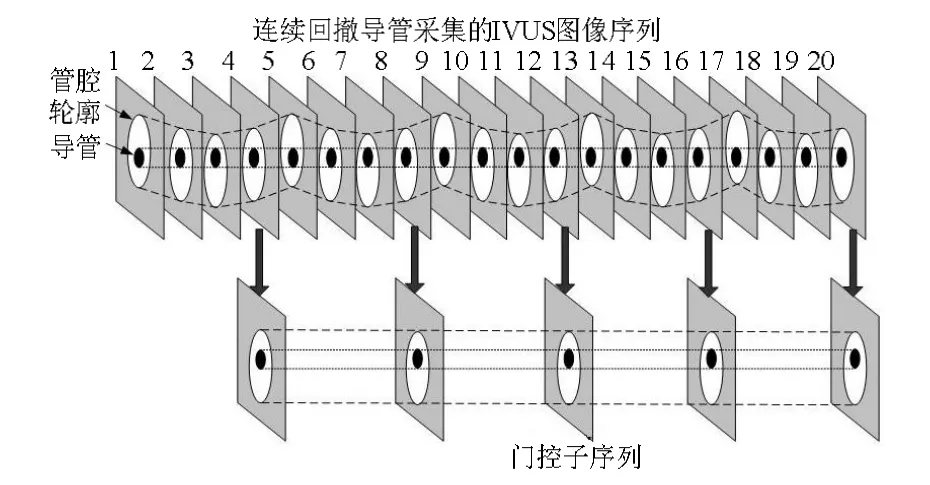
图6 基于图像的门控示意图[27]
2.3 直接抑制方法
针对门控技术抑制运动伪影的不足,近年来研究者开始探讨对IVUS灰度图像序列直接进行运动补偿的方法。目前提出的方法主要包括以下4类:
(1) 利用射频信号[29]:即根据原始射频信号分析图像灰度的变化。由于射频信号是基于极坐标系的,因而此类方法只考虑图像平面内的旋转运动。同时,并非所有临床使用的IVUS成像系统都允许采集原始射频信号。
(2) 光流法(optical flow)[30]:运动估计结果对图像中存在的噪声非常敏感,且极易受到血流随机运动的干扰[31]。
(3) 块匹配法(block matching)[32]:需要明显的标志物(例如钙化、血管分叉等),而此类标志并非在每帧图像中都存在。
(4) 运动模型法:通过跟踪血管腔轮廓的椭圆近似[23];或者由图像灰度特征估计出的血管质心[33]来估算运动参数。
此类伪影抑制方法既不借助ECG信号,也不需要抛弃有用帧,在抑制运动伪影的同时,还可保证图像数据集合的完整性,因而是未来的主要发展方向。
3 血管的三维重建
早期的血管三维重建方法是把一系列的 IVUS图像按照采集顺序等间距叠加起来形成三维直血管段[34]如图7所示,不考虑血管本身的弯曲和扭曲、超声导管在回撤过程中的扭曲和滑动所造成的图像旋转和信息丢失、以及由于心脏运动所导致的运动伪影等。由于IVUS本身不能提供每一帧切片图像的空间信息和定位导管回撤路径,因而此类方法往往将弯曲的血管重建成直的血管,其结果是不准确的。

图7 IVUS图像序列中的血管直接重建结果[34]
由于在进行IVUS检查的过程中,X线血管造影和IVUS分别同步显示导管探头在管腔内的部位和相应血管壁的结构形态,因而可采用一对近似正交的造影图像对导管的回撤路径进行精确定位,将由造影图像获得的超声导管和管腔长轴方向的三维几何信息与由IVUS图像获得的管腔横截面信息相融合,三维重建血管,充分发挥两种成像手段的优势,克服分别独立采用二者重建血管时的不足,如图8所示。文献[35-38]是代表性方法,主要不足在于确定各帧IVUS图像的空间方向时,从造影图像中重建出的三维血管腔模型或造影中的管腔轮廓或轴线作为基准,采用优化的方法求得各帧IVUS图像的最优空间方向。而基于造影图像的三维重建本身就存在误差(例如,重建时一般假设管腔横截面为椭圆,而事实上当发生狭窄时管腔的形状通常复杂多样),且在反投影的过程中,可能再次引入成像系统参数的误差。
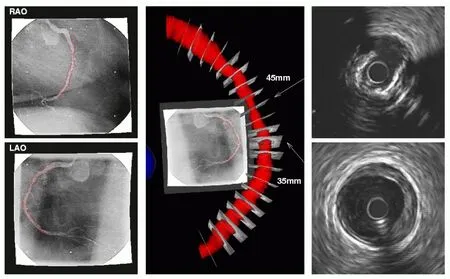
图8 基于血管造影和IVUS图像融合的重建结果[37]
更重要的是,目前对冠状动脉内超声图像序列中血管三维重建的研究仅限于重建某一个时相(通常是舒张末期)的血管。而研究冠状动脉血管组织的生物力学特性、分析血管壁受到的由搏动血流引入的应力应变分布情况、建立血管弹性图等,都需要分析动脉血管在心动周期中不同时刻的变形,因而限制了IVUS在此方面的应用。
利用同步采集的、覆盖多个心动周期的冠状动脉内超声图像序列和一对近似正交的血管造影图像序列对靶血管段进行动态三维(四维,即三维+时间)重建,再现冠状动脉血管(包含可能存在的斑块)在心动周期中各时相的真实形态,是未来的主要发展方向。同时,对重建结果精度的定量评价也是需要解决的关键问题,目前一般采用仿体实验或动物(如猪)心脏的体外实验,但是制作可真实模拟人体搏动状态下的血管仿体是非常困难的,动物体外实验同样存在不能模拟搏动的动脉血管问题。
4 血管形态和血流动力学参数的定量测量
4.1 形态参数
在完成IVUS图像的分割和血管三维重建的基础上,采用几何方法,可对具有临床参考价值的血管形态参数(包括最大和最小管腔直径、管腔横截面积、管腔偏心率、管腔容积、血管壁厚、斑块体积、血管段长度等)进行定量测量[39-40],辅助血管病变的诊断和指导介入治疗。
4.2 血流动力学参数
利用重建出的三维血管模型,采用计算流体力学(computational fluid dynamics, CFD)数值模拟技术,可对血管壁应力/应变的分布和管壁的弹性模量等进行估算[41],如图9所示。通过分析血管形态参数和血流动力学参数之间的关系,还可研究斑块的分布规律与血管的局部曲率和管壁剪应力之间的关系,预测斑块的发展趋势,探讨动脉粥样硬化的发病机理[42]。该测量方法的缺点是结果的精度很大程度上取决于血管三维重建的精度。重建过程中,图像采集、二维分割、确定各帧IVUS图像的轴向位置和空间方向等步骤中存在的误差都会累积在最终的重建结果中,进而影响对血流动力学参数的测量精度。同时由于需借助 CFD软件进行数值模拟分析,限制了其适用范围。

图9 血管壁剪应力CFD数值模拟结果[41]
4.3 小 结
血管形态和血流动力学参数的精确测量,对冠心病临床治疗介入方案的选择和对治疗效果的评价等具有重要的参考价值。由于实际中动脉血管内部的血液流场是高度复杂的,而且心脏的周期性运动也会导致动脉血管一定程度的变形,因而目前亟待解决的主要难题是对测量结果精度的定量、客观评价。
5 血管组织定征显像
为了准确获取斑块信息,在IVUS的基础上出现了虚拟组织成像(virtual histology, VH)和血管弹性图(vascular elastography, VE)两种技术,由于均以获取斑块的组织信息为目的,故统称为组织定征显像[43]。
5.1 虚拟组织成像
VH是美国Volcano公司(Volcano Therapeutics, Rancho Cordova, CA, USA)开发的一项新技术[44],其原理是计算超声回波信号的背向散射积分,并与预先建立的数据库进行相关性分析,将斑块成分区分为 4种不同类型并以不同的颜色显示,如图 10所示。VH的临床应用价值尚需进一步研究才能证实[45]。目前只有Volcano公司生产的IVUS设备具有VH-IVUS的分析功能。同时,VH-IVUS的图像采集是通过ECG门控采集RF数据,因此如果没有接上病人的ECG信号,或者病人ECG信号的R波波幅太低就不可能作VH-IVUS的图像分析。
法家思想是当时最先进的的思想,商鞅的两次变法正是法家思想的实践,对户籍制度、爵位制度、土地制度、行政制度、税收制度以及民风民俗进行变革,制定出严苛的法律,全面推行依法治国。正如刘歆《新序论》所言,“法令必行,内不私贵宠,外不偏疏远。是以令行而禁止,法出而奸息”[3],在法家思想的指导下,在重刑厚赏的指令下,秦国旧有的奴隶制度、奴隶主贵族特权得以彻底推翻,真正完成了从奴隶制到封建制的过渡,建立起符合新兴地主阶级利益、适应新的生产力新的生产关系的上层建筑,以及郡县为基础的中央集权制,奠定了影响中国社会两千余年的封建政治制度的基础。

图10 最新一代的Volcano血管内超声仪可提供实时的VH-IVUS显像[44]
5.2 血管弹性图
血管弹性图是一种显示管壁和斑块组织的生物力学特征的技术,用于评估斑块的易损性。建立在 IVUS基础上的称为血管内超声弹性图(intravascular ultrasound elastography, IVUSE),依据构建原理的不同分为2类:
(1) 基于射频信号的IVUSE[46]:由于将射频信号转化为灰阶图像的过程中损失了部分信息,所以理论上基于射频信号的 IVUSE较之基于图像处理的 IVUSE具有更高的分辨力和精度。但基于射频的 IVUSE计算是沿血管径向方向的组织变形,属于一维应变,而实际上,组织的变形是三维的,包括径向、周向和纵向3个分量,所以IVUSE无法全面显示斑块组织的弹性信息,这种限制性是该技术难以克服的[47]。此外,只有在组织运动方向与射频信号方向一致时才能获得可靠的应变估计。由于受射频信号低 SNR的影响,很难获得对较短舒张末期区间中较小应变的估计。
(2) 基于图像处理的IVUSE[48]:无需获取原始射频信号,而是直接通过对灰阶图像的处理和分析构建 VE。可计算斑块横截面上任意方向上的正应变和剪应变,其构建的是二维弹性图,所以较基于射频的 IVUSE能更全面地反映斑块组织的弹性特征。但该方法的前提是必须确保在两个不同管腔压力下的相同位置处获得对应的一组血管壁横截面图像。由于心脏运动和动脉管腔内搏动的血流会导致超声导管在管腔内产生复杂运动,所以图像的获取较困难。
近年来,国内理工医的科研人员围绕该问题开展了一系列的研究工作。例如,复旦大学汪源源教授领导的项目组在结合血流多普勒信号和血管内压力测量的冠脉弹性参数和等效阻抗的计算[49]方面开展了一系列的研究工作。山东大学齐鲁医院张运院士[50]和西安交通大学万明习教授[51]领导的项目组分别独立地对IVUS动脉血管壁弹性显像问题进行了深入研究。
未来的发展方向是从IVUS灰阶图像序列中获取血管壁组织随血流施压变化产生的运动场的基础上,根据力学理论得到各帧血管壁横截面图像上各点的应力和应变值。
6 与其他影像的融合
6.1 IVUS与X线血管造影图像的融合
如第3节中所述,X线血管造影和IVUS具有互补性:造影图像反映血管腔被造影剂充填后的投影轮廓,无法获得血管壁和斑块的形态结构信息;IVUS显示血管横断面,但无法提供管腔及斑块的空间位置信息。融合IVUS和造影图像数据,对血管进行三维重建,可克服分别独立采用二者重建血管时的不足[35-38,52]。
6.2 IVUS与IV-OCT图像的融合
IVUS与血管内光学相干断层扫描技术(intravascular optical coherence tomography, IV-OCT)的成像原理类似,都是用能量束在血管腔内进行360°周向扫描,获得管腔横断面图像,而且二者具有互补性[53]:IVUS可获得较好地探测深度,但是空间分辨率较低,对血管微小结构变化提供价值有限;IV-OCT的轴向和侧向分辨率都很高,接近组织学分辨率,但由于采用红外光源,导致其组织穿透力较弱。因此,将同一段血管的IV-OCT与IVUS图像数据进行配准和融合[54],可充分发挥IVUS的强组织穿透力和IV-OCT的高分辨率的优势,获得对血管壁以及损伤和斑块的全面描述(图11)。
配准时通常需要采用图像中的标志物作为配准依据,例如侧支血管和钙化等。但是在IVUS和IV-OCT图像序列中,并非每个切面中都有此类标志,例如IVUS图像中可观察到钙化,但其在对应的IV-OCT图像中不一定可见。而且,由于IVUS和IV-OCT检查并非同时进行,因此成像导丝在管腔内的回撤轨迹可能会不同。即使按照相同的回撤速度,同一段血管的IVUS和IV-OCT图像序列的对应帧之间仍然存在误差。同时,由于心脏运动,各心动周期中图像的采集时间点也会不同,导致对应的IVUS和IV-OCT图像中的血管会有一定程度的变形,更加大了配准的难度。

图11 IVUS和OCT图像配准[54]
未来的发展方向是开发多功能的血管内超声成像系统,使得血管内超声和 OCT成像可同时进行[55],获得对靶血管段形态结构更为全面的了解。
6.3 IVUS与CT血管造影图像的融合
CTA(CT angiography)作为一种无创的血管影像技术,为多数病人提供了与X线血管造影相似的解剖结构信息[56]。在利用IVUS图像序列对血管进行三维重建时,可采用 CTA图像重建目标血管的中心线,作为对三维导管回撤路径的近似[57],如图12所示。但是,在对冠状动脉成像时,由于 CTA与IVUS图像并非同步获取,因此,二者记录的可能不是相同状态下的心脏及冠状动脉。并且,如图 13所示,通常情况下血管腔轴线与超声导管回撤路径并不重合[58],因而估计重建误差和评价算法精度时必须考虑这一因素的影响。
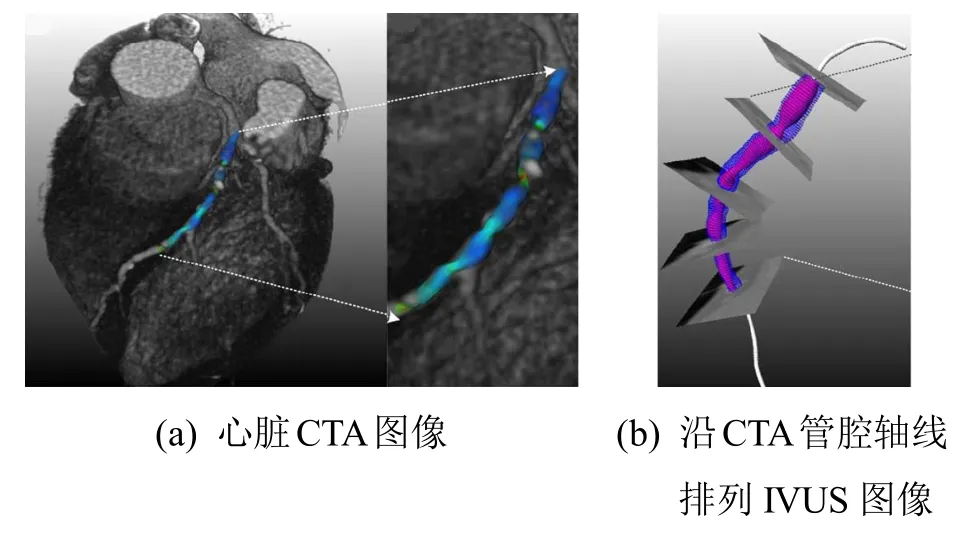
图12 CTA与IVUS图像的融合[57]

图13 超声导管与血管腔轴线示意图[58]
7 结论和展望
目前,已经应用于临床的IVUS图像计算机后处理软件,如VH-IVUS (volcano therapeutics, rancho Cordova, CA, USA)、iMAP-IVUS (Boston scientific, Santa Clara, CA, USA)、integrated backscatter IVUS (IB-IVUS)和automated differential echogenicity (ADE),主要包括自动提取血管壁内外膜轮廓、定量测量具有临床参考价值的血管形态参数、射频信号分析、虚拟组织学显像和血管弹性显像等功能。上述的其他研究内容虽然目前尚未应用于临床,但其应用前景是光明的。
血管内超声基本的信号被转化为标准显示的常规灰度图像。虽然对于超声信号的高级分析(包括射频信号、背向散射信号以及弹性特征等),可进一步了解组织特征,为血管壁形态学分类和斑块成分的分析提供更客观及重复性好的分类方法,但是并非所有IVUS成像系统都允许对原始射频信号进行采集,因而限制了此类处理方法(涉及血管壁边缘提取、组织标定、运动伪影的抑制、血管弹性显像、血管三维重建等)的广泛应用。基于上述原因,对IVUS数字图像序列的自动、定量、客观地解读,对于血管病变(特别是冠状动脉粥样硬化性病变)的计算机辅助诊断和筛查、制定介入手术规划和实现手术的精确定位、评价介入治疗效果等将具有很好的应用前景。
[1] Gibbons R J, Araoz P A, Gerber T C. The year in cardiac imaging [J]. Journal of the American College of Cardiology, 2012, 59(21): 1849-1860.
[2] Suh W M, Seto A H, Margey R J P, et al. Intravascular detection of the vulnerable plaque [J]. Circulation: Cardiovascular Imaging, 2011, 4: 169-178.
[3] Schoenhagen P. 轻松掌握血管内超声[M]. 刘茜蒨,刘 健, 陈 芸, 译. 北京: 人民军医出版社, 2009.
[4] Ge Junbo. Current status of percutaneous coronary intervention of chronic total occlusion [J]. Journal of Zhejiang University-Science B, 2012, 13(8): 589-602.
[5] Olszewski M E, Wahle A, Vigmostad S C, et al. Multidimensional segmentation of coronary intravascular ultrasound images using knowledge-based methods [C]// Proceedings of SPIE Conference on Medical Imaging and Image Processing. San Diego, CA, USA: SPIE, 2005: 496-504.
[6] Zhu X, Zhang P, Shao J, et al. A snake-based method for segmentation of intravascular ultrasound images and its in vivo validation [J]. Ultrasonics, 2011, 51(2): 181-189.
[7] Brusseau E, de Korte C L, Mastik F, et al. Fully automatic luminal contour segmentation in intracoronary ultrasound imaging - a statistical approach [J]. IEEE Transactions on Medical Imaging, 2004, 23(5): 554-566.
[8] Filho E S, Yoshizawa M, Tanaka A, et al. Detection of luminal contour using fuzzy clustering and mathematical morphology in intravascular ultrasound images [C]// Proceedings of 27th Annual International Conference of the IEEE Engineering in Medicine and Biology, Shanghai, China: IEEE, 2005: 3471-3474.
[9] Giannoglou G D, Chatzizisis Y S, Koutkias V, et al. A novel active contour model for fully automated segmentation of intravascular ultrasound images: in vivo validation in human coronary arteries [J]. Computers in Biology and Medicine, 2007, 37(9): 1292-1302.
[10] Mendizabal-Ruiz G, Rivera M, Kakadiaris I A. A probabilistic segmentation method for the identification of luminal borders in intravascular ultrasound images [C]//Proceedings of 26thIEEE Conference on Computer Vision and Pattern Recognition, Anchorage, AK, USA: IEEE, 2008: 1-8.
[11] Papadogiorgaki M, Mezaris V, Chatzizisis Y S, et al. Image analysis techniques for automated IVUS contour detection [J]. Ultrasound in Medicine and Biology, 2008, 34(9): 1482-1498.
[12] Unal G, Bucher S, Carlier S, et al. Shape-driven segmentation of the arterial wall in intravascular ultrasound images [J]. IEEE Transactions on Information Technology in Biomedicine, 2008, 12(5): 335-347.
[13] Bovenkamp E G P, Dijkstra J, Bosch J G, et al. User-agent cooperation in multiagent IVUS image segmentation [J]. IEEE Transactions on Medical Imaging, 2009, 28(1): 94-105.
[14] Zhang Qi, Wang Yuanyuan, Wang Weiqi, et al. Automatic segmentation of calcifications in intravascular ultrasound images using snakes and the contourlet transform [J]. Ultrasound in Medicine and Biology, 2010, 36(1): 111-129.
[15] Moraes M, Furuie S. Automatic coronary wall segmentation in intravascular ultrasound images using binary morphological reconstruction [J]. Ultrasound in Medicine and Biology, 2011, 37(9): 1486-1499.
[16] Ciompi F, Pujol O, Gatta C, et al. HoliMAb: a holistic approach for media-adventitia border detection in intravascular ultrasound [J]. Media Image Analysis, 2012, 16(6): 1085-1100.
[17] Francois D, Marie-Hélène Roy C, Louise A, et al. Segmentation method of intravascular ultrasound images of human coronary arteries [J]. Computerized Medical Imaging and Graphics, 2014, 38(2): 91-103.
[18] 孙 正, 杨 宇. 基于snake模型的IVUS图像序列三维分割方法[J]. 工程图学学报, 2011, 32(6): 25-32.
[19] Mendizabal-Ruiz E G, Kakadiaris I A. Probabilistic segmentation of the lumen from intravascular ultrasound radio frequency data [C]//Proceedings of 15thInternational Conference on Medical Image Computing and Computer Assisted Intervention, Nice, France, 2012: 454-461.
[20] Athanasiou L S, Karvelis P S, Tsakanikas V D, et al. A novel semiautomated atherosclerotic plaque characterization method using grayscale intravascular ultrasound images: comparison with virtual histology [J]. IEEE Transactions on Information Technology in Biomedicine, 2012, 16(3): 391-400.
[21] Nair A, Margolis M P, Kuban B D, et al. Automated coronary plaque characterization with intravascular ultrasound backscatter: ex vivo validation [J]. Eurointervention, 2007, 3(1): 113-120.
[22] Ciompi F, Gatta C, Pujol O, et al. Reconstruction and analysis of intravascular ultrasound sequences [J]. New Advances in Biomedical Signal Processing, 2011: 231-250.
[23] Rosales M, Radeva P, Rodriguez-Leor O, et al. Modeling of image-catheter motion for 3-D IVUS [J]. Medical Image Analysis, 2009, 13(1): 91-104.
[24] 阎 静, 成官迅, 刘国顺, 等. 双源CT前瞻性和回顾性心电门控冠状动脉成像对比研究[J]. 医学影像学杂志, 2012, 22(1): 45-49.
[25] O′Malley S M, Granada J F, Carlier S, et al. Image-based gating of intravascular ultrasound pullback sequences [J]. IEEE Transactions on Information Technology in Biomedicine, 2008, 12(3): 299-306.
[26] Gatta C, Balocco S, Ciompi F, et al. Real-time gating of IVUS sequences based on motion blur analysis: method and quantitative validation [C]//Proceedings of International Conference on Medical Image Computing and Computer-Assisted Intervention (MICCAI 2010). Beijing, China, 2010: 59-67.
[27] Sun Zheng, Yan Qi. An off-line gating method for suppressing motion artifacts in ICUS sequence [J]. Computers in Biology and Medicine, 2010, 40(11): 860-868.
[28] Hernàndez-Sabaté A, Gil D, Garcia-Barnés J, et al. Image-based cardiac phase retrieval in intravascular ultrasound sequences [J]. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2011, 58(1): 60-72.
[29] Saijo Y, Tanaka A, Owada N, et al. Tissue velocity imaging of coronary artery by rotating-type intravascular ultrasound [J]. Ultrasonics, 2004, 42: 753-757.
[30] Danilouchkine M G, Mastik F, Steen A F W. Accuracy in prediction of catheter rotation in ICUS with feature-based optical flow-a phantom study [J]. IEEE Transactions on Information Technology in Biomedicine, 2008, 12(3): 356-365.
[31] Rosales M, Radeva P, Rodriguez O, et al. Suppression of IVUS image rotation. A kinematic approach [J]. Functional Imaging and Modeling of the Heart, 2005, 3504: 359-368.
[32] Danilouchkine M G, Mastik F, van der Steen A F W. Improving IVUS palpography by incorporation of motion compensation based on block matching and optical flow [J]. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control, 2008, 55(11): 2392-2404.
[33] Hernàndez-Sabaté A, Gil D, Fernandez-Nofrerías E, et al. Approaching artery rigid dynamics in IVUS [J]. IEEE Transactions on Medical Imaging, 2009, 28(11): 1670-1680.
[34] Sanz-Requena R, Moratal D, Garcia-Sanchez D R, et al. Automatic segmentation and 3D reconstruction of intravascular ultrasound images for a fast preliminar evaluation of vessel pathologies [J]. Computerized Medical Imaging and Graphics, 2007, 31(2): 71-80.
[35] Wahle A, Prause G P M, DeJong S C, et al. Geometrically correct 3-D reconstruction of intravascular ultrasound images by fusion with biplane angiography-methods and validation [J]. IEEE Transactions on Medical Imaging, 1999, 18(8): 686-699.
[36] Slager C J, Wentzel J J, Schuurbiers J C, et al. True 3-dimensional reconstruction of coronary arteries in patients by fusion of angiography and IVUS (ANGUS) and its quantitative validation [J]. Circulation, 2000, 102(5): 511-516.
[37] Andreas W, Steven C M, Mark E O, et al. Accuratevisualization and quantification of coronary vasculature by 3-D/4-D fusion from biplane angiography and intravascular ultrasound [C]//Proceedings of SPIE Conference on Biomonitoring and Endoscopy Technologies, Amsterdam, Netherlands, 2000: 144-155.
[38] Stéphane C, Rich D, Tristan S, et al. A new method for real-time co-registration of 3D coronary angiography and intravascular ultrasound or optical coherence tomography [J]. Cardiovascular Revascularization Medicine, 2014, 15(3): 226-232.
[39] Luo Zhongchi, Wang Yuanyuan, Wang Weiqi. Estimating coronary artery lumen area with optimization-based contour detection [J]. IEEE Transactions on Medical Imaging, 2003, 22(4): 564-566.
[40] Medina R, Wahle A, Olszewski M E, et al. Three methods for accurate quantification of plaque volume in coronary arteries [J]. The International Journal of Cardiovascular Imaging, 2003, 19(4): 301-311.
[41] Wahle A, Mitchell S C, Ramaswamy S D, et al. Four-dimensional coronary morphology and computational hemodynamics [C]//Proceedings of SPIE International Conference on Medical Imaging 2001: Image Processing, San Diego, CA, USA, 2001: 743-754.
[42] Wahle A, Lopez J J, Olszewski M E, et al. Plaque development, vessel curvature, and wall shear stress in coronary arteries assessed by X-ray angiography and intravascular ultrasound [J]. Medical Image Analysis, 2006, 10(4): 615-631.
[43] Garcìa-Garcìa H M, Gogas B D, Serruys P W, et al. IVUS-based imaging modalities for tissue characterization: similarities and differences [J]. International Journal of Cardiovascular Imaging, 2011, 27(2): 215-224.
[44] Volcano. IVUS IMAGING: VH® IVUS imaging [EB/OL]. [2015-01-25]. http://www.volcanocorp.com/products/ ivus- imaging/ vh-ivus.php.
[45] Sonka M, Downe R W, Garvin J W, et al. IVUS-based assessment of 3D morphology and virtual histology: prediction of atherosclerotic plaque status and changes [C]// Proceedings of 33rd Annual International Conference of the IEEE EMBS. Boston, Massachusetts USA: IEEE, 2011: 6647-6650.
[46] Brugaletta S, Garcia-Garcia H M, Serruys P W, et al. Relationship between palpography and virtual histology in patients with acute coronary syndromes [J]. Journal of JACC: Cardiovascular Imaging, 2012, 5(3): 19-27.
[47] 胡晓波, 张 梅. 血管内超声组织定征显像的研究现状[J]. 中华超声影像学杂志, 2010, 19(1): 77-79.
[48] Liang Yun, Zhu Hui, Friedman M H. Estimation of the transverse strain tension of the arterial wall using IVUS image registration [J]. Ultrasound in Medicine and Biology, 2008, 41: 2906-2911.
[49] Zhang Qi, Steinman D A, Friedman M H. Use of factor analysis to characterize arterial geometry and predict hemodynamic risk: application to the human carotid bifurcation [J]. Journal of Biomechanical Engineering, 2010, 132(11): 114505(1-5).
[50] Zhang Pengfei, Su Haijun, Zhang Mei, et al. Atherosclerotic plaque components characterization and macrophage infiltration identification by intravascular ultrasound elastography based on B-mode analysis: validation in vivo [J]. The International Journal of Cardiovascular Imaging, 2011, 27(1): 39-49.
[51] Wan Mingxi, Li Yangmei, Li Junbo, et al. Strain imaging and elasticity reconstruction of arteries based on intravascular ultrasound video images [J]. IEEE Transactions on Biomedical Engineering, 2001, 48(1): 116-120.
[52] Tu Shengxian. Three-dimensional quantitative coronary angiography and the registration with intravascular ultrasound and optical coherence tomography [D]. Netherlands: Leiden University, 2012.
[53] Jang I K. Optical coherence tomography or intravascular ultrasound [J]. Journal of JACC: Cardiovascular Imaging, 2011, 4(5): 492-494.
[54] Paulya O, Unala G, Slabaugha G, et al. Semi-automatic matching of OCT and IVUS images for image fusion [C]// Proceedings of SPIE International Conference on Medical Imaging 2008: Image Processing. San Diego, CA, USA: SPIE, 2008: 6914 2N.
[55] Yang Haochung, Yin Jiechen, Hu Changhong, et al. A dual-modality probe utilizing intravascular ultrasound and optical coherence tomography for intravascular imaging applications [J]. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2010, 57(12): 2839-2843.
[56] Feuchtner G, Loureiro R, Bezerra H, et al. Quantification of coronary stenosis by dual source computed tomography in patients: a comparative study with intravascular ultrasound and invasive angiography [J]. European Journal of Radiology, 2012, 81(1): 83-88.
[57] van der Giessen A G, Schaap M, Gijsen F J, et al. 3D fusion of intravascular ultrasound and coronary computed tomography for in-vivo wall shear stress analysis: a feasibility study [J]. The International Journal of Cardiovascular Imaging, 2010, 26(7): 781-796.
[58] Wahle A, Prause G P M, Birgelen C, et al. Fusion of angiography and intravascular ultrasound in vivo: establishing the absolute 3-D frame orientation [J]. IEEE Transactions on Biomedical Engineering, 1999, 46(10): 1176-1180.
Review on Post-Processing of Intravascular Ultrasound Images
Sun Zheng
(Department of Electronic and Communication Engineering, North China Electric Power University, Baoding Hebei 071003, China)
Intravascular ultrasound (IVUS) imaging, an invasive imaging modality, has been widely used in clinical diagnosis of vascular diseases. With IVUS, the morphology of the vessel wall and lumen including atherosclerosis plaques as well as components of plaques can be obtained in vivo. Automatic or semi-automatic processing and analysis of IVUS images with digital image processing techniques is important for computer-aided diagnosis and planning of treatment of vascular diseases. This paper provides a survey on the current process of post-processing of IVUS images. The improvements of this topic in the last several years are discussed in detail including image segmentation and tissue characterization, suppression of motion artifacts, vessel reconstruction, measurement of morphological and hemodynamic parameters, tissue characterization imaging, and fusion of IVUS with other imaging modalities. The discussion assesses the progress so far, and outlines some future directions.
intravascular ultrasound; image segmentation; motion artifact; 3D reconstruction; tissue characterization imaging; image fusion
TN 911.73
A
2095-302X(2015)03-0468-09
2014-03-22;定稿日期:2015-04-15
国家自然科学基金资助项目(61372042);中央高校基本科研业务费专项资金资助项目(2014ZD31)
孙 正(1977-),女,河北保定人,教授,博士。主要研究方向为医学图像处理。E-mail:sunzheng_tju@163.com

