重组人粒细胞集落刺激因子对脑缺血再灌注大鼠的神经保护和血管再生作用
邓文静 李东瑞 楚广磊 滕军放(通讯作者)
郑州大学第一附属医院神经内科 郑州 450052
粒细胞集落刺激因子(G-CSF)是一种细胞生长因子。近几年,国内外的许多研究认为G-CSF 具有神经保护作用,所以推测G-CSF可能是治疗脑缺血的有效措施。重组人粒细胞集落刺激因子(rhG-CSF)与天然G-CSF具有相同的生物学活性,更普遍的应用于临床。因此本研究采用rhG-CSF作为干预药物,拟通过局灶性脑缺血再灌注模型,观察脑缺血大鼠的神经功能变化和血管再生的情况,进一步研究rhGCSF的神经保护机制。
1 材料与方法
1.1 主要试剂 rhG-CSF 购自山东泉港药业有限公司,CD105、VEGF兔抗鼠多克隆抗体购于美国Santa Cruz公司。
1.2 实验动物分组与模型制备 健康雄性SD 大鼠,2~3个月,体质量280~320g,由郑州大学基础医学院动物实验研究中心提供。随机分为假手术组(sham 组)、生理盐水对照组(Nacl组)、rhG-CSF治疗组。每组又随机分为缺血治疗后24h、7d和14d时间点组,每一时间点均为6只大鼠。采用改良的Longa[1]方法制作大鼠大脑中动脉闭塞MCAO 模型,动物模型缺血90min时再灌注。于再灌注开始,治疗组予rhG-CSF 50μg/(kg·d),腹部皮下注射,连续5d。生理盐水对照组予等量生理盐水。分别于治疗后24h、7d、14d时进行神经功能缺损评分。
1.3 神经功能评分与病死率统计 每只动物分别于缺血再灌注治疗后24h、7d、14d进行神经功能缺损评分,具体方法采用chen等[2]制定的神经功能缺损评分标准(Nss)进行,观察rhG-CSF对脑缺血大鼠神经功能的影响。
1.4 CD105、VEGF蛋白表达检测 以10%水合氯醛将大鼠深度麻醉,断头取脑,以前囱为中心、冠状面±1mm 脑片,每隔100μm 续作6μm 厚脑冠状面石蜡切片。每只大鼠选5张大致相同部位计数阳性细胞数,经图像分析系统得出积分光密度IOD,取其平均数。胞浆呈棕褐色着色者认为免疫反应阳性细胞。
1.5 统计学方法 采用SPSS 17.0软件,所有实验数据采用均数±标准差(±s)表示,病死率比较采用四格表χ2检验。神经功能评分比较采用单因素方差分析,组间两两比较采用Student Newman Keuls Test SNK和Least Significant Difference Procedure LSD法检验。P<0.05为差异有统计学意义。
2 结果
2.1 rhG-CSF对MCAO 大鼠病死率的影响 制作NacL组动物模型39只大鼠,rhG-CSF 治疗组共进行24只动物模型制作,2组病死率比较差别有统计学意义(P<0.05)。见表1。
2.2 神经功能缺损评分结果 NaCl组和rhG-CSF 治疗组大鼠麻醉清醒后精神萎靡,左侧肢体瘫痪,表现为站立不稳,或走路向偏瘫侧转圈或倾倒。假手术组未发现此种情况。
缺血再灌注治疗后24h,NaCl组和rhG-CSF 治疗组较sham 组神经功能评分上升,差异有显著性(P<0.05)。缺血再灌注治疗后7d时,NaCl组和rhG-CSF治疗组较sham 组神经功能评分差异有显著性(P<0.05),rhG-CSF 治疗组较NaCl组神经功能评分差异有显著性(P<0.05)。缺血再灌注治疗后14d 时,各组两两比较差异均有显著性(P<0.05)。见表2。
2.3 各组大鼠脑组织缺血半暗带VEGF蛋白的表达 免疫组化结果可见在神经细胞、血管内皮细胞及神经胶质细胞胞质呈棕黄色着色,此即VEGF 阳性表达。sham 组可见少量VEGF表达,缺血再灌注治疗后7d和14d,NaCl组VEGF阳性表达要高于sham 组,差异有统计学意义(P<0.05),rhG-CSF治疗组VEGF 阳性表达要高于sham 组和NaCl组,差异有统计学意义(P<0.05)。见表3、图1。

表1 rhG-CSF对MCAO 大鼠病死率比较 [n(%)]
表2 3组对大鼠神经缺损评分比较 (±s,n=6)

表2 3组对大鼠神经缺损评分比较 (±s,n=6)
注:以上数据经方差齐性检验和正态检验,均符合正态分布,方差具有齐性;与sham组比较,* P<0.05,** P<0.05;与NaCl组比较,△P>0.05,△△P<0.05
组别24h 7d 14d Sham 组0.50±0.55 3.50±0.55 3.33±0.52 NaCl组 8.50±0.55* 7.83±0.75* 7.83±0.75*rhG-CSF治疗组7.83±0.98**△ 4.67±1.21**△△4.50±0.55**△△
表3 各组大鼠脑组织VEGF积分光密度比较 (±s,n=6)

表3 各组大鼠脑组织VEGF积分光密度比较 (±s,n=6)
注:以上数据经方差齐性检验和正态检验,均符合正态分布,方差具有齐性;与sham 组比较,*P<0.05,**P<0.05,较之NaCl组,△P<0.05
△
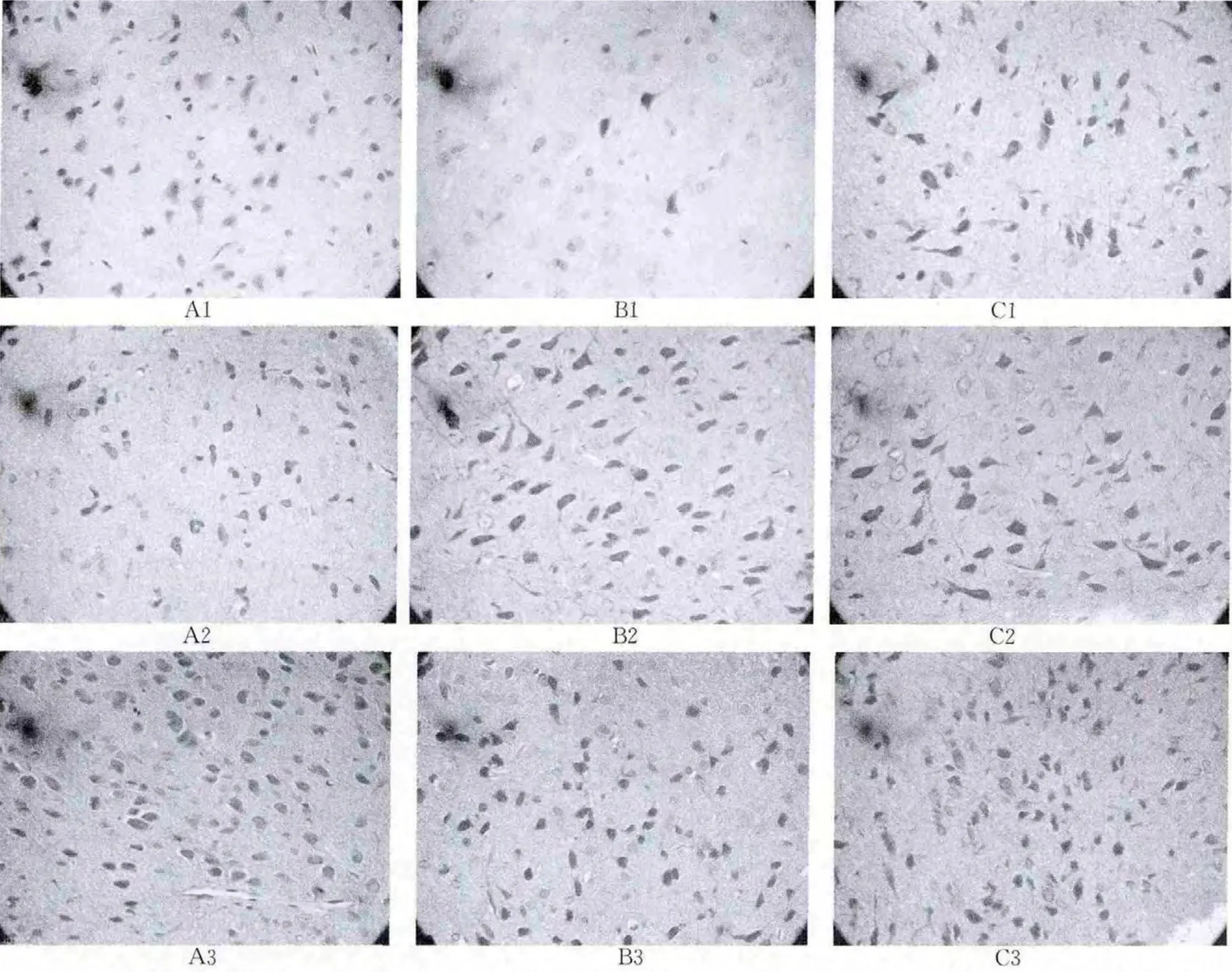
图1 各组大鼠脑组织VEGF蛋白的表达(SP,×400)A:sham 组;B:NaCl组;C:rhG-CSF治疗组1:7d;2:14d,3:21d
2.4 CD105染色观察各组大鼠脑组织毛细血管密度 免疫组化结果可见血管内皮细胞中棕黄色颗粒沉积,即为CD105阳性表达。脑缺血再灌注治疗后14d时,sham 组CD105染色显示毛细血管稀疏,NaCl组毛细血管稍增多,可见胶质细胞浸润,rhG-CSF治疗组毛细血管明显增多(P<0.05)。见表4。
表4 各组大鼠脑组织CD105积分光密度 (±s)

表4 各组大鼠脑组织CD105积分光密度 (±s)
注:与sham 组比较,*P<0.05,与NaCl组相比,**P<0.05
组别24h 7d 14d Sham 组58.97±3.54 69.22±2.03 65.84±2.46 NaCl组 90.89±8.45* 110.32±10.15* 100.01±11.15*rhG-CSF治疗组 134.77±12.16** 133.29±13.46** 143.02±9.96**
3 讨论
本实验应用rhG-CSF 治疗脑缺血大鼠,观察病死率发现,NaCl组病死率为53.8%,rhG-CSF 治疗组病死率为25.0%,差别具有统计学意义(P<0.05)。对脑缺血大鼠神经功能缺损评分显示,缺血再灌注治疗后7d 和14d 时,rhG-CSF治疗组神经功能较NaCl组神经功能恢复较好。由此可见rhG-CSF能降低脑缺血大鼠病死率,提高神经功能,具有神经保护作用。
血管内皮生长因子VEGF(vascular endothelial factor)能促进血管的新生与重建,是针对血管内皮细胞最为特异的有丝分裂原。本实验中缺血再灌注治疗后7d和14d,rhGCSF治疗组VEGF 阳性表达要高于sham 组和NaCl组,。CD105(Endoglin)蛋白是转化生长因子家族中的一员,相较于其他血管标记因子,CD105多表达在新生血管的内皮细胞中,较大的血管基本不表达,特异性好,常被作为新生血管的特异标记分子之一[3]。本实验中CD105免疫组化结果可见血管内皮细胞中棕黄色颗粒沉积,正常脑组织中,可以检测微量的CD105,脑缺血再灌注治疗后14d时,sham 组显示毛细血管稀疏,NaCl组毛细血管稍增多,可见胶质细胞浸润,rhG-CSF治疗组毛细血管明显增多。由此可见rhG-CSF 能促进缺血后脑组织VEGF 和CD105 的表达,标志着血管再生,这种促进血管再生作用能持续至脑梗死后14d,并且伴随有神经功能的好转。与Lee等[4-6]研究结果一致。
G-CSF促进血管再生的机制,目前认为有可能通过促使骨髓间充质细胞转化为内皮细胞或者血管[7],或通过促进单核细胞向缺血区募集进而促进血管生成[8]。在中枢神经系统,G-CSF被认为有可能通过旁分泌途径刺激星形胶质细胞分泌血管内皮生长因子(VEGF)。
由以上结果可发现,rhG-CSF能改善脑缺血后大鼠的神经功能,其机制可能与促进血管再生有关。rhG-CSF作为一种新型的神经保护药物,有望成为脑缺血神经保护研究的新方向。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in the rats[J].Stroke,1989,20(1):84-91.
[2]Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after ischemia in rats[J].Stroke,2001,32(4):1 005-1 011.
[3]Wikstrom P,Lissbrant IF,Stattin P,et al.CD105is expressed on immature blood vessels and is a marker for survival in prostate Caacer[J].Prostate,2002,51(4):268-275.
[4]Hayashi T,Deguchi K,Nagotani S,et al.Cerebral ischemia and angiogenesis[J].Curr Neurovasc Res,2006,3(2):119-129.
[5]Krupinski J,Kaluza J,Kumar P,et al.Role of angiogenesis in patients with cerebral ischemic stroke[J].Stroke,1994,25(9):1 794-1 798.
[6]Lee ST,Chu K,Jung KH,et al.Granulocyte colony-stimulating factor enhances angiogenesis after focal cerebral ischemia[J].Brain Res,2005,1058(1/2):120-128
[7]Minamino K,Adachi Y,Okigaki M,et al.Macrophage colonystimulating factor(M-CSF),as well as granulocyte colonystimulating factor(G-CSF),accelerates neovascularization[J].Stem Cells,2005,23(3):347-354.
[8]Capoccia BJ,Shepherd BM,Link DC.G-CSF and AMD 3100 mobilize monocytes into the blood that stimulates angiogenesis in vivo through a paracrine mechanism[J].Blood,2006,108(7):2 438-2 445.

