维胺酯在大鼠体内的血药浓度及组织分布
王鹏 张蓓蓓 缪晓辉⋆ 倪武
维胺酯在大鼠体内的血药浓度及组织分布
王鹏 张蓓蓓 缪晓辉⋆ 倪武
目的 研究SD大鼠口服维胺酯(Via)后体内的血药浓度及组织分布情况。方法 大鼠口服Via后,通过高效液相色谱检测各时间点血浆和组织中药物浓度,采用DAS2.0软件进行房室模型拟合并计算药物动力学参数。结果 大鼠口服Via125 mg/kg,所得血浆药时曲线符合二室模型,主要药代动力学参数:t1/2(β)为(2.22±0.52)h;Tmax为(0.83±0.13)h;Cmax为(3.90±1.05)mg/L。Via口服后15min内可迅速分布至各主要组织器官,1 h后药物在脂肪组织浓度最高,皮肤、肌肉组织次之,骨骼最低。7 h后各组织药物浓度均明显下降。结论 Via在体内吸收迅速、清除较快、分布广泛,在脂肪和皮肤组织中浓度最高。
维胺酯 血药浓度 组织分布 高效液相色谱
目前Via已广泛应用于多种皮肤病治疗,尤其对中、重度痤疮疗效显著[2,3],然而,该药物在皮肤及其他组织器官中的分布情况尚未清楚。因此作者参考相关文献,选择快速、简便的高效液相色谱药物浓度测定法(HPLC)[4],对其在大鼠体内组织分布特点进行研究,旨在为临床用药的安全性、有效性和扩大适应证提供依据。
1 材料与方法
1.1 材料与设备 (1)药物与试剂:Via胶囊规格25 mg/粒;Via标准品(重庆华邦公司),以甲醇配制成1 g/L储备液,避光低温保存备用;甲醇(色谱纯),乙腈(色谱纯),羧甲基纤维素钠(分析纯),重蒸馏水。(2)实验动物:健康合格一级SD大鼠,雌雄各半,体重180~200 g,由中南大学湘雅医学院实验动物中心提供。(3)主要仪器:依利特P230高效液相色谱仪(大连依利特科学仪器公司);Diamonsil C18 色谱柱(200 mm×4.6 mm,5μm);组织匀浆机(宁波新芝仪器有限公司);低速台式离心机(长沙高创仪器有限公司);高速台式离心机(长沙英泰仪器有限公司);漩涡振荡仪(上海第一医学院仪器厂);电子分析天平(北京赛多利斯仪器系统有限公司)。
1.2 方法 (1)血液样品的采集和预处理:选取健康合格一级SD大鼠6只,雌雄各半,体重180~200 g,实验前禁食18h,按动物体重计算给药剂量,实验当天灌胃给予125 mg/kg的Via混悬液(使用5‰羧甲基纤维素钠配制)。于给药前(0)以及给药后0.5、0.75、1、2、3、4、5、6、7、8、9、10、11、12 h采尾静脉血0.2 ml,3000 r/min离心10min分离血浆备用。精确移取血浆0.1 ml,加入0.3 ml乙酸乙酯,旋摇3min,12000 r/min离心10min,精确移取上层有机相0.2 ml至空白试管,常温下氮气吹干,0.1 ml流动相溶解,取20 μl进样,所有操作和保存过程均严格避光。(2)组织样品采集和预处理:选取健康合格一级大鼠24只,体重200 g 左右,随机分为4组,每组6只,雌雄各半。给药方法同上。分别在15min、1 h、4 h、7 h四个时间点将动物处死,心脏取血1ml,在相同部位切取心、肝、脾、肺、肾、脑、皮肤、脂肪、肌肉、睾丸或子宫和卵巢适量,称重,用1:3(W/V)蒸馏水制成组织匀浆,取此匀浆1ml,加3ml乙酸乙酯提取,旋摇3min,3000r/min 离心10min,精确移取上层有机相2ml至空白试管,常温下氮气吹干,0.1 ml流动相溶解,12000 r/min离心5min,取上层清液20 μl进样。骨组织取自大鼠股骨,洗去骨髓,称重,按1 :3(W/V)加入甲酸若干,置40 ℃水浴中温孵30min,待其完全溶解后用0.1mol/L NaOH调pH至6.0,取1ml同上方法处理并进样分析。(3)测定条件:依利特P230高效液相色谱仪,Diamonsil C18色谱柱(200mm×4.6mm,5μm),流动相为甲醇:水(95:5,V/V),使用前经0.45μm的过滤膜超声脱气;柱温25℃;流速为1 ml/min;检测波长为370nm;20μl固定进样环。(4)血浆标准曲线的建立:采用大鼠空白血浆配成药物浓度为31、122、488、195、781μg/L的Via标准液,按前述血浆处理办法进行处理、测定,所得数据用加权最小二乘法进行线性回归。(5)组织标准曲线的建立:采用大鼠空白混合组织匀浆配成药物浓度为25、98、391、1560、6250、25000 μg/L的Via标准液,按前述组织匀浆处理办法进行处理、测定,所得数据采用加权最小二乘法进行线性回归。(6)回收率、精密度:采用大鼠空白混合组织匀浆配制低、中、高3种浓度(0.1、1.0、5.0 mg/L)的Via质控样品,各5管,于同一天作预处理后采用HPLC分析,计算日内精密度。以后每天配制上述3种浓度的质控样品各5份,连测3 d,计算日间精密度和方法回收率。
1.3 统计学方法 采用SPSS12.0统计软件。计量资料以(x±s)表示,组间比较采用t检验;计数资料以%表示,组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 检测方法的建立 在甲醇:水(95:5;V/V)条件下,Via色谱峰与内源性物质分离良好,峰形对称,保留时间较短(6.2min),见图 1。
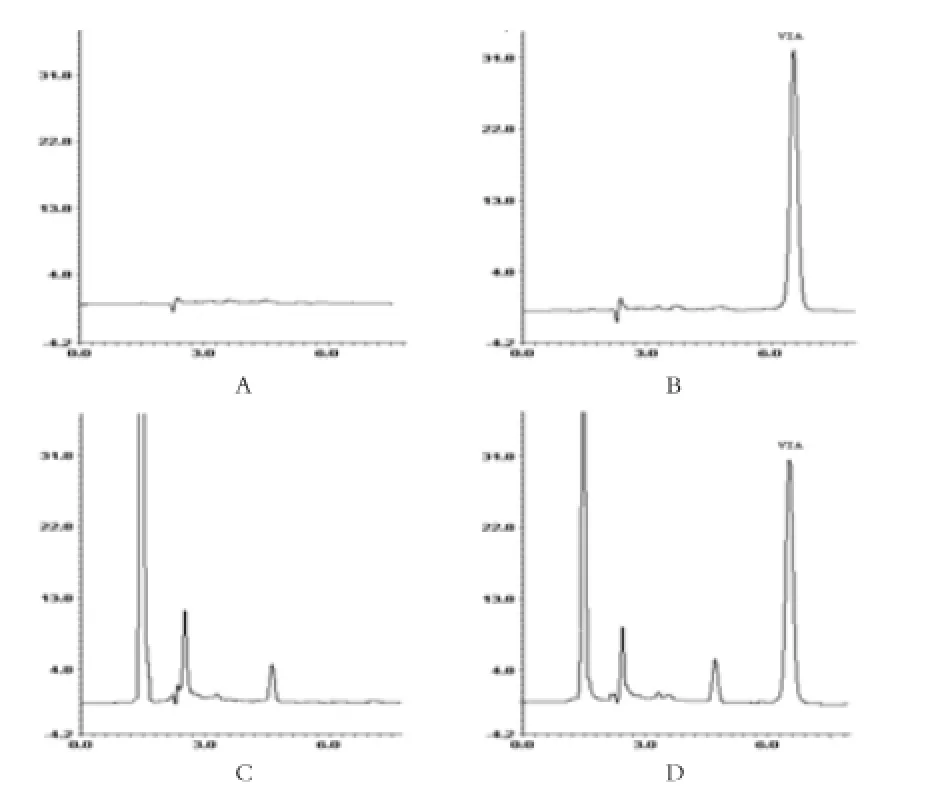
图1 样品测定色谱图
2.2 标准曲线、回收率、精密度 血浆标准曲线回归方程为y=0.0634x+9.772,浓度范围为31~7810μg/ L,r2=0.9987。组织匀浆标准曲线回归方程为y=0.5251 x+3.557,线性范围为6.1~25000 μg/L,r2=0.9998。回收率以及精密度结果见表1。
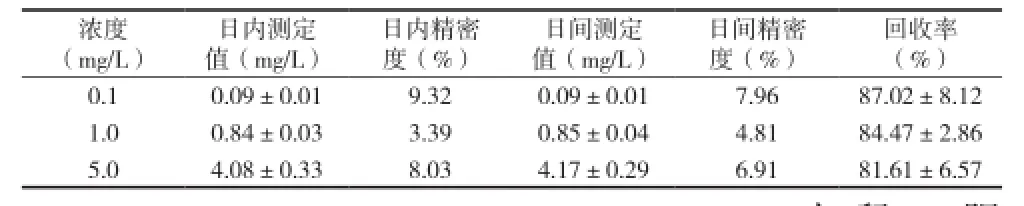
表 1 组织匀浆样品回收率和精密度测定结果[n=5,(x±s)]
2.3 大鼠口服Via时曲线 大鼠口服Via 125mg/kg后,不同时间测定的血药浓度值采用DAS2.0药代动力学软件拟合处理,得到药-时曲线(见图2)。主要药动学参数见表2。根据药时曲线,0~0.83 h为吸收相,0.83~2.5 h为平衡相,2.5~12.0 h为消除相。模型拟合为二室模型。
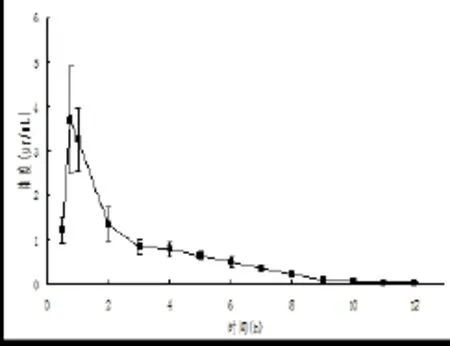
图2 SD大鼠口服Via后血浆药物浓度—时间曲线

表2 Via在SD大鼠体内药物动力学参数[n=6,(x±s)]
2.4 Via在SD大鼠组织中的分布 大鼠口服Via后可迅速分布至各主要器官,1h后药物在脂肪中浓度最高,皮肤、肌肉次之,骨骼最低。7 h后各组织药物浓度均明显下降,24h后除脂肪组织仍存在(1.13±1.01)μg/g的药物外,其他组织药物浓度均已检测不到。见图3。
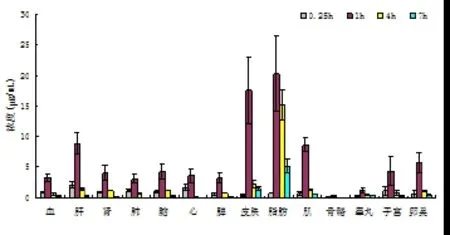
图3 Via在SD大鼠体内各组织的分布
3 讨论
Via是全反式维A酸与对氨基苯甲酸乙酯化合形成的酰胺类化合物,是目前我国唯一自行研制并具有知识产权的维A酸类药物[1]。现已明确Via对角质形成细胞或鳞状上皮的分化与增殖有明显的抑制作用[5],临床实践亦证实该药对中、重度痤疮及多种角化异常性皮肤病疗效肯定,与异维A酸相比疗效无显著差异,副作用轻微[6]。
本资料显示,大鼠单次灌胃Via125 mg/kg后体内药动学呈二室开放模型,吸收较迅速,达峰时间(0.83±0.13)h;血浆清除亦较快,消除半衰期(2.22±0.52)h,清除率(16.20±0.13)L/(kg·h)。组织分布研究发现,Via在大鼠体内分布迅速且广泛,15min即可在肝、肾、脾、肺、心、脑、脂肪、皮肤、骨骼肌、睾丸、子宫和卵巢等组织检测到,各组织器官中Via的达峰时间与血浆中的基本相同。给药15min时,Via在肝组织中分布浓度最高,心脏次之,这可能与这些组织器官的血流量较大有关;给药1h后,Via在脂肪、皮肤的持续高浓度则可能与药物的脂溶性高有关。
药物的分布情况对其疗效和毒副作用具有重要的意义,只有治疗靶组织达到一定的药物浓度才能保证疗效。在本实验中,大鼠口服Via 1h后,皮肤的药物浓度明显高于除脂肪外的其他组织,Via的这一分布特点可能有助于提高疗效。然而,疗效部位以外的器官组织可能成为药物毒副作用的靶器官。已有证据表明,维A酸类药物长期应用可在不同的组织器官中产生多种副作用,如引起头痛、眼结膜炎、骨骼发育不良、肌肉痛、胰腺炎、血脂升高、肝功能损害以及胎儿畸形等[7,8]。有研究显示Via亦会引起黏膜干燥、致畸、血脂改变、肝脏损害等[2,9],因此作者推测Via的副作用可能与其在组织中的分布有关。尽管如此,Via产生的毒副作用常较其同类药物轻微[6],这可能与其在皮肤、脂肪浓聚以及在血浆和其它组织中浓度相对较低的特点有关。Via在脂肪组织中药物浓度高,下降缓慢,滞留时间长,而同样具有高亲脂性的药物阿维A酯在肥胖大鼠体内半衰期明显延长[10],提示长期应用Via可能会造成药物在脂肪组织中过度蓄积,使得人体药物清除速度减慢。
本实验组前期研究发现Via在强光下短时间内可变构成分子量相同而结构不同的另一种较稳定的物质,本实验采用液相色谱质谱联用法在大鼠血浆及皮肤组织中发现了这种物质,由于全反式维A酸与其异构体13-顺-维A酸在光照或体内能够互变[11],故推测Via在体内可能亦存在着类似改变。
1 徐世平,郭宗儒,袁占亮,等.防癌药物的研究—维生素甲酸衍生物的合成.药学学报,1981,16(9): 678~685.
2 赵善聚,于爱英.维胺酯在皮肤病中的应用.皮肤病与性病,2005,27(4): 9~11.
3 雷霞,鲁元刚,赵莉蓉,等.口服维胺酯胶囊治疗寻常痤疮.中华皮肤科杂志,2003,36(2): 116.
4 欧阳净,黄华,杨成钢. 三蕊胶囊中维胺酯含量测定方法的改进.现代食品与药品杂志,2006,16(2): 23~25.
5 蔡海英,崔小邢,张金生,等.新维生素甲酸衍生物抑制鸡胚脚掌上皮的分化. 中国医学科学院学报,1982,15(3): 45~48.
6 沈献平,桑红,倪容之,等.维胺酯胶囊与异维A酸对照治疗寻常痤疮.中华皮肤科杂志,2003,36(5): 295.
7 Castano G,Etchart C,Sookoian S. Vitamin A toxicity in a physical culturist patient: a case report and review of the literature. Ann Hepatol, 2006,5(4): 293~395.
8 Zane LT,Leyden WA,Marqueling AL,et al. A population-based analysis of laboratory abnormalities during isotretinoin therapy for acne vulgaris.Arch Dermatol,2006,142(8): 1016~1023.
9 王美琴,静玉,岳娟.维胺酯引起肝损害1例.医药导报,2002,21(5): 149.
10 Chien DS,Sandri RB,Tang-Liu DS. Systemic pharmacokinetics of aci tretin,etretinate,isotretinoin,and acetylenic retinoids in guinea pigs and obese rats. Drug Metab Dispos,1992,20(2): 211~221.
11 Wang C J,Pal L H,Hsiong C H,et al. Novel inhibition of cis/tran retinoic acid interconversion in biological fluids-An accurate method for determination of trans and 13-cir retinoic acid in biological fluids. J Chromatogr B Analyt Technol Biomed Life Sci,2003,796(2): 238~291.
Objective To study the plasma concentration and tissue distribution of oral viaminate in rats. Methods The plasma and tissue concentrations of viaminate were detected by high performance liquid chromatography at various times after oral administration in rats. The pharmacokinetic parameters were calculated with Das2.0 program. Results The time-concentration curve of viaminate corresponded to the model of two-compartment model after oral administration. The main pharmacokinetics parameters were:t1/2(β)=(2.22 0.52)h;Tmax =(0.83±0.13)h;Cmax=(3.90±1.05)mg/L. It was showed that viaminate was absorbed rapidly and was distributed in many tissues or organs in 15minutes.The concentration of viaminate was highest in fat at 1 h,followed by skin and muscle,lowest in skeleton. The concentrations in all of the tissues were decreased obviously. Conclusions Viaminate can be quickly absorbed and distributed in various tissues or organs in vivo, fellowed by being eliminated very quickly. The concentration of viaminate in skin and fat is higher than that in other tissues.
Viaminate Plasma concentration Tissue distribution HPLC
200003 上海第二军医大学长征医院感染科
*通讯作者

