超声波辅助提取花生红衣多酚及其抗氧化活性研究
任 虹 薛宏亮 李 婷 朱晓霞
(北京工商大学食品学院北京市食品风味化学重点实验室食品添加剂与配料北京高校工程研究中心食品质量与安全北京实验室1,北京 100048)
(武汉大学公共卫生学院2,武汉 430071)
超声波辅助提取花生红衣多酚及其抗氧化活性研究
任 虹1薛宏亮2李 婷1朱晓霞1
(北京工商大学食品学院北京市食品风味化学重点实验室食品添加剂与配料北京高校工程研究中心食品质量与安全北京实验室1,北京 100048)
(武汉大学公共卫生学院2,武汉 430071)
采用单因素和响应面试验研究超声波辅助提取花生红衣多酚的工艺条件,采用DPPH·法测定其体外抗氧化活性。结果表明:花生红衣多酚超声波辅助最佳提取条件:乙醇溶液体积分数70%、超声功率240 W、超声时间9 min、超声温度50℃;提取因素影响大小顺序为超声温度>超声功率>超声时间;花生红衣中提取多酚物质平均得率为5.89%,与模型预测值基本相符。与传统提取方法相比,超声辅助提取是一种提取花生红衣多酚的有效方法。花生红衣多酚具有较强的体外清除DPPH·自由基的能力。
花生红衣多酚 响应面法 超声波辅助提取 抗氧化活性
花生(Arachis hypogaea)是我国各地广泛种植的油料作物,花生红衣(Peanut testa)为花生的种皮,在花生榨油加工生产中,作为经济效益低的副产物,没有得到充分综合利用[1]。多酚类物质是花生红衣中重要的功效成分,与其抗氧化活性密切相关,大量药理实验表明,多酚类化合物具有降血脂、清除自由基等抗氧化活性[2-4],但目前花生红衣在加工生产中常常作为废弃物而被丢弃,若能以花生红衣为原料,规模化开发其中高活性的多酚类物质,将有效发挥其潜在的应用价值和可观的经济效益[5-6]。
植物多酚类物质的提取通常采用热回流、溶剂浸泡及碱提酸沉等方法,但多酚类物质的提取率均不理想[7-9]。近年来,将超声波辅助、微波辅助等提取法应用于植物细胞壁的破碎,有效提高了功效成分的提取率,提高了生产效率[10-12]。超声波辅助提取法是一种提高天然产物功效成分萃取率的新技术,该技术利用超声波辐射压强产生的强烈空化效应、机械振动、扰动作用、高速击碎和搅拌作用等多级效应,增大物质分子的运动频率和速度,增加溶剂的穿透力,加速目标成分进入溶剂,从而提高目标成分的萃取率[13]。目前,超声波辅助萃取技术用于花生红衣功效成分提取的研究报道还比较少。虽然有些文献报道了不同产地的花生红衣多酚的提取工艺[14-15],但花生的产地、品种不同,其中多酚的含量、成分及其抗氧化活性各异,本试验选用我国山东省胶东半岛产花生红衣为材料,应用超声波辅助提取法优化花生红衣多酚成分的提取工艺,为多酚类物质的开发和花生红衣的高值化利用提供依据。
1 材料与方法
1.1 材料与试剂
花生红衣:山东省蓬莱市当地农场,粉碎过40目筛;焦性没食子酸(纯度>98%)二丁基羟基甲苯(BHT)、1,1-二苯基 -2-三硝基苯肼(DPPH):Sigma-Aldrich公司;福林试剂:北京索莱宝科技有限公司;无水Na2CO3:北京五洲世纪红星化工有限责任公司;以上试剂均为分析纯。
1.2 仪器设备
KQ-400DB数控超声仪:自昆山市超声仪器有限公司;SpectraMax190连续波长酶标仪:Molecular Devices公司;CP224S电子分析天平:Sartorius公司;ALPHA2-4LSC真空冷冻干燥机:CHRIST公司;RE-2000旋转蒸发仪:上海亚荣生化仪器厂。
1.3 方法
1.3.1 花生红衣多酚提取方法
准确称取5.0 g花生红衣粉末,加入一定浓度乙醇,用超声波辅助法(选择一定的超声时间、超声温度和超声功率)提取其多酚类成分,抽滤,弃去滤渣得浓缩液,冷冻干燥得多酚粗提物,称重,备用。
1.3.2 花生红衣多酚含量测定
1.3.2.1 绘制没食子酸标准曲线[14]
准确配制40 mg/mL没食子酸标准溶液,分别取0、20、40、80、100、120、140μL上述溶液,以去离子水定容至 10 mL,此时质量浓度分别为 0、80、160、320、400、480、560μg/mL;分别取上述各标液20μL于EP管中,各加入500μL去离子水,摇匀后,加入100μL福林试剂后,混匀。再加入200μL 20%Na2CO3溶液,混匀,避光静置30 min。取100μL上清液于96孔板中,每个样品作6个平行孔,于760 nm下测其吸光度A760值,以没食子酸浓度为横坐标,吸光度A760为纵坐标绘制标准曲线,吸光度(y)没食子酸质量(x)与之间的关系为y=0.000 8x+0.009 6,相关系数 R2=0.997 5。
1.3.2.2 花生红衣多酚含量测定
称取10.0 mg花生红衣粉末提取物,加入甲醇10 mL,配制1.0 mg/mL花生红衣样品溶液。分别取20μL上述样品于EP管中,各加入500μL去离子水,摇匀,再加入100μL福林试剂,混匀后,迅速加入200μL 20%Na2CO3溶液,摇匀,25℃ 避光静置反应30 min,取100μL上清液于96孔板中,每个样品6个平行孔,于760 nm下测其吸光度 A值,根据标准曲线,以下公式计算样品中多酚物质含量。
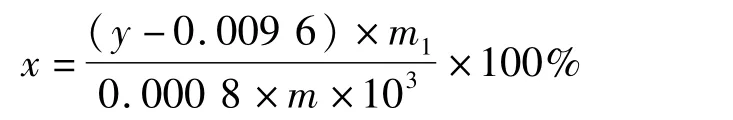
式中:x为样品中多酚物质含量/%;y为样品提取液吸光度值A760;m1为花生红衣多酚粗提物干质量/g;m为花生红衣样品干质量/g。
1.3.3 花生红衣多酚抗氧化活性
采用DPPH·法测定花生红衣多酚的抗氧化活性[16]。取0.10 mL不同浓度的花生红衣多酚溶液,分别加入2.90 mL 0.1 mol/L DPPH·甲醇溶液,室温静置30 min后测定517 nm处的吸光度值,同时,以相同浓度的BHT作为对照,每个处理设置3个平行试验。
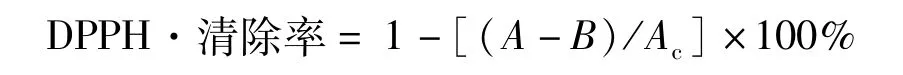
式中:Ac为0.1mL甲醇 +2.9 mL DPPH·溶液的对照吸光度值;A为0.1 mL样品溶液+2.90 mL DPPH·溶液的吸光度值;B为0.10 mL样品溶液+2.90 mL甲醇的吸光度值。
1.3.4 数据分析
采用Origin 6.5软件绘制单因素试验图,采用Design-Expert 6.0对试验数据进行多元回归拟合分析。
2 结果与分析
2.1 超声波辅助提取花生红衣多酚单因素试验
2.1.1 乙醇浓度对花生红衣多酚得率的影响
称取花生红衣粉末5.0 g,固定超声时间10min、温度40℃、超声功率280W、料液比1∶15(g∶mL),选取40%、50%、60%、70%、80%乙醇溶液提取红衣多酚,考察乙醇浓度对花生红衣多酚得率的影响,如图1所示。
图1表明,随着乙醇溶液体积分数的增加,花生红衣提取液中的多酚含量不断增加,当乙醇溶液体积分数达到70%时,多酚得率达到最大值。进一步升高乙醇浓度,多酚得率逐渐降低,这与提取液中多酚物质的溶解性有关。另外,随着乙醇浓度的增加,蛋白质等生物大分子变性沉淀,使多酚物质从组织细胞向提取溶剂中扩散的阻力增大,导致多酚得率降低。因而确定提取花生红衣多酚类物质的最佳乙醇体积分数为70%。
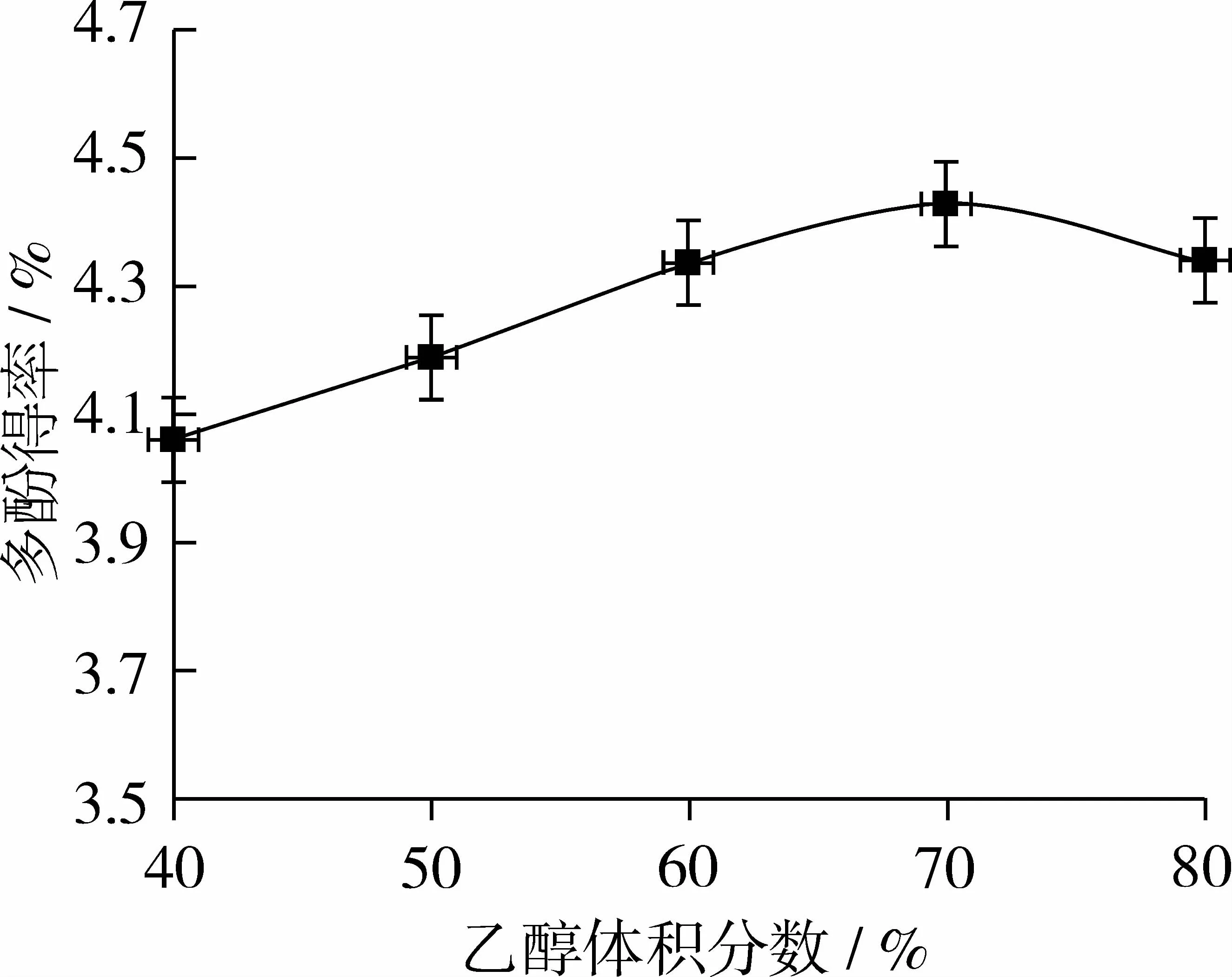
图1 乙醇浓度对花生红衣多酚得率的影响
2.1.2 料液比对花生红衣多酚得率的影响
称取5.0 g花生红衣粉末,固定超声时间10 min、温度40℃、功率280 W,分别加入20、40、60、80、100 mL 70%乙醇,考察不同料液比对花生红衣多酚得率的影响,如图2。
由图2可知,随着料液比的增加,多酚得率逐渐增加,当料液比为1∶16(g∶mL)时,得率达最高,进一步提高溶剂量,多酚得率稍有下降。料液比升高在一定程度上可提高传质推动力,但从提取效率、溶剂用量等方面综合考虑,确定料液比1∶16(g∶mL)较佳,此时,多酚得率为3.70%,明显低于图1多酚得率,可能是由于乙醇纯度不同、超声时间不足等因素引起的,但曲线的变化趋势反映了料液比对多酚得率的影响。
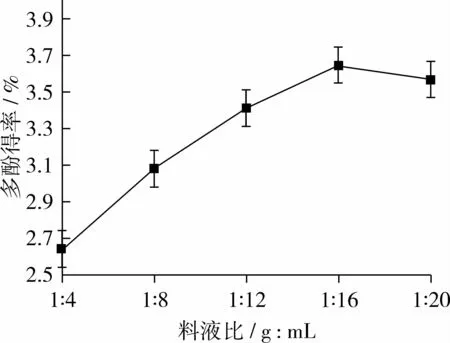
图2 料液比对花生红衣多酚得率的影响
2.1.3 超声时间对花生红衣多酚得率的影响
固定超声波功率280W、温度40℃、料液比1∶16(g∶mL)、体积分数 70%乙醇溶液,分别用 5、10、15、20、25 min超声时间提取红衣多酚,考察超声时间对多酚得率的影响,如图3所示。
由图3可见,随超声时间的增加,提取液中多酚得率逐渐增大;当超声10 min时,多酚得率达最大值;时间延长至15 min后,多酚得率明显降低。说明超声10 min时多酚已基本提取完全,随着花生红衣多酚物质在超声波中处理时间的增加,可能导致部分多酚物质发生降解,得率降低。因此,初步确定最佳超声时间为10 min。
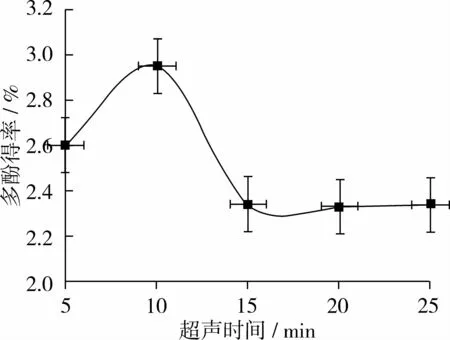
图3 超声时间对花生红衣多酚得率的影响
2.1.4 超声温度对花生红衣多酚得率的影响
固定超声波功率280 W、时间10 min、料液比1∶16(g∶mL)、体积分数 70%的乙醇溶液,分别用超声温度40、50、60、70、80℃ 提取红衣多酚,超声温度对多酚得率的影响,如图4所示。
图4表明,当超声温度未达到50℃时,多酚物质的含量随温度的升高而逐渐增加;当超声温度达到50℃时,多酚得率达到最大值;之后随温度的升高,多酚得率逐渐减少,这是因为随着温度的升高,提取液中部分多酚物质可能发生分解。由此确定最佳超声温度为50℃。
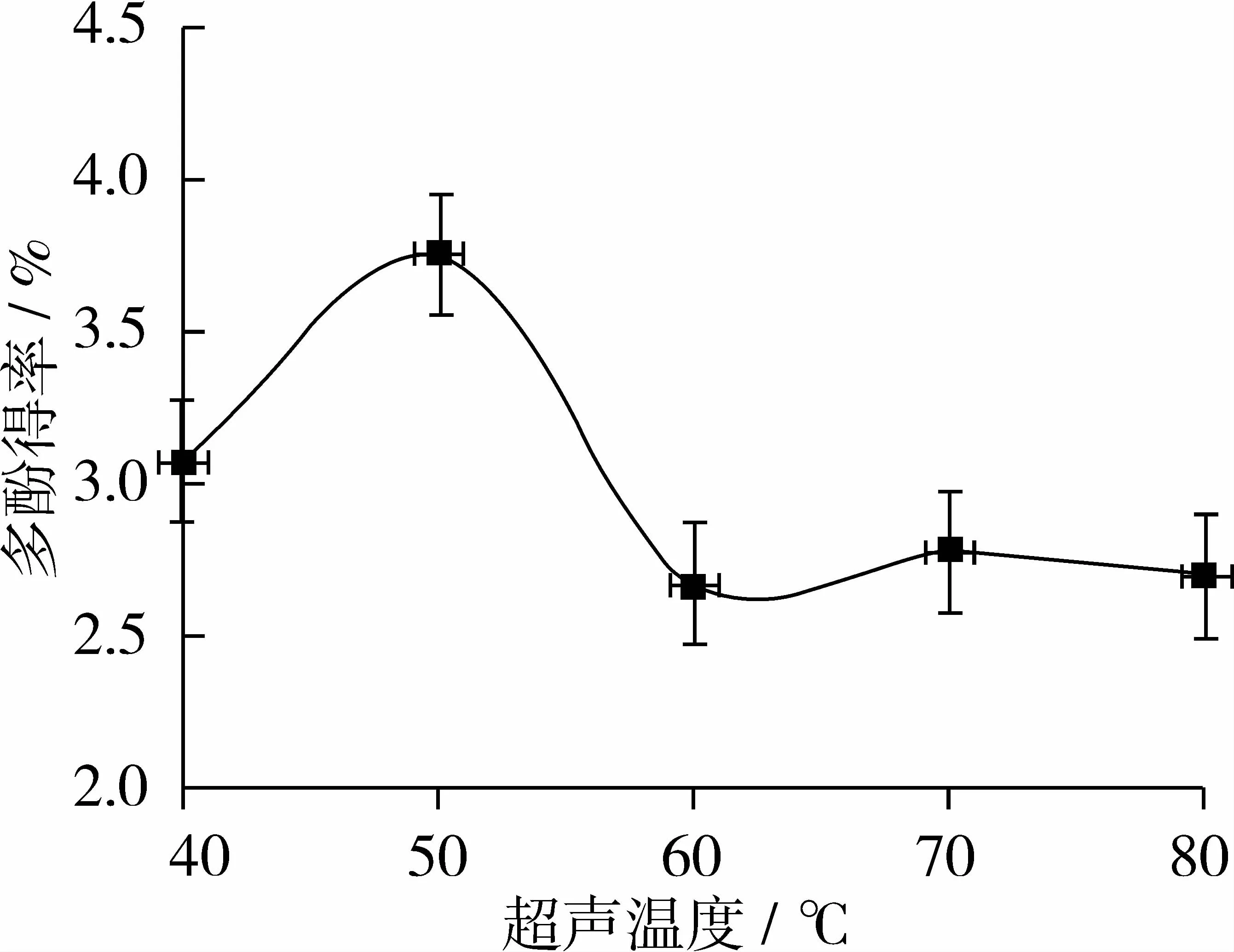
图4 超声温度对红衣多酚得率的影响
2.1.5 超声功率对花生红衣多酚得率的影响
固定超声时间10 min、温度50℃、料液比1∶16(g∶mL)、体积分数 70%乙醇溶液,分别用 160、200、240、280、320W的超声功率提取红衣多酚,考察超声功率对多酚得率的影响,如图5所示。
图5可见,随着超声功率的提高,多酚得率不断增加,因为功率越高,对细胞的破坏作用越大,溶剂扩散效果越佳,越有利于多酚物质的萃出,当超声功率达240 W时,多酚得率达最高值,进一步提高功率,多酚得率逐渐下降,可能是由于过高的提取功率产生的瞬间高温会破坏多酚成分,同时杂质萃出增多。因此,选择240W为最佳超声功率。
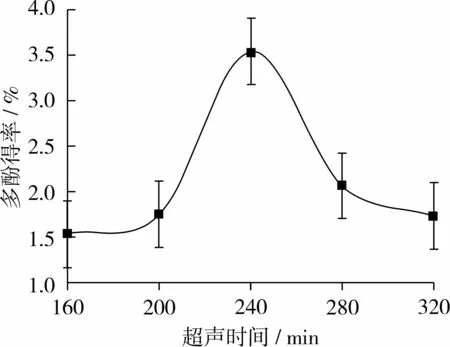
图5 超声功率对红衣多酚得率的影响
2.2 响应面法优化花生红衣多酚提取工艺条件
2.2.1 分析因素选择及分析方案
根据Box-Benhnken模型的中心组合试验设计原理,在单因素试验基础上,选取超声时间X1、超声功率X2和温度X3进行三因素三水平响应面试验,并以 +1、0、-1分别表示自变量的高、中、低水平,多酚得率为响应值(目标函数Y),试验设计见表1。
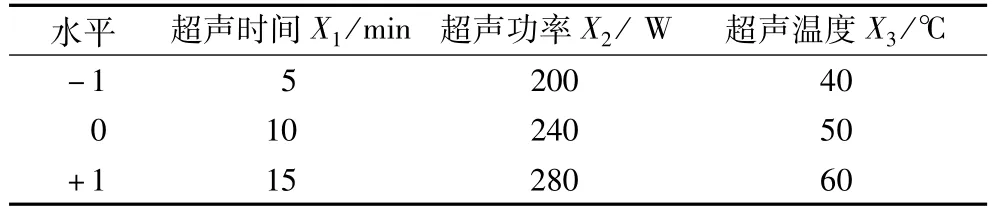
表1 响应面法三因素三水平试验设计表
取15个试验点分为12个析因点和3个零点,其中,析因点为自变量,取值在X1、X2、X3构成的三维顶点上,零点为区域的中心点,零点重复3次,估计试验误差。响应面分析结果见表2。
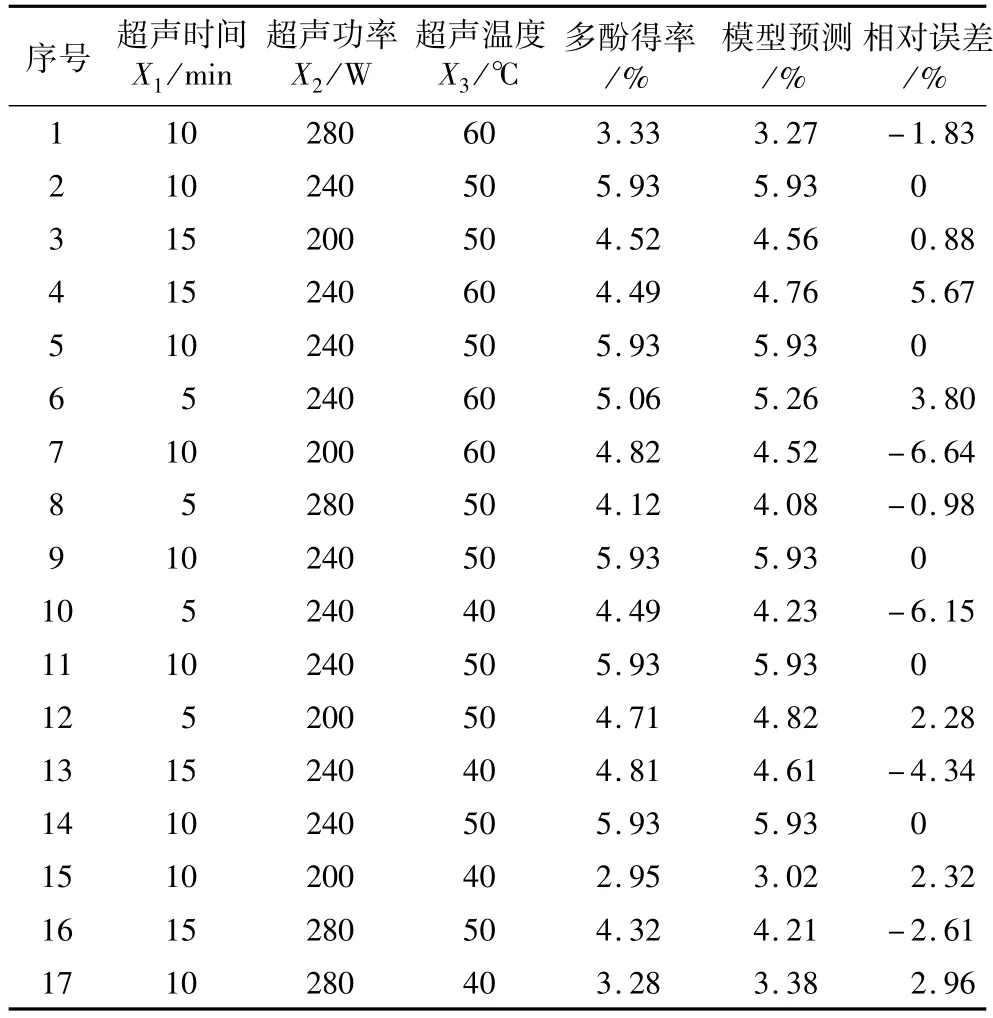
表2 花生红衣多酚得率响应面分析及试验结果
2.2.2 模型建立与显著性检验
利用Design-Expert 6.0软件对表2数据进行二次多元回归拟合,得到花生红衣多酚得率预测值Y对X1、X2和X3的二次多项回归方程如下:
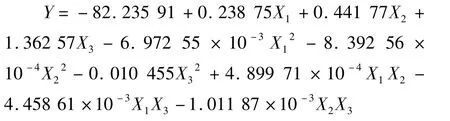
式中:X1为超声时间;X2为超声功率;X3为超声温度;方程中各项系数的绝对值直接反映了各因素对多酚得率的影响程度,系数的正负反映了影响的方向。
回归方程可信度分析见表3,其中R2=0.969 4,表明96.94%的数据可以此方程来解释,说明方程可靠性较高。CV值越低,显示试验稳定性越好,本试验中CV值为5.58%,说明试验操作可信。综上说明了此方程可以用来分析和预测超声萃取山东花生红衣多酚得率的工艺结果。

表3 回归方程可信度分析
模型系数显著性检验和结果见表4,表明各因素对多酚得率的影响不同,各因素对模型影响程度大小依次是X3>X2>X1,即超声温度影响最大,超声功率次之,超声时间影响较少。该分析结果与方差F值分析结果一致。
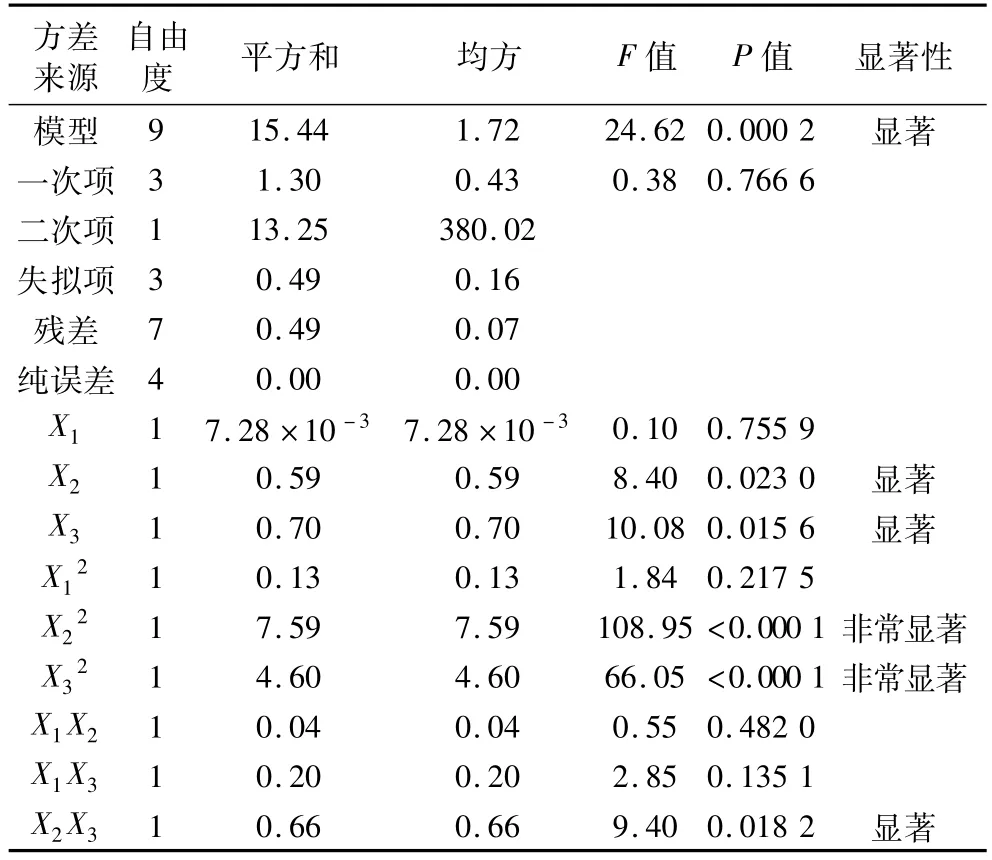
表4 模型系数显著性检验和结果
2.2.3 响应面分析
响应面图形是响应值Y与对应的试验因素X1(超声时间)、X2(超声功率)和 X3(超声温度)构成的一个三维空间曲面图,直观反映了各因素交互关系对响应值Y的影响。当特征值为正值时,响应面图形为山谷形曲面,有最小值存在;当特征值为负值时,为山丘形曲面,有最大值存在;当特征值有正有负时,为马鞍形曲面,无极值存在。等高线形状反映了各因素交互作用的强弱,圆形表示两因素交互作用显著,而椭圆形与之相反。采用Design Expert 6.0软件以回归方程式绘制响应面图和等高线图,如图6~图8所示。
图6为超声时间和功率对多酚得率的影响。由图6曲面图可知,当超声温度一定时,随着超声功率的增加,多酚得率出现先增后减的趋势,曲线较陡;随着提取时间的增加,多酚得率变化不明显,曲线较平滑;由图6等高线图可知,超声时间和功率的交互作用不显著。图7为超声时间和温度对多酚得率的影响,由图7曲面图可知,当超声功率一定时,随着超声温度的增加,多酚得率逐渐增加;随着提取时间的增加,多酚得率曲线较平滑;由图7等高线图为椭圆形可知,超声时间与温度的交互作用不显著。图8为超声功率和温度对多酚得率的影响,曲线较陡,随着超声功率和温度的增加或减小,响应值变化较大;由图8曲面图可知,当超声时间一定时,随着超声功率和温度的增加,多酚得率呈现先增后减的趋势,曲线较陡;由图8等高线图可知,超声功率与温度的交互作用显著。从表4模型系数显著性检验和结果中也可以得到同样的结论。
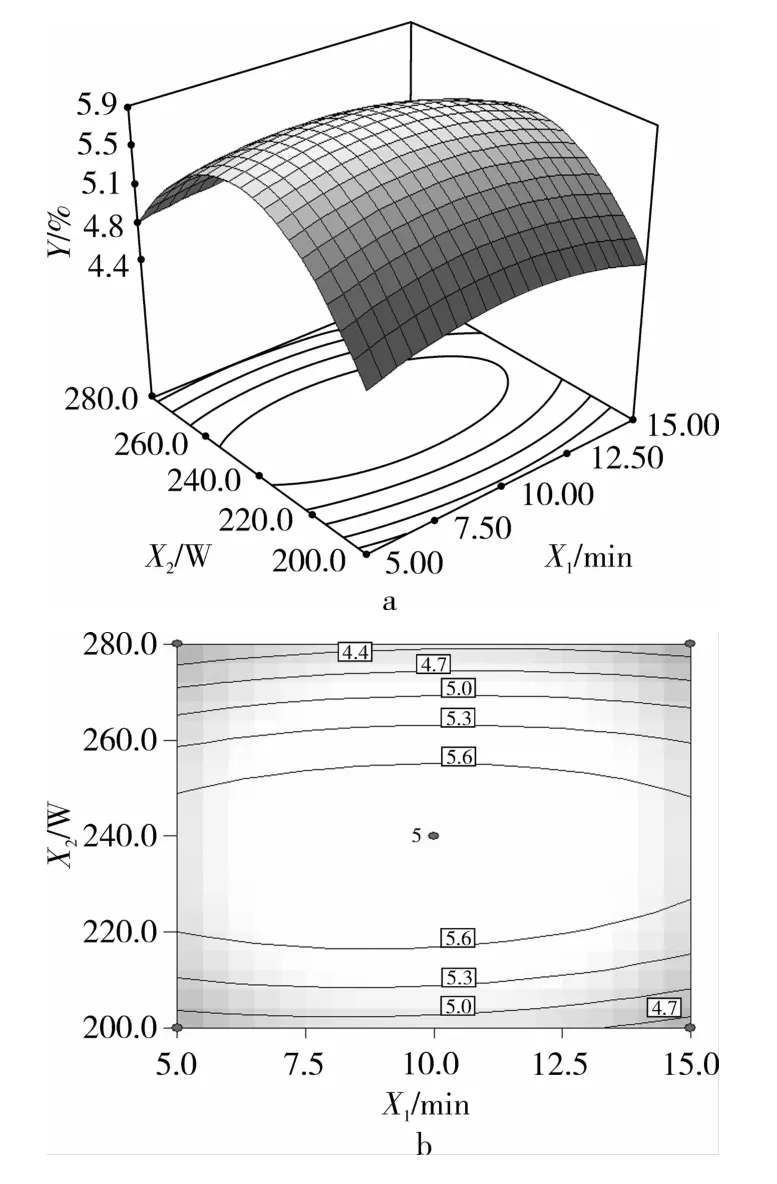
图6 DH=f(X1,X2)的响应面和等高图
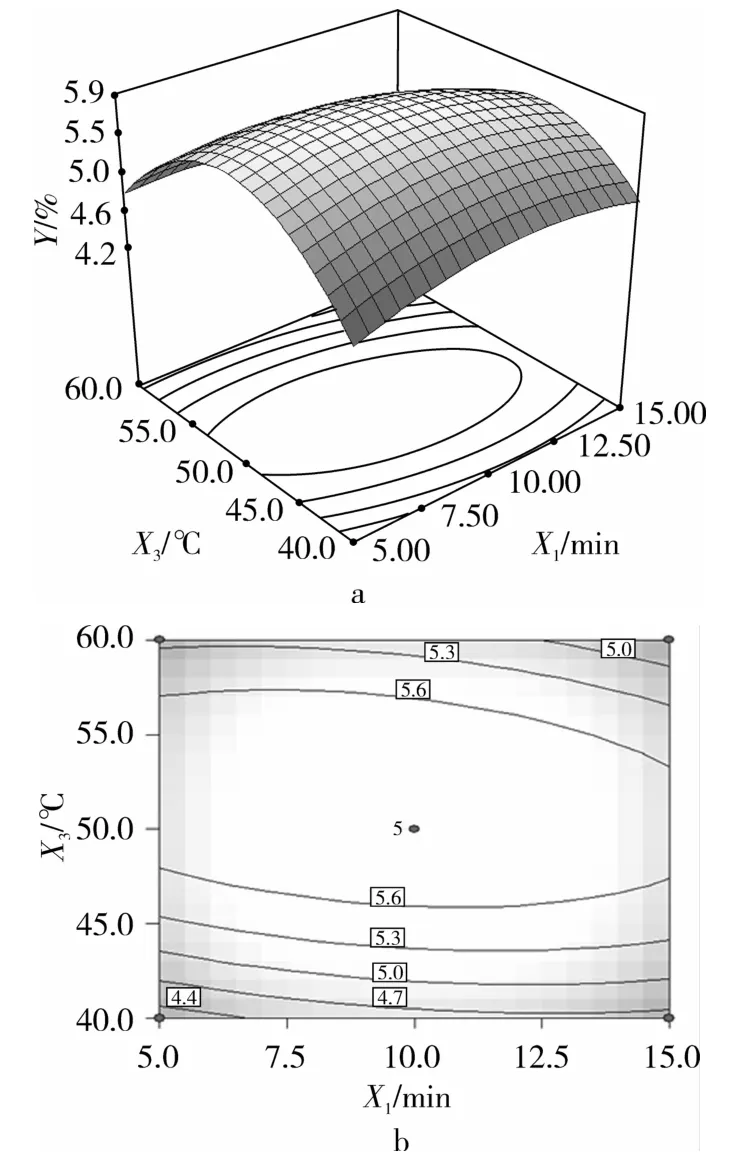
图7 DH=f(X1,X3)的响应面和等高图

图8 DH=f(X2,X3)的响应面和等高图
2.2.4 确定最佳工艺条件
由响应面分析可知,回归模型存在最大值,花生红衣多酚得率的最大值为5.97%,最高点位于试验设计范围内,最大值对应各因素:X1=9.24,X2=238.04,X3=50.54,即花生红衣多酚超声波辅助提取的最佳条件为:时间9.24 min,功率238.04 W,温度50.54℃。为检验RSM法的可靠性,采用上述最佳条件进行验证性试验,结合实际操作条件,将最佳工艺条件修正为:料液比1∶16(g∶mL),70%乙醇、超声时间9 min、超声功率240W、超声温度50℃,在此条件下进行3平行试验,花生红衣多酚平均得率为5.93%,与理论预测值5.97% 基本相符,说明回归方程能真实反映各因素对花生红衣多酚得率的影响,优化结果可靠,对于多酚提取工艺研究具有指导意义。
2.3 超声波辅助提取与传统提取方法的比较
分别采用传统提取法和超声波辅助提取法的工艺条件提取花生红衣多酚,结果见表5。由表5可知,在相同乙醇浓度、料液比和提取时间条件下,超声波辅助提取法获得的多酚得率(5.93%)远远高于传统提取法得率(2.80%)。超声波辅助提取增强了多酚物质的溶出和扩散,明显提高了多酚物质的提取得率。

表5 超声波辅助提取法和传统提取法效果比较
2.4 花生红衣多酚的抗氧化活性
以BHT作为阳性对照,研究花生红衣多酚对DPPH·的清除能力,如图9,在2~30 mg/g浓度范围内,随着花生红衣多酚浓度的升高,对DPPH·的清除能力逐渐增高,并呈良好量效关系;当花生红衣多酚含量为25 mg/g时,达到最大清除力,对DPPH·的清除率达81.2%,直至30 mg/g基本保持不变,明显强于BHT,可见花生红衣多酚具有较强的体外清除DPPH·能力。本试验初步研究了花生红衣多酚对DPPH·的清除能力,其作用机理有待深入研究。
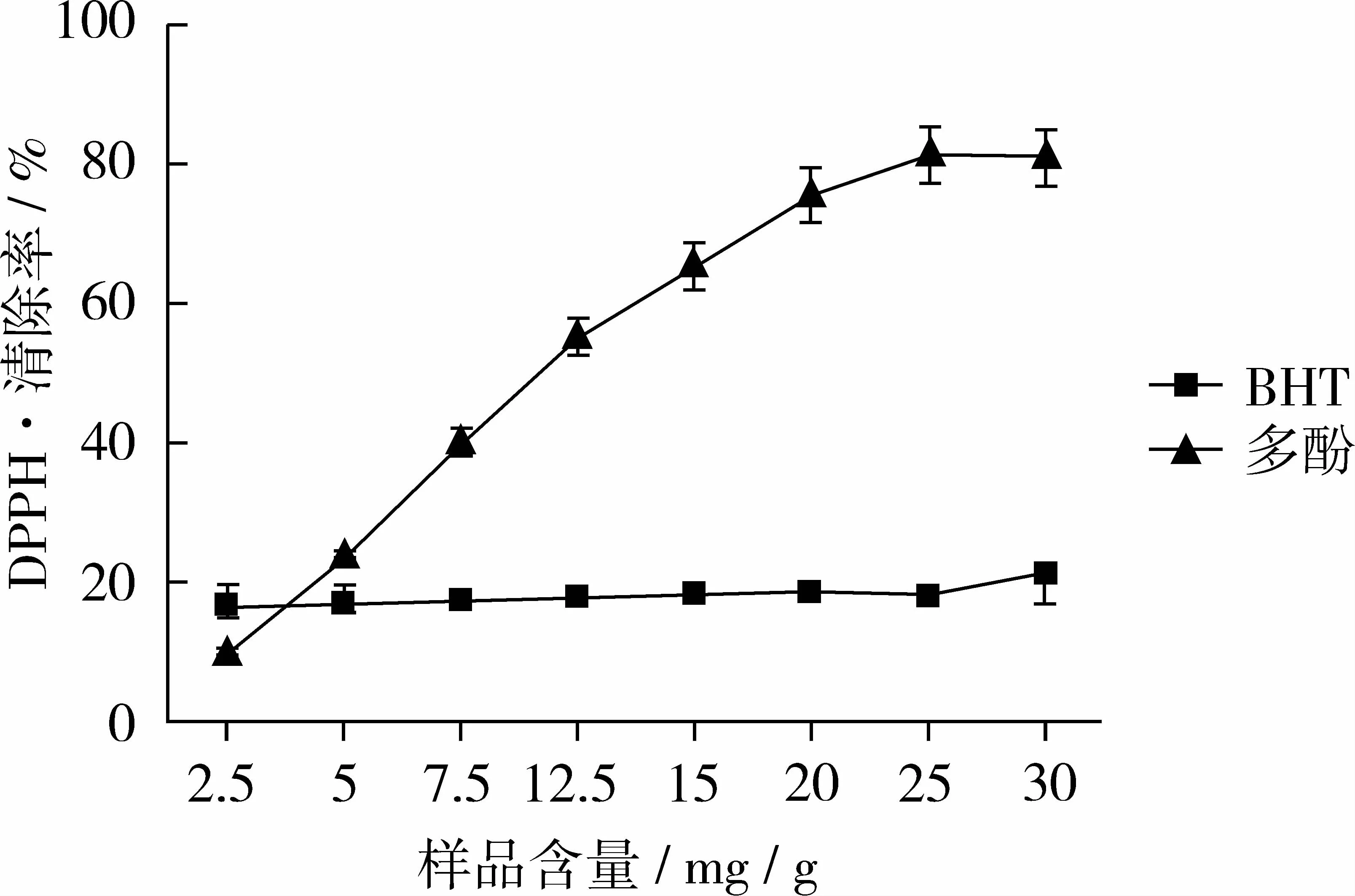
图9 BHT、花生红衣多酚对DPPH·的清除作用
3 结论
通过响应面分析可以得出,在超声辅助提取的各影响因素(超声功率、超声温度、超声时间)中,以超声温度对花生红衣多酚得率的影响最为显著,各因素间的交互作用明显,通过软件优化得出超声波辅助提取花生红衣多酚的最佳工艺条件为:料液比为1∶16(g∶m L),乙醇体积分数为 70%、超声功率为240 W、最佳温度为50℃、超声时间为9 min,花生红衣多酚平均得率为5.93%,与模型预测值(5.97%)基本相符,可信度高。在相同乙醇浓度、料液比和提取时间条件下,超声波辅助提取的花生红衣多酚得率远远高于传统提取法。因此,超声波辅助提取法是一种有效提取花生红衣多酚的方法。抗氧化活性检测发现,花生红衣多酚体外清除DPPH·的能力强于BHT,花生红衣多酚具有良好的体外抗氧化活性。
[1]Yuanyuan Ma,William L Kerr,George A Cavender,et al.Effect of Peanut Skin incorporation on the color,texture and total phenolics content of peanut butters[J].Journal of Food Process Engineering,2013,36(3):316-328
[2]Huang SC,Yen G C,Chang LW,etal.Identification of an antioxidant,ethyl protocatechuate,in peanut seed testa[J].Journal of Agricultural and Food Chemistry,2003,51(8):2380-2383
[3]Yen W J,Chang LW,Duh PD.Antioxidantactivity of peanut seed testa and its antioxidative component,ethyl protocatechuate[J].LWT-Food Science and Technology,2005,38(3):193-200
[4]Romina PPizzolitto,JoséS,Dambolena,María PZunino,et al.Activity ofnatural compounds from peanut skins on Fusarium verticillioides growth and fumonisin B1 production[J].Industrial Crops and Products,2013,47:286-290
[5]Tameshia S Ballard, Parameswarakumar Mallikarjunan,Kequan Zhou,et al.Microwave-assisted extraction of phenolic antioxidant compounds from peanut skins[J].Food Chemistry,2010,120(4):1185-1192
[6]Yoav Shem-tov,Hana Badani,Aharon Segev,et al.,Determination of total polyphenol,flavonoid and anthocyanin contents and antioxidant capacities of skins from peanut(Arachis Hypogaea)lineswith different skin colors[J].Journalof Food Biochemistry,2012,36(3):301-308
[7]Jianmei Yu,Mohamed Ahmedna,Ipek Goktepe,et al.Peanut skin procyanidins:Composition and antioxidant activities as affected by processing[J].Journal of Food Composition and Analysis,2006,19:364-371
[8]王凤舞,李鹏,朴美子.纤维素酶法提取花生红衣中的白藜芦醇[J],中国食品学报,2009,9(5):76-81
[9]Sales JM,Resurreccion A V A.Maximizing resveratrol and piceid contents in UV and ultrasound treated peanuts[J].Food Chemistry,2009,117:674-680
[10]Chandrasekaran S,Ramanathan S,Basak T.Microwave food processing-A review[J].Food Research International,2013,52(1):243-261
[11]Guowen Zhang,Mingming Hu,Li He,et al.Optimization ofmicrowave-assisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro[J].Food and Bioproducts Processing,2013,91(2):158-168
[12]王庆玲,罗小玲,董娟,等.花生红衣中原花色素超声提取工艺的优化[J],现代食品科技,2008,24(2):1284-1288
[13]Şahin S,Aybastler O,Işlk,E.Optimisation of ultrasonic-assisted extraction of antioxidant compounds from Artemisia absinthium using response surface methodology[J].Food Chemistry,2013,141(2):1361-1368
[14]赵萍,林樱姬,金征宇,等.超声辅助提取花生红衣中多酚物质及其抗氧化活性的研究[J].食品科学,2010,31(12):53-58
[15]赵萍,林樱姬,金征宇,等.花生红衣中多酚类物质清除DPPH自由基能力和抑菌性能的研究[J].食品工业科技,2010,31(10):129-133
[16]任虹,朱晓霞,韩东桓,等.微波辅助提取花生红衣多酚及其抗氧化活性研究[J].中国食品学报,2013,13(7):25-33.
Ultrasonic-Assisted Extraction of Polyphenols from Peanut Testa and Its Antioxidant Activity
Ren Hong1Xue Hongliang2Li Ting1Zhu Xiaoxia1
(Beijing Technology&Business University,Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Key Laboratory of Flavor Chemistry,Beijing Laboratory for Food Quality and Safety1,Beijing 100048)
(School of Public Health,Wuhan University2,Wuhan 430071)
The extraction technique of polyphenols from peanut seed testa and their antioxidant activity in vitro have been studied.One-factor-at-a-time and response surfacemethodology(RSM)have been applied to optimize the ultrasonic assisted extraction(SAE)of polyphenols from peanut seed testa.The antioxidants activity in vitro were assayed through scavenging effects on 1,1-diphenyl-2-picrylhydrazyl radical(DPPH).The results showed that the obtained optimum conditionswere ultrasonic assisted for extraction time 9 min,extraction temperature 50℃and extraction power 240W.The above conditions displayed different effects on polyphenol extraction yields as the following order:ultrasonic assisted extraction temperature>extraction power>extraction time.On the optimum condition,the polyphenols extraction yield was 5.93%,which was basically matched with the values predicted by the mathematicalmodel.Compared with traditional extraction,SAE had a better performance to extract polyphenols from peanut seed testa.The polyphenols from peanut seed testa exhibited significant antioxidant activity on scavenging DPPH in vitro,which can be utilized as a source of potential antioxidants.
polyphenols of peanut testa,ultrasonic assisted extraction,polyphenols,antioxidant activity
S565.2;TS209
A
1003-0174(2015)01-0117-07
863计划(2011AA060701)
2013-10-09
任虹,女,1967年出生,副教授,天然产物化学

