液相还原法制备高纯度微纳米银粉的研究
赵 爽,严 彪(同济大学材料科学与工程学院,上海201804)
液相还原法制备高纯度微纳米银粉的研究
赵 爽,严 彪
(同济大学材料科学与工程学院,上海201804)
摘 要:以硝酸银为原料,抗坏血酸为还原剂,聚乙二醇为分散剂及乳化剂,采用液相还原法直接制备得到平均粒径为100nm左右的颗粒状微纳米银粉,产物纯度高达100%。使用能谱、XRD等测试方法对所得微纳米银粉进行表征,探讨了在微纳米银粉制备过程中各因素对产物的影响。结果表明,在反应条件AgNO3浓度为0.1mol/L,抗坏血酸浓度为0.1mol/L,反应温度为30℃,搅拌速度为500r/min时,采用本方法直接制备微纳米银粉得到的产物纯度高达100%,且分散性良好。
关键词:微纳米银粉;液相还原法;硝酸银;聚乙二醇
(E-mail)rukawazhao@126.com,(Tel)13764590493
通讯联系人:严彪,教授,主要从事先进金属材料的制备和应用、金属表面处理等研究,(E-mail)yan_biao@mail.tongji.edu.cn
微纳米银粉在结构上具有晶粒尺寸小,且晶界尺寸大的特点,使得微纳米银粉具有常规材料无法比拟的优异特性。这些优异特性包括:消光性,优良的导电性,低熔点,杀菌性等等。其中,导电性及低熔点特性应用最多,且主要应用在电子工业中,如厚膜集成电路、多层陶瓷电容器、导电油墨、太阳能电池电极等。[1]
目前,微纳米银粉的制备方法大致可分为物理法和化学法。物理法主要有气相蒸发凝聚法、研磨法和雾化法等。[2]化学法主要有液相化学还原法、液固相化学还原法等,其中液相化学还原法因其成本较低,制备工艺及设备要求相对简单,产物的粒径及形状较易控制,同时还可以配合球磨等方法获得其他形状的银粉颗粒等优点,被广泛应用于微纳米银粉的制备,并成为工业上制备微纳米银粉的主要方法。
以硝酸银为原料,抗坏血酸为还原剂制备微纳米银粉,近几年报道量逐渐增加。例如,梁敏等采用硝酸银、抗坏血酸为反应原料,油酸为分散剂制备超细银粉;甘卫平等采用硝酸银、抗坏血酸作为反应原料,柠檬酸三钠作为分散剂制备超细银粉。但是,以硝酸银-抗坏血酸-聚乙二醇体系制备微纳米银粉,且聚乙二醇兼顾分散剂及乳化剂还鲜见报道,而且,对微纳米银粉的纯度控制也未作为探讨内容。为此,笔者采用抗坏血酸为还原剂,聚乙二醇为分散剂及乳化剂,采用液相化学还原法制备微纳米银粉,并对产物性能进行表征。旨在探讨一种采用较低成本、较少助剂获得纯度较高、粒度较小且分散性良好的微纳米银粉的方法。
1 实验
1.1 主要试剂及仪器
硝酸银(AgNO3),AR级,相对分子质量169.88;各元素质量分数:Ag为63.50%,N为8.25%,O为28.25%;熔点212℃,上海精细化工材料研究所。聚乙二醇(HO(CH2CH2O)nH),AR级,国药集团化学试剂有限公司。抗坏血酸(C6H8O6),AR级,相对分子质量176.12,熔点190~192℃,国药集团化学试剂有限公司。无水乙醇(C2H6O),AR级,相对分子质量46.07,沸点78.3℃,国药集团化学试剂有限公司。去离子水。
MA110型电子分析天平,上海卓精;HH-1型数显恒温水浴锅,常州普天仪器制造有限公司;PS-30A超声清洗机,durasonic;TM3000型台式扫描电子显微镜,日立;EDAX能谱仪,日立;Y-2000A型X射线衍射仪,丹东奥射线仪器有限公司。
1.2 实验原理
本实验所采用的制备微纳米银粉的方法化学反应方程式如下:
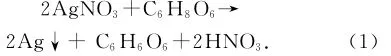
由反应方程式(1)可知,该反应理论上抗坏血酸与AgNO3的摩尔比是1∶2,但是在实际实验操作中,为了保证AgNO3被全部还原,抗坏血酸的用量要比理论用量多。式中,Ag+的标准氧化还原电位为+0.799 5V;抗坏血酸的氧化还原电位随pH变化而变化,pH=4时,抗坏血酸的氧化还原电位是+0.127V;pH=7时,抗坏血酸的氧化还原电位是+0.34V[3]。理论上,在pH<7时,必须有催化剂存在,抗坏血酸才能被氧化;而本反应体系中,作为氧化剂的Ag+对抗坏血酸的氧化反应有催化作用,因此,在pH=4~7区间范围内,我们不需再引入其他催化剂就可以进行抗坏血酸与Ag+发生氧化还原反应。
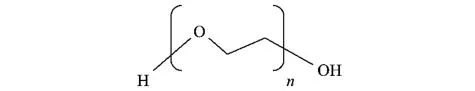
以下为聚乙二醇的结构式:从结构式中我们可以看到,聚乙二醇含有羟基和醚键两种亲水基且没有疏水基,它的水溶性、稳定性极好,不易受到电解质及酸、碱的影响,并且它在水溶液中呈蛇形,极易与被还原的金属单质粒子表面形成较强的氢键,其醚键也极易与单质粒子发生亲和作用,使得聚乙二醇能够较容易地吸附在粒子表面,形成一层高分子膜,包裹住金属单质粒子;而其分子键呈蛇形伸向水溶液中,使得包裹在粒子表面的保护膜具有一定的厚度,当带同性电荷的胶体质点互相接近时,静电斥力加上高分子的空间位阻效应,使得单质粒子之间的吸引力大大减弱,从而有效地阻止粒子生长,抑制粒子的团聚,起到分散以及乳化的作用。
1.3 实验过程
称取适量AgNO3,加入去离子水配成100mL硝酸银溶液A;称取适量抗坏血酸和聚乙二醇,加入去离子水,配成100mL溶液B;用浓氨水和浓硝酸调节溶液B的pH值在合适数值,将溶液B倒入250mL烧杯中,置于恒温水浴锅中,控制搅拌速度为500r/min;以3mL/min的速度向烧杯内滴加溶液A,待溶液A滴完,继续恒温搅拌10min使反应完全。经沉淀过滤后,将所得沉淀先用去离子水清洗数次,再用无水乙醇在超声波清洗机内进行超声清洗30min,然后将清洗过后的沉淀置于真空干燥箱内,恒温60℃干燥5h,得到银粉。将所得银粉置于扫描电子显微镜下观察形貌、粒度以及进行成分分析。其简要工艺流程如图1所示。
图1 实验流程图Fig.1 Experimental flow chart
2 结果与讨论
2.1 微纳米银粉表征
为了解反应制得的超细银粉的纯度、形貌、粒度等情况,笔者依次采用了X射线衍射仪(XRD)、EDAX能谱仪以及扫描电子显微镜,对制得的产品进行相关分析。
图2为反应制得的超细银粉的XRD图谱。对图中显示数据进行分析可以看出,产物的主要衍射峰的2θ角分别为38.16°,44.32°,64.40°,77.44°,与标准衍射卡JCPDS No.04-0783上的数据(2θ角为38.096°,44.257°,64.406°,77.452°)基本吻合;分别对应立方晶系银的(111)、(200)、(220)、(311)晶面,单质Ag的特征峰,说明采用本方法制得的产品全为Ag单质,产物纯净,无氧化现象。
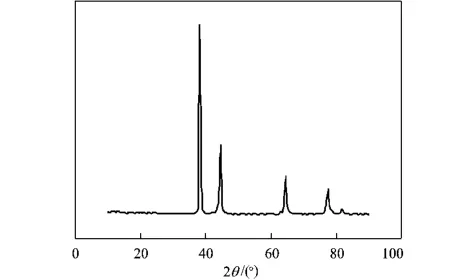
图2 实验所得银粒子的XRDFig.2 XRD chart of silver powder particle
图3为采用EDAX能谱仪进一步分析得到的结果。图中显示产物纯度极高,达到100%。由此测试结果进一步验证了采用本实验所述方法制得的产物纯净,均为单质银,无氧化现象,也无其他杂质引入。
图4为通过SEM拍摄的银粉颗粒照片(随机抽取),从照片中我们可以看出,采用本方法制得的
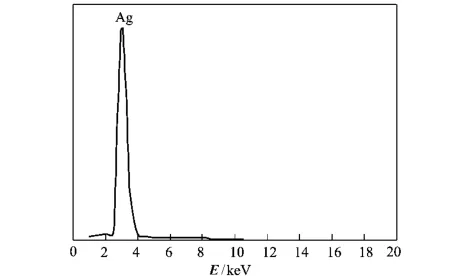
图3 实验产物粒子的X射线能谱分析结果Fig.3 EDAX result of silver powder particle
微纳米银粉呈颗粒状,颗粒较小,粒径为100nm左右,分散性较好,但是存在部分团聚现象。

图4 实验产物银粒子的SEM(随机抽取)Fig.4 SEM images of silver powderparticle size(random selection)
2.2 产物纯度影响因素分析
化学反应中,常见的造成产物纯度不够的原因大致有以下几种:
1)参与化学反应的反应物本身是微溶或者难溶的,因为化学反应都为可逆反应,不能100%把反应物完全转化为生成物,因而未反应的微溶或难溶的反应物会和产物混合在一起;
2)一些化学反应需要在催化剂存在的条件下才能进行,如果该反应所需的催化剂是微溶或难溶与反应体系的物质,那么反应产物中必然会混入这些催化剂,除非采用其他方法去除;
3)化学反应获得的产物性质活泼,极易与外界环境中的物质(例如:空气,水等)进行反应,从而被氧化或是生成其他物质,造成得到的目标产物不纯的结果;
4)反应进行的环境不够清洁,反应体系中混入其他不溶杂质。
针对上述几种原因,对照我们氧化还原反应的实验过程可知,在本文所述的方法中,反应物是硝酸银溶液和抗坏血酸,这两种物质的水溶性都相当好,就算在水溶液反应体系中是反应物和产物三者共存的情况,通过清洗和烘干这两步也可以将它们与产物银单质分离开。本反应体系中,Ag+对反应有催化作用,无需再引入其他催化剂就可以保证反应进行,不存在加入其他难溶催化剂造成的产物不纯结果。因为本反应全程在实验室进行,因而也不存在引入环境中的不溶杂质的可能。如果得到的产物在测试表征的时候出现产物不纯的情况,那么原因基本上可以认定是因为反应获得的微纳米银粒子因其粒径小、具有一定分散性,与空气的接触面积大,且其表面能较高、活性大,与空气接触发生氧化反应生成氧化物造成的。银粒子与空气的氧化反应的发生可能是在氧化还原反应进行过程中,也可能是在后续的清洗烘干等过程中。
2.3 产物粒度和分散性影响因素分析
2.3.1 硝酸银溶液浓度
在其他反应条件不变的情况下,随着AgNO3溶液浓度增大,还原产物Ag粒子的粒径逐渐增大。因此,要想得到粒径较小的产物,反应物AgNO3的浓度不能太高。
通过本实验的氧化还原反应方程式(1)也能得出上述结论。由(1)式可知,在其他反应条件不变的情况下,增大氧化物AgNO3浓度,反应体系中Ag+浓度增大,该反应向正反应方向进行的反应速率加大,单位时间内生成的单质Ag粒子增多。同时,由于分散剂局部相对不足,会造成分散剂不能及时发挥对还原产物Ag的分散作用,不能有效阻止大量Ag粒子团聚,从而造成产物粒径较大的现象。
但是反应物的浓度不能太低,浓度太低会造成单位体积的反应体系中参与反应的反应物粒子数量过少,会降低反应速率,也不利于达到反应平衡时的转化率,不利于生产需要。经过实验,笔者认为选择AgNO3溶液的初始反应浓度为0.1mol/L左右比较合适。
2.3.2 搅拌速度
搅拌速度较低的时候,银粉粒度随着搅拌速度增大而减小;而增加搅拌速度达到一定值的时候,银粉粒度反而呈现增大趋势。经分析,出现上述现象的原因有如下2点:
1)搅拌速度较低时,该氧化还原体系在反应过程中局部AgNO3溶液浓度过大,正反应方向的反应速度过快,而该局部的分散剂的浓度相对不足,分散剂不能及时有效地发挥对产物颗粒的分散作用来阻止银粉粒子的团聚以及银粉粒子的生长,从而得到的产物粒径较大。
2)搅拌速度较大时,虽然能较好地对AgNO3溶液进行分散,不会造成局部反应物浓度过大的现象,但是会增加还原产物银粉粒子之间相互碰撞的几率,同样会造成因银粉粒子团聚而使产物粒径增大的情况,不利于得到粒径较小的微纳米银粉粒子。通过实验验证可得,该反应较佳的搅拌速度为500 ~600r/min。
2.3.3 分散剂用量
本实验采用的分散剂为PEG1000。经试验可知,随分散剂用量逐渐增大,产物粒径逐渐减小;但是分散剂用量达一定程度后,增加分散剂用量,产物粒径减小不明显。
分析此现象的原因在于反应体系中分散剂的相对含量。体系中分散剂含量少、浓度低的时候,在氧化还原反应进行过程中,分散剂不能及时将还原反应所获得的银粒子及时包裹起来,不能有效阻止银粒子长大,也不能有效发挥其空间位阻效应来阻止产物粒子的接触团聚;随着体系中分散剂含量增加,有充足的分散剂可以吸附在银粒子表面,形成保护薄膜,可以有效阻止反应生成的银粒子长大,还可以有效发挥其空间位阻效应,阻止银粒子的相互接触团聚。
但是,分散剂用量也不是越大越好。结合实验结果以及反应成核机理等笔者认为,反应体系里分散剂的用量存在一个临界点,在未到达该临界点之前,反应产物的粒度是随着反应体系里分散剂含量的增加而减小;到达临界点之后,继续增加反应体系里分散剂的含量,产物粒径变化不大。这是因为到达临界点之后,反应体系里的分散剂已经足够把反应产物及时包裹起来,阻止还原产物粒子的长大,并能有效发挥空间位阻效应,阻止产物粒子的接触团聚,起到良好的分散作用。在此情况下,再增加分散剂的用量一方面会造成原料浪费,另一方面则会造成反应体系溶液黏度增大,不利于后续的银粉清洗工作。所以,应根据实际情况,选择合适的分散剂用量。根据实验结果,本实验选用分散剂用量为0.2mol/L。
2.3.4 反应温度
根据Volmer-Weber成核速率公式我们可以知道,成核速率会随着温度的持续升高出现先增大后减小的状态。因此,我们可以推定应该存在最佳温度点,使得反应获得的银粉粒度最小。关于这方面的研究前人有探讨过,考虑到工业化生产实际操作的难易度,本文不探讨那个最佳温度点,而是选择更易于达到的室温。
2.3.5 反应物溶液滴加速度
溶液A向溶液B的滴加速度对产物粒度的影响,我们可以参考反应物浓度的影响,滴加速度快相当于局部反应物浓度较大,生成的微纳米银粉粒度较大;反之,产物粒度较小。但是滴加速度不能太低,一方面,还原剂抗坏血酸空气环境下稳定性不是很好,长期置于空气中会氧化,失去作为还原剂的反应活性;另一方面,虽然较低的滴加速率可以较好保证产物银粒子的粒度较小,但是会使反应时间过长,不利于生产需要。所以,反应时间控制在30min左右即可。
3 结论
以AgNO3为原料,抗坏血酸为还原剂,聚乙二醇为分散剂及乳化剂,AgNO3溶液浓度为0.1mol/L,抗坏血酸浓度为0.1mol/L,聚乙二醇浓度为0.2mol/L,30℃下反应,搅拌速率为500 r/min,采用化学还原法可以制得纯度高达100%,且稳定性较好的微纳米银粉,其平均粒度约为100 nm,分散性较好。本法所用实验试剂及助剂种类较少,价格相对低廉且无毒副作用,实验方法操作简便,适合工业化生产。
参考文献:
[1] 甘卫平,罗贱,郭桂全,等.化学还原法制备电子浆料用超细银粉[J].电子元件与材料,2010,29(11):15-18.
[2] 梁敏,唐霁楠,林保平.电子浆料用球形超细银粉的制备[J].中国粉体技术,2006(3):16-19.
[3] 邓彤,史建军.用抗坏血酸还原氯化银[J].贵金属,1997,18(4):20-23.
[4] Abdel-Aal E A,Farghaly F E.Preparation of silver powders in micron size from used photographic films via leaching cementation technique[J].Powder Technology,2007,178:51-55.
[5] 袁林生,沈晓冬,崔升,等.液相还原法制取纳米银粉的研究[J].电子元件与材料,2006,25(6):40-42.
[6] 李明利,周宇松,纪松,等.球形纳米银粉的制备与微结构研究[J].兵器材料科学与工程,2010,33(4):1-3.
[7] Nersisyana H H,Leea J H,Sona H T,et al.A new and effective chemical reduction method for preparation of nanosized silver powder and colloid dispersion[J].Materials Research Bulletin,2003,38:949-956.
[8] 周全法,徐正,包建春,等.还原保护法制备纳米级银粉的研究[J].精细化工,2001,18(1):39-42.
[9] 李小莉,杨东方.纳米晶铁纤维的制备及其电磁参数的测量[J].太原理工大学学报,2012,43(1):42-46.
作者简介:赵爽(1984-),女,辽宁海城人,硕士生,工程师,主要从事先进金属材料的制备和应用研究,
基金项目:国家自然科学基金资助项目:可降解镁合金/仿生纳米羟基磷灰石涂层体系的构建及其对成骨的调控机制(51471120)
收稿日期:*2014-10-11
文章编号:1007-9432(2015)03-0263-05
DOI:10.16355/j.cnki.issn1007-9432tyut.2015.03.003
文献标识码:A
中图分类号:TB383

