商洛绿茶多糖的分离纯化及体外抗氧化和抗肿瘤活性研究*
何念武,李丹
(商洛学院 生物医药与食品工程学院,陕西 商洛,726000)
茶叶Camellia sinensis(L.)O.Kuntze为双子叶植物纲山茶属植物茶树的新鲜嫩叶炮制而成,唐代陈藏器在《本草拾遗》中提到:“诸药为各病之药,茶为万病之药”,说明茶最初是作为药物来使用的,正如宋代林洪撰的《山家清供》中亦有“茶,即药也”的论断一样,这些都足以证明茶叶有着重要的药用价值[1]。现代科学研究表明,茶叶富含多种生物活性成分,诸如茶多酚、茶多糖、咖啡碱、氨基酸、维生素等等[2-3]。医学营养学研究表明,绿茶具有广泛的药理活性,诸如抗氧化、抗肿瘤、降血压、降血糖及防治心脑血管疾病等功效[5]。由于茶叶中含有大量茶多酚具有很强的抗氧化活性,是人体自由基的天然清除剂,可以有效阻断亚硝酸胺等多种致癌物质在体内的合成[6]。同时,它还能吸收放射性物质以达到防辐射的效果,从而保护女性皮肤[7]。目前,有关茶多酚药理作用的研究已有很多[5]。然而,对其另外一种活性成分茶多糖的研究则远比不上茶多酚,再加上多糖结构复杂,分离纯化难度大等制约因素,从而使得多糖结构与活性研究成为了热点[8]。
商洛绿茶因所处的独特地理位置造就了其色香、味浓、耐冲泡的优良品质,当前商洛茶叶正处于蓬勃发展之中,如何从科学的角度去阐述商洛绿茶的药用价值或营养价值就显得非常重要。为此,本文就商洛绿茶茶多糖分离纯化及其体外活性加以探讨,以期为深度开发商洛绿茶的药用和营养保健价值提供理论依据。
1 材料与方法
1.1 实验材料与仪器
1.1.1 材料与试剂
商洛绿茶,于2014年6月采自陕西省商洛市商南县茶园,经商洛学院生物医药与食品工程学院王新军教授鉴定为山茶科山茶属植物茶树的新鲜嫩叶。
氮蓝四唑(NBT),上海蓝季科技发展有限公司;抗坏血酸(VC),天津市天力化学试剂有限公司;1.1-二苯基-2-三硝基苯肼(DPPH)、碘化丙啶(PI)、还原型辅酶(NADH)、吩嗪甲硫酸盐(PMS)、二甲亚砜(DMSO)、BHT(二丁基羟基甲苯)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)、无DNA酶活性的 RNA酶,均购于 Sigma-Aldrich(St.Louis,MO,USA);RPMI-1640 细胞培养液,购自GIBCO公司(Grand Island,USA);胎牛血清(FBS),购于杭州四季青生物公司;其他试剂均为分析纯,实验用水为蒸馏水。
1.1.2 仪器
可见分光光度计,上海精密科学仪器有限公司;FA1104型电子天平,上海精科天平厂;CO2培养箱,美国Thermo公司;电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;RT6000酶标仪,深圳雷杜生命科学股份有限公司;高压灭菌器,上海博讯实业有限公司;TGL-20bR高速冷冻离心机,上海安亭科学仪器厂。
1.2 实验方法
1.2.1 商洛绿茶多糖(SGTPs)的分离纯化
商洛绿茶粗多糖的制备参照何念武[8]的方法进行,以热水浸提-乙醇沉淀法制得。称取一定量的粗多糖样品,溶解后过DEAE-52纤维素柱层析,收集不同的茶多糖组分,采用苯酚-硫酸法测定总糖含量[9-10]。
1.2.2 不同组分的商洛绿茶多糖体外抗氧化活性
参照 Tian[11],He[12]等方法并加以适当改进,分别在DPPH自由基,超氧阴离子,羟基自由基和ABTS自由基体系上检测不同组分茶多糖的体外抗氧化活性。将不同组分的样品多糖和BHT分别用蒸馏水配制成1.0,1.5,2.0,2.5,3.0,3.5,4.0 mg/mL 的剂量,然后在上述抗氧化体系上进行检测,所有实验均重复3次以上。
(1)DPPH自由基:精确吸取不同浓度的茶多糖样品和BHT溶液各1 mL置于10 mL刻度离心管中,然后加入0.08 mmol/L的DPPH溶液(乙醇为溶剂)3 mL,室温,避光反应25 min,最后于517 nm测其吸光度值,按照下述公式计算清除率:
IR/%= [(Ai-Ab)/Aj]× 100
其中,Ai为样品吸光值(多糖样品 +DPPH);Aj为阴性对照(DPPH+样品溶剂);Ab为样品本底吸光值(样品 +溶解DPPH的溶剂)。
(2)超氧阴离子:量取不同浓度的茶多糖样品和BHT溶液各1 mL置于10 mL刻度离心管中,然后加入0.08 mol/L的NBT水溶液1 mL,再加入1 mL的NADH水溶液(浓度为0.5 mol/L),最后加入0.5 mL的PMS水溶液,室温下摇匀、反应10 min,而后于560 nm测其吸光度值,按照下述公式计算清除率:
IR/%= [(Ai-Ab)/Aj]× 100
其中,Ai为样品吸光值(多糖样品 +NBT+NADH+PMS);Aj为阴性对照(NBT+NADH+PMS+样品溶剂);Ab为样品本底吸光值(样品 +蒸馏水)。
(3)羟基自由基:参照 Tian[11],He[12]等方法进行。
(4)ABTS自由基:①ABTS自由基的制备:7 mmol/L的ABTS水溶液和2.45 mmol/L的过硫酸钾溶液等体积混合;②取不同浓度的茶多糖样品和BHT溶液各0.5 mL加入含有3.5 mL的ABTS自由基溶液的离心管中,室温、静置10 min,最后于734 nm测其吸光度值,按照下述公式计算清除率:
IR/%= [1-(Ai-A0)/Aj]× 100
其中,Ai为样品吸光值(多糖样品 +ABTS);Aj为阴性对照(ABTS+样品溶剂);A0为样品本底吸光值(样品+溶解ABTS的溶剂)。
1.2.3 不同组分的SGTPs对乳腺癌细胞(MCF-7)的生长抑制作用
在体外培养的肿瘤细胞模型上,以MTT法筛选具有抑制 MCF-7细胞生长的活性多糖组分[12-14]。具体而言,取对数生长期细胞,制成细胞悬液,并调浓度至5×104~1×105个/mL,接种于96孔细胞培养板。每孔加90 μL,置37℃,5%CO2细胞培养箱中培养24 h后,分别加入10 μL用生理盐水配制而成的不同浓度(0.0、50.0、150.0、200.0 μg/mL)的茶多糖样品溶液,以5-氟尿嘧啶(5-Fu)为阳性对照,生理盐水和培养液作为阴性对照,继续培养44 h,加入20 μL MTT(5 mg/mL),4 h后加入SDS三联液终止反应,在酶标分析仪570 nm处测定吸光值,每个处理设3个重复。按以下公式计算细胞生长抑制率:
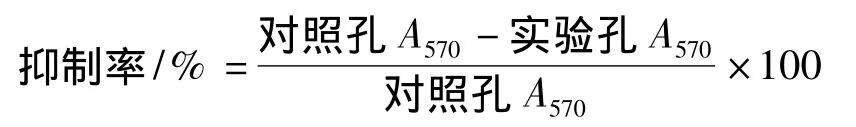
2 结果与分析
2.1 商洛绿茶多糖的分离纯化
如图1所示为SGTPs经DEAE-52纤维素柱分离后的结果。洗脱液分别采用0.05、0.15、0.45 mol/L NaCl溶液梯度洗脱,得到3个单一的洗脱峰。将收集到的 0.05、0.15、0.45 mol/L NaCl洗脱液洗脱部位,减压蒸馏,透析(分子截留量8 000 Da)3 d,每天换6次水,冷冻干燥,得到SGTPs-1、SGTPs-2、SGTPs-3三个组分。经测定3个组分的总糖含量分别为83.5%,76.8%,89.7%。
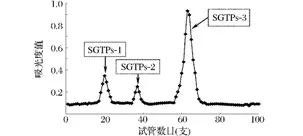
图1 SGTPs的DEAE纤维素柱色谱图Fig.1 Eluting curve of SGTPs on DEAE-52 column
2.2 SGTPs对DPPH自由基的清除能力
从图2中可以看出,SGTPs不同组分对DPPH自由基的清除率随着样品质量浓度的增加而逐步增加,并且呈现出较好的量效关系。尤其是在高浓度的时候,样品对DPPH自由基的清除率越接近相同剂量的阳性对照。另外,从图中还可以发现,SGTPs-2对DPPH自由基的清除能力最弱,SGTPs-3的清除能力最强,SGTPs-1介于二者之间,这可能是因为其多糖含量各异的缘故。
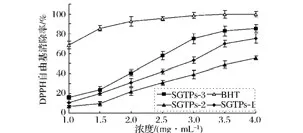
图2 SGTPs对DPPH自由基的清除率Fig.2 DPPH radical scavenging activity of SGTPs
2.3 SGTPs对超氧阴离子的清除作用
由图3中可以看出,SGTPs不同组分对超氧阴离子自由基的清除率随着样品质量浓度的增加而呈现较为缓慢的增加,但依然呈现出良好的量效关系。另外,从图中还可以发现,SGTPs-2对DPPH自由基的清除能力最弱,SGTPs-3的清除能力最强,SGTPs-1介于二者之间。当样品质量浓度达到4.0 mg/mL时,SGTPs-1、SGTPs-2和SGTPs-3对超氧阴离子的清除率分别为52.4%,46.3%,63.7%,而此时相同剂量的阳性对照清除率为100%。由此可见,SGTPs不同组分对超氧阴离子自由基的清除能力要比同剂量的阳性对照低的多。众所周知,每个人体内都有一定数量的超氧阴离子存在,如若不发生化学变化则对人体无害,但是受到外界刺激或是与羟基结合后的产物会导致细胞DNA损伤,破坏机体功能。研究表明,一定量的SGTPs能够起到清除超氧阴离子的效果,由此推测长期饮茶可以起到预防超氧阴离子对机体造成的损伤。
2.4 SGTPs对羟基自由基的清除作用
从下图4中可以看出,SGTPs不同组分对羟基自由基的清除率随着剂量不断增加几乎呈线性递增的趋势。当样品质量浓度从1.0 mg/mL增加到4.0 mg/mL的时候,SGTPs-3对羟基自由基的清除率依次为13.6%,24.5%,35.8%,43.7%,49.4%,55.5%,61.2%;SGTPs-1对羟基自由基的清除率则从8.5%上升到58.3%;而SGTPs-2对羟基自由基的清除率增长最为缓慢,亦是3个组分中清除率最低的一个组分,由此可见这与其多糖含量最低是分不开的。

图3 SGTPs对超氧阴离子的清除率Fig.3 Superoxide radical scavenging activity of SGTPs
图4 SGTPs对羟基自由基的清除率Fig.4 Hydroxyl radical scavenging activity of SGTPs
2.5 SGTPs对ABTS自由基的清除作用
从图5中可以看出,随着质量浓度的不断递增,SGTPs不同组分对ABTS自由基的清除率逐渐增加,而且呈现出较好的量效关系。尤其是当浓度为4.0 mg/mL时,样品对DPPH自由基的清除率接近相同剂量的阳性对照,SGTPs-1,SGTPs-2,SGTPs-3以及BHT对 ABTS自由基的清除率依次为80.4%,75.7%,85.8%和100%。另外,从图中还可以发现,SGTPs三个组分对ABTS自由基的清除率顺序仍然是SGTPs-3>SGTPs-1>SGTPs-1。SGTPs-2仍然是活性最弱的。

图5 SGTPs对ABTS自由基的清除率Fig.5 ABTS radical scavenging activity of SGTPs
2.6 SGTPs不同组分对不同自由基体系的半数有效浓度(EC50)
半数有效浓度(EC50),即能引起50%阳性反应(质反应)或50%最大效应(量效应)的浓度。半数有效浓度可快速地判断被试物质对反应体系可能产生的影响或效果,为进一步作慢性毒性研究提供依据。从下表1中可以看出,SGTPs各组分对不同自由基的EC50差异较大,有的组分与阳性对照差距比较小,而有的组分差距较大。其中,3个组分当中SGTPs-3的EC50相比之下是最小的,SGTPs-2则是最大的。另外,从中也可以看出,SGTPs对ABTS自由基的清除作用最好,其次是DPPH自由基,最后是超氧阴离子和羟基自由基。总体而言,3个组分总的抗氧化能力顺序依次为SGTPs-3> SGTPs-1>SGTPs-2。

表1 SGTPs对各自由基体系的EC50 单位:mg/mLTable 1 The free radical system EC50 of SGTPs
2.7 SGTPs不同组分对MCF-7细胞的生长抑制作用
从图6中可以看出,SGTPs不同组分对MCF-7细胞均有不同程度生长抑制作用,并且呈现良好的剂量效应关系。而且当 SGTPs浓度在200 μg/mL时,SGTPs-1的抑制率为51.29%,SGTPs-2的抑制率为48.63%,SGTPs-3的抑制率为61.83%,而此浓度下阳性药物的抑制率为70.71%。另外,3个组分的半数抑制浓度(IC50)依次为 206.55,227.91,157.06 μg/mL,而阳性对照的则是110.64 μg/mL,结果表明SGTPs-3对MCF-7细胞的生长抑制作用最强。同时,在相同时间、相同剂量的条件下,SGTPs处理后细胞的生长抑制率接近于同浓度的阳性药物(5-FU),说明商洛绿茶茶多糖对MCF-7细胞又较好的生长抑制作用。
3 结论
(1)通过热水浸提-乙醇沉淀法制备的粗多糖,经DEAE-52纤维素柱层析纯化后得到SGTPs-1,SGTPs-2,SGTPs-3三个组分,多糖含量分别为83.5%,76.8%,89.7%。
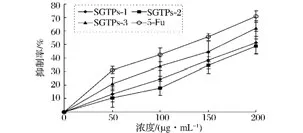
图6 SGTPs不同组分对MCF-7细胞的抑制率Fig.6 The different fractions of SGTPs on the inhibition rate of MCF-7 cells
(2)SGTPs对DPPH自由基、ABTS自由基、羟基自由基和超氧阴离子均有不同程度的清除能力,其中对DPPH自由基和ABTS自由基的清除能力较强,对另外两种自由基清除能力相对较弱。总体而言,商洛绿茶多糖3个组分对不同自由基的清除能力均呈现良好的量效关系,其中SGTPs-3组分的作用最强,其次为SGTPs-1,最后是SGTPs-2。当质量浓度达到4.0 mg/mL时,SGTPs-3对DPPH自由基、ABTS自由基、羟基自由基和超氧阴离子的清除率分别为85.4%,85.8%,61.2%和63.7%。
(3)对乳腺癌MCF-7细胞的生长抑制作用研究结果表明,SGTPs3个组分对MCF-7细胞均有一定的生长抑制作用,且伴随着质量浓度的增加而呈现递增趋势。在浓度为200 μg/mL时,SGTPs三个组分的生长抑制率分别为51.29%,48.63%和61.83%。
[1] 何念武.紫阳富硒绿茶茶多糖与茶多酚抗肿瘤药理作用研究[D].西安:陕西师范大学,2012:1-2.
[2] 刘爽.绿茶鲜爽味的化学成分及判别模型研究[D].北京:中国农业科学院,2014:2-5.
[3] 魏威.绿茶化学成分及其抗氧化活性的研究[D].大连:辽宁师范大学,2010:4-6.
[4] 师少军,陈华庭,曾繁典.绿茶的药理作用与临床应用[J].中国医院药学杂志,2010,30(8):692-696.
[5] 李军,辛勤,杨雁.绿茶多酚药理作用的研究进展[J].中国热带医学,2014,14(1):128-130.
[6] 赵保路.茶多酚的抗氧化作用[J].科学通报,2002,47(16):1 206-1 210.
[7] 吴亮宇,林金科.茶多酚抗辐射研究进展[J].茶叶,2011,37(4):213-217.
[8] 何念武.水提醇沉法制备商南泉茗茶茶多糖的研究[J].商洛学院学报,2013,27(6):78-81.
[9] 张倩,张民,王超,等.枸杞多糖分离纯化及结构研究[J].食品与发酵工业,2014,40(12):41-47.
[10] 杨红燕,严楠楠,姜艳红,等.苦荞茶多糖的体外抗氧化活性及其分离纯化[J].食品与发酵工业,2014,40(12):94-99.
[11] TIAN Lingmin,ZHAO Yan,GUO Chao,et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J].Carbohydrate Polymers,2011,83(2):537-544.
[12] HE Nianwu,YANG Xingbin,JIAO Yadong,et al.Characterisation of antioxidant and antiproliferative acidic polysaccharides from Chinese wolfberry fruits[J].Food Chemistry,2012,133(3):978-989.
[13] HE Nianwu,SHI Xiaolong,ZHAO Yan,et al.Inhibitory effects and molecular mechanisms of selenium-containing tea polysaccharides on human breast cancer MCF-7 Cells[J].Journal of Agricultural and Food Chemistry,2013,61(3):579-588.
[14] ZHANG Haisheng,ZHANG Min,YU Linhong,et al.Antitumor activities of quercetin and quercetin-5,8-disulfonate in human colon and breast cancer cell lines[J].Food and Chemical Toxicology,2012,50(5):1 589-1 599.

