阿司匹林预处理对豚鼠内耳缺血再灌注损伤后细胞凋亡的影响
许险艳 王庆林 李德水 谢永华 林文东
(泉州医学高等专科学校,泉州362000)
阿司匹林(aspirin,ASA)的神经保护作用在缺血性脑血管疾病的治疗与预防中已得到临床医生的广泛共识。已有的研究结果表明,ASA对脑缺血再灌注损伤(ischemian-reperfusion injure,IRI)的神经保护作用与抗细胞凋亡有关[1],但是ASA是否对内耳IRI导致的细胞凋亡也有神经保护作用尚不明确。本实验的目的是建立豚鼠内耳IRI模型,观察ASA预处理对豚鼠内耳IRI后细胞凋亡的影响,研究内耳IRI的病理机制,为ASA的临床应用提供新的理论依据。
1 材料与方法
1.1 实验动物与分组
豚鼠由福建医科大学动物中心提供,清洁级,许可证号为松联2007-001102370,共64只,体重250~300g,雌雄不拘,要求健康、耳廓反应灵敏、鼓膜完整。将豚鼠随机分成正常组、假手术组、模型组和干预组,后两组再各分为3个亚组:IRI 6h组、24h组及48h组,每组8只。
1.2 动物模型的建立
10%水合氯醛(100mg/kg)腹腔注射麻醉,颈前正中切开,分离各层组织,暴露锁骨下动脉及其分支椎动脉,并分离一侧颈总动脉。灼断双侧椎动脉、用微动脉夹夹闭一侧颈总动脉后计时为缺血时间,30min后松开动脉夹,手术显微镜下观察到血液复流后计时为再灌注时间。干预组在缺血前腹腔注射阿司匹林50mg/kg(北京拜耳医药保健有限公司生产,批号为J20080078,剂量为100mg/片,研碎溶于生理盐水2ml),每天一次,共7d。假手术组术前等量生理盐水腹腔注射共7d,手术时切开皮肤分离组织暴露双侧椎动脉和一侧颈总动脉后,不做任何处理,30min后即断头取材。
1.3 耳蜗组织切片检查
动物麻醉后4%多聚甲醛(北京赛驰科技生物有限公司)行活体心脏灌注,断头取出听泡,打开听泡暴露耳蜗,置于4%多聚甲醛中4℃固定24h,10%EDTA(100g/L,上海生工生物工程有限公司生产)脱钙7~15d,梯度酒精脱水,二甲苯透明,石蜡包埋,平行于耳蜗中轴切片,片厚4μm,进行HE染色,另备切片用于TUNEL细胞凋亡检测。
1.4 耳蜗细胞凋亡检测(TUNEL法)
石蜡切片常规脱蜡、水化,滴加蛋白酶K工作液于37℃湿盒中孵育20min,PBS冲洗5min×3次;按 TUNEL试剂盒(Santa Cruz Biotechnology,Inc.)说明书比例将酶溶液加入标记液中获得TUNEL反应混合液,滴加到组织片上,37℃湿盒中孵育60min,PBS冲洗5min×3次;滴加转化-POD于样品上,37℃湿盒中孵育30min,PBS冲洗5min×3次;DAB显色,苏木素复染,脱水透明后中性树胶封片。)。每批次均设对照片,用已知阳性片做阳性对照,滴加未混入酶溶液的标记液做阴性对照,
1.5 数据收集和分析
显微镜下每张HE染色切片观察耳蜗形态的改变;每只动物取3张TUNEL染色切片,显微镜下每张切片随机取6个视野,Corti器和螺旋神经节各3个,计算每个视野内凋亡细胞的个数,取其平均值表示该动物该部位凋亡细胞数。
实验数据均以均数±标准差(±s)表示,运用SPSS 13.0统计软件。正常组、假手术组、模型组之间进行方差分析比较组间差异,正常组与假手术组和模型组、干预组与模型组缺血再灌注组同时间段之间进行LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 耳蜗形态学检测
正常组、假手术组耳蜗HE染色见Corti器完整,血管纹清晰。模型组耳蜗Corti器变形、毛细胞缺失、倒伏;血管纹变薄,细胞间有空泡,螺旋韧带萎缩或脱落,螺旋神经节细胞缺失,其中以IRI 24h组损伤最严重。干预组豚鼠耳蜗Corti器、血管纹、毛细胞、螺旋神经节亦有同样改变,但程度较模型组为轻(见图1)。
2.2 耳蜗细胞凋亡检测
光镜下TUNEL染色阳性细胞胞核为棕褐色,伴有核的形态不规则或固缩。正常组、假手术组罕见凋亡细胞,两组间差别无统计学意义。模型组耳蜗缺血再灌注各时间点在上述两个部位阳性细胞明显增多,与正常组相比有显著性意义(P<0.01)。干预组较模型组在每个时间点上每个部位阳性细胞明显减少,差别有统计学意义(P<0.05)(见图2、表1)。
3 讨论
ASA也叫乙酰水杨酸,是一种历史悠久的解热镇痛药,有广谱药理活性和多个作用位。进入机体后易吸收、在全身组织分布广、作用强,用于治感冒、发热、疼痛、风湿病等的治疗,另外还能抑制血小板聚集、抗血栓,用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成。随着对IRI研究的深入,发现ASA对IRI导致的神经细胞凋亡也有很好的抑制作用。
IRI导致细胞凋亡的机制包括一系列复杂的级联反应,有细胞内钙超载、炎症反应、自由基的形成、线粒体功能紊乱、兴奋性氨基酸的毒性作用、凋亡相关基因的表达等。ASA能够抑制大鼠局灶性脑IRI后内皮细胞和神经元内皮素(endothelin,ET)的表达,ET可通过引起中性粒细胞聚集、增加氧自由基产生、使兴奋性氨基酸释放增加等机制加重神经损伤、导致神经细胞凋亡[2]。在大脑中动脉IRI后,ASA能减少同侧皮质 Hsp27、NF-κB和TNF-α的表达而起到减轻神经炎症反应和减少细胞凋亡的作用[3]。ASA还可以通过减少谷氨酸和IL-6的释放发挥神经保护作用[4]。IRI后脑组织内静止型小胶质细胞被激活转化为活化型小胶质细胞,ASA对小胶质细胞激活有明显抑制作用,ASA还可能减缓以小胶质细胞为中心的炎症级联反应恶性循环,发挥神经保护作用[5]。除了神经组织以外,ASA对其他脏器和组织细胞的凋亡也有明显的抑制作用[6-8]。但是对于肿瘤细胞,有实验显示ASA却发挥了促进肿瘤细胞凋亡的作用[9]。其机制是ASA可通过激活JAKl/STATl信号通路,上调促凋亡基因XAFl的转录,XAFl再通过诱导Bax表达促进细胞色素C的表达,进而激活caspase-9和caspase-3通过内源性凋亡途径诱导肿瘤细胞凋亡。另外ASA还可以下调肿瘤细胞抗凋亡基因G1P3的转录。考虑细胞凋亡的过程涉及多种基因的调控、多种蛋白的表达,需要多种细胞通路的作用,而肿瘤的发生是多个基因突变累积的共同结果,所以使ASA与凋亡的关系也变得复杂和多样。本次实验结果显示,正常组、假手术组耳蜗罕见凋亡细胞;模型组Corti器、螺旋神经节在缺血再灌注各个时间点均有细胞凋亡,与正常组比较差异有统计学意义(P<0.05);干预组螺旋神经节和Corti器的凋亡细胞在IRI的每个时间点上都较模型组较少,差异有统计学意义,说明ASA对IRI的内耳有保护作用,这种保护作用是通过抑制细胞凋亡而实现的。
表1 各组豚鼠耳蜗各部位单视野凋亡细胞的个数(x±s,n=8)

表1 各组豚鼠耳蜗各部位单视野凋亡细胞的个数(x±s,n=8)
注:*:与正常组比较P<0.05;☆:与模型组同等时间点比较P<0.05。
组别 正常组 假手术组 模型组IRI6h IRI24h IRI48h ASA 预处理组IRI6h IRI24h IRI48h Corti器 0.10±0.17 0.12±0.13 3.59±0.52* 4.95±0.64* 4.10±0.36* 2.13±0.27*☆ 2.97±0.53*☆ 3.05.±0.14*☆螺旋神经节 0.12±0.08 0.13±0.14 3.81±0.31* 5.09±0.25* 4.86±0.63* 2.49±0.85*☆ 3.71±0.54*☆ 3.21±0.26*☆
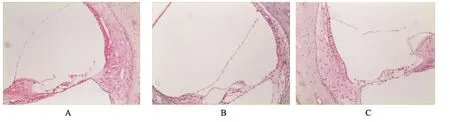
图1 耳蜗的形态(×100)
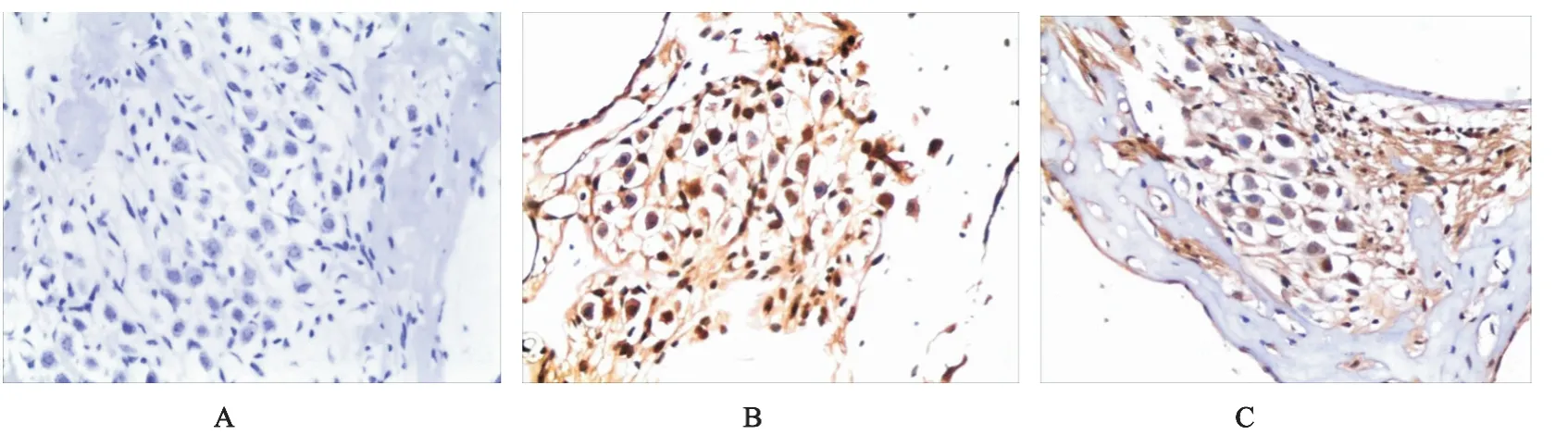
图2 凋亡的螺旋神经节细胞 (×200)
[1] 李泽东,马静萍.阿司匹林预处理对大鼠脑缺血再灌注后caspase-3和AIF表达的影响[J].中国神经免疫学和神经病学杂志,2009,16(4):281-284.
[2] 宋妮娜,高政,孙文芳,等.拜阿司匹灵预处理对高血糖SD大鼠局部脑缺血再灌注损伤中ET-1的表达[J].中国实用神经疾病杂志,2010,13(11):36-38.
[3] Whitehead SN,Bayona NA,Cheng G,eta1.Effects of triflusal and aspirin in a rat model of cerebral ischemia[J].Stroke,2007,38(2):381-387.
[4] Berger C,Stauder A,Xia F,etal.Neuroprotection and glutamate attenuation by acetylsalicylic acid in temporary but not in permanent cerebral ischemia[J].Exp Neurol,2008,210(2):543-548.
[5] 何凡,陈团芝,曲方,等.阿司匹林和脂多糖对大鼠局灶性脑缺血/再灌注后小胶质细胞激活的影响[J].中国临床神经科学,2013,21(3):252-258.
[6] 张勇,刘义.小剂量阿司匹林对糖尿病大鼠胰腺功能和凋亡相关蛋白的研究[J].中国医药指南,2013,13(11):414-417.
[7] 冯友权,孟尽海,白 洁.阿司匹林对大鼠肺缺血再灌注损伤的影响[J].宁夏医学杂志,2011,33(5):396-398.
[8] 张钛,刘义.小剂量阿司匹林对糖尿病大鼠主动脉凋亡相关蛋白的作用[J].辽宁医学院学报,2013,34(2):17-19.
[9] 李涛,乔筱玲,王敏,等.阿司匹林促进干扰素-α诱导肝癌凋亡的作用机制[J].中华肝胆外科杂志,2014,20(9):670-676.

