CCL3、CCL4下调表达和重症继发性肺结核病理损伤的关系
苏瑾文,刘艳华,杨秉芬,程小星(解放军309医院结核病研究所ICU,北京 0009;解放军309医院结核病研究室;通讯作者,E-mail:xc36cn@63.com)
重症肺结核[1]是指各型血型播散性肺结核及3个肺野以上的继发性肺结核。其中重症继发性肺结核病灶范围大,病理损害严重,肺结构的破坏使得呼吸功能受到严重影响,死亡率增加[2]。已有研究证实肺结核组织损伤是由迟发型超敏反应引发、Th2辅助T细胞介导的免疫反应[3]所致,但其免疫病理机制仍不十分明确,本研究前期用基因表达谱芯片[4]筛选重症继发性肺结核患者的差异基因,以期发现并研究重症继发性肺结核患者差异基因与肺结构严重损害的关系。芯片结果显示有大量表达下调基因,其中趋化因子CCL3、CCL4表现为表达下调,本研究进一步从多角度验证了CCL3、CCL4的表达下调,并对其表达下调与重症病例病变的关系做了初步探索。
1 资料与方法
1.1 入选标准
根据重症肺结核的定义,结合自己的研究目的确定入选标准。重症:病灶范围在三个肺野以上,病灶斑片状并伴有坏死、空洞、实变等病变。轻症:结核病灶范围在两个肺野以下,病灶点状或索条状,且无空洞形成者。对照:正常健康人。排除标准:①使用过激素者;②有合并症者;③合并结核性胸膜炎和肺外结核者;④病变范围两个肺野以下有空洞者及三个肺野以上无空洞、坏死、实变者。肺结核的诊断按照中华医学会《临床诊疗指南》(结核病分册)[5]。本研究得到解放军309医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 临床标本的采集
解放军309医院结核病研究所2012-04~2013-10确诊为继发性肺结核的患者90例,男性48例,女性42例,均无基础疾病;同期健康对照33例,来自解放军309医院体检中心健康查体者,男性17例,女性16例。其中5例重症、5例轻症、5例健康送检芯片。其余病例用于做RT-PCR和ELISA检测,每组20例。采集静脉抗凝血2 ml,于室温下放置,在采集后6 h内处理。
1.3 外周血单个核细胞的分离
Ficoll淋巴细胞分离液(美国GE公司)分离抗凝血。方法 :吸取2 ml平衡至室温的Ficoll到离心管中,再缓慢加入2 ml混匀的抗凝血,1 000×g离心20 min,吸取中间的白膜层,分别用10 ml 1640完全培养基(美国Gibco公司)、350×g 7 min和1 ml 1640完全培养基、300×g 5 min洗涤,弃去上清,沉淀即为外周血单个核细胞。
1.4 细胞总RNA的提取
Trizol法提取细胞总RNA。方法 :按1×106细胞/ml Trizol的比例加入Trizol(美国invitrogen公司),涡旋使其完全裂解,室温静置5 min;按0.2 ml氯仿/1 ml Trizol加入氯仿,涡旋30秒后室温静置5 min,4℃ 12 000×g离心15 min;取上层无色水相至新离心管中,按0.5 ml异丙醇/1 ml Trizol比例加入异丙醇,混匀后室温放置10 min,沉淀 RNA,4℃12 000×g离心10 min,弃上清;加入1 ml 75%的乙醇洗涤沉淀,4℃ 7 500×g离心5 min,弃上清,室温干燥10 min;加入100 μl DEPC水,-20℃保存。
1.5 cDNA 合成
采用TaKaRa PrimeScriptTMRT reagent kit[RR037A,宝生物工程(大连)有限公司]的逆转录试剂盒,按说明书操作,将RNA反转录成cDNA。反转录体系为:5 ×buffer 2 μl;Enzyme 0.5 μl;Oligo dT 0.5 μl;Random6 0.5 μl;Total RNA 5 μl;加 ddH2O 补充到10 μl。反应条件为:37 ℃,15 min;85 ℃,5 s。
1.6 实时荧光定量PCR(RT-PCR)
采用 KAPA SYBR FAST qPCR kit(KM4105,KapaBiosystems)荧光定量试剂盒测定外周血单个核细胞CCL3和CCL4 mRNA的表达,重症、轻症组各20例,健康对照8例。内参基因:GAPDH。引物和内参基因由上海生工生物公司合成。以cDNA为模板扩增基因,扩增反应体系为:SuperReal Premix(SYBR Green)10 μl;Forward Primer 0.4 μl;Reverse primer 0.4 μl;cDNA(template)2 μl;RNase ddH2O 7.2 μl,总量为 20 μl。设定反应条件:第一步 95 ℃3 min;第二步95℃ 3 s,60℃ 20 s,进行40个循环。
用2-Δct计算每个候选基因的相对表达量。当目标基因和参照基因有相同的扩增效率时,ΔCt目标基因=Ct目标基因-Ct内参基因。
1.7 ELISA法验证CCL3和CCL4
对CCL3、CCL4进一步用ELISA方法验证细胞蛋白表达量。重症、轻症组和健康对照各20例用EDTA或肝素抗凝的外周血标本2-4 ml,3 000 r/min、10 min离心吸取血浆。先用标准品倍比稀释后做标准曲线,然后在微孔板内每孔加样100 μl,37℃孵育2 h,再经洗板及先后加一抗、二抗、底物及终止反应等步骤,最后用酶标仪在450 nm处测定吸光值。
1.8 数据处理和统计学分析
Graphad prism5统计软件分析组间差异。用方差分析方法判断数据是否符合正态分布,组间比较用非参数检验判断重症、轻症继发性肺结核患者与对照组之间表达量的统计学差异,P<0.05为差异有统计学意义。
2 结果
2.1 病例临床资料
对45例重症和45例轻症患者的临床资料总结见表1。
从表1的临床资料中可看出,重症患者痰抗酸染色阳性、复治、耐药比例均高于轻症组,有吸烟、饮酒史的患者比例高于轻症组,病程在3年以上的比例高于轻症组,营养状况相对差,即白蛋白和血红蛋白低于轻症组。
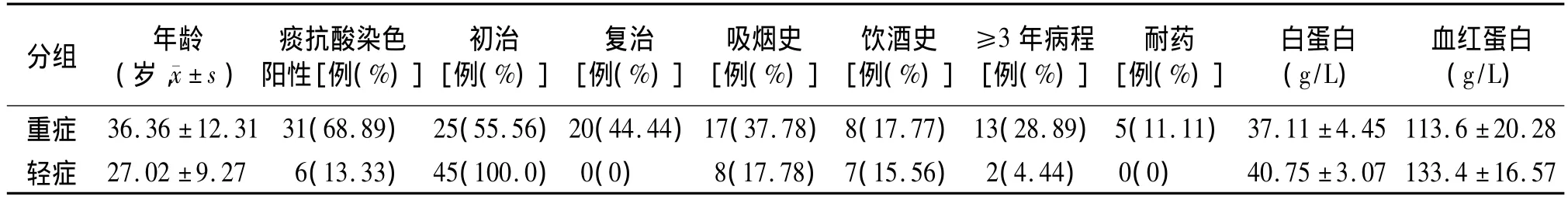
表1 45例重症与45例轻症肺结核患者的临床数据 (n=45)Table 1 Com parison of clinical data between 45 cases of severe TB and 45 cases of mild TB (n=45)
2.2 细胞总RNA质控
本实验以送检芯片标本为代表检测RNA纯度为A260nm/A280nm≥1.80;经甲醛变性胶电泳检测RNA完整性,9号RNA样品电泳条带清晰,28S∶18S rRNA条带亮度大于或接近1∶1,其余样品电泳条带清晰,28S∶18S rRNA条带亮度大于或接近2∶1;RNA总量≥1 μg,质量符合芯片实验要求(见图1)。
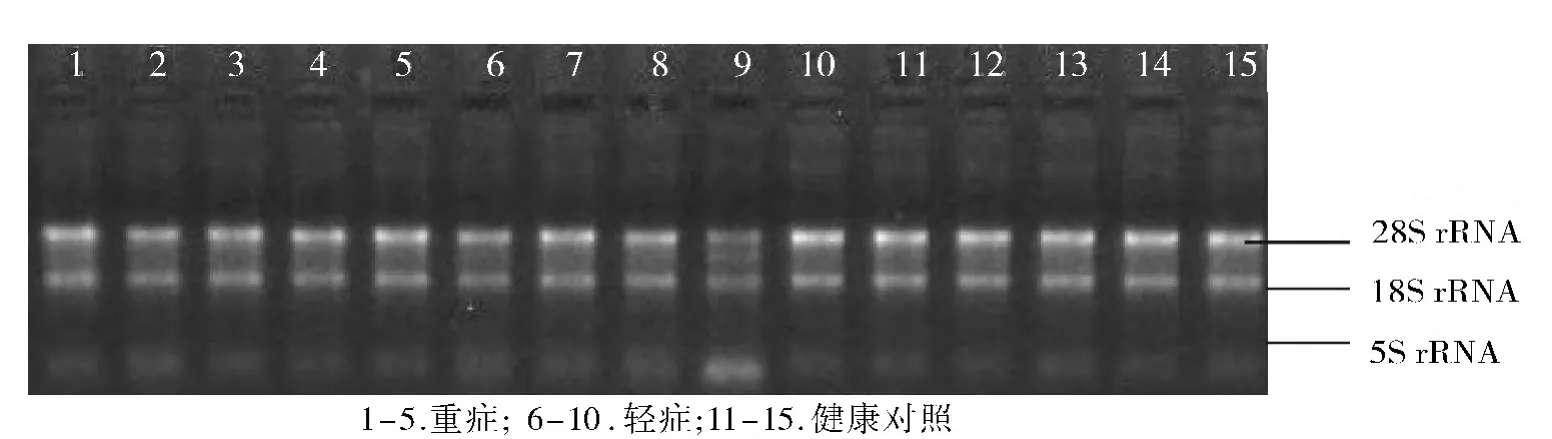
图1 细胞总RNA电泳图Figure 1 Electrophoresis of cellular total RNA
2.3 表达谱芯片检测结果
分组比较筛选出差异基因数目为:重症vs轻症406条,重症vs健康668条,轻症vs健康12条;其中下调基因数目在重症vs轻症264条,重症vs健康351条,轻症vs健康12条。从中可见差异表达基因以下调为主,有较多免疫相关基因表现为下调,其中CCL3 下调84.69%,CCL4 下调87.73%。
2.4 RT-PCR 验证 CCL3、CCL4表达
CCL3、CCL4的熔解曲线为单一峰,证实 PCR扩增特异性较好。从标准曲线获得的扩增效率为90%,因此相对表达量计算为1.90-Δct。对重症、轻症和健康对照组CCL3、CCL4的相对定量Ct值经计算后进行统计。由于数据为非正态分布数据,组间两两比较用非参数检验方法。统计结果显示,RTPCR验证重症与轻症、健康对照组比较CCL3、CCL4表达下调,差异有统计学意义(P<0.05,见表2),RT-PCR验证结果与芯片相符。
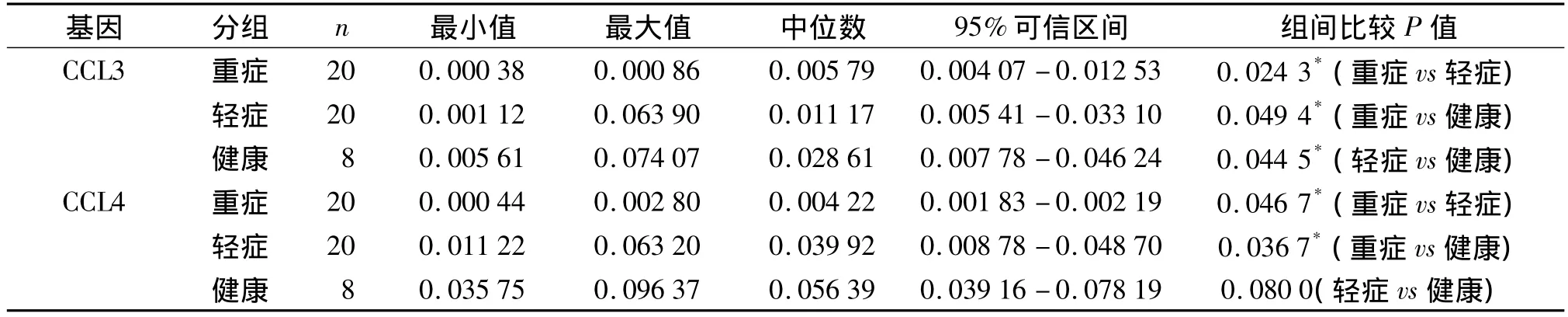
表2 重症、轻症组和健康对照组RT-PCR检测值的比较Table 2 Com parison of RT-PCR results between severe secondary TB,mild secondary TB patients and healthy controls
2.5 ELISA 验证 CCL3、CCL4的表达
对ELISA方法检测重症、轻症和健康对照组CCL3、CCL4的吸光值进行统计,因数据为非正态分布数据,组间两两比较用非参数检验方法。重症与轻症组比较、重症与健康组比较CCL3表达下调(P<0.05);重症与轻症组比较、重症与健康对照组比较CCL4表达下调(P<0.05)。结果 显示重症患者CCL3、CCL4血浆蛋白表达水平下调,与芯片结果相符(见表3)。
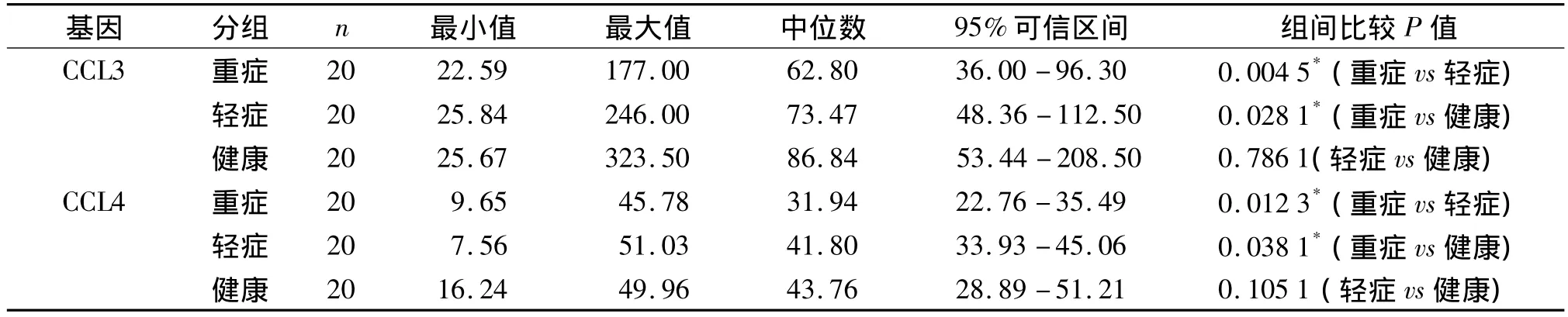
表3 重症、轻症组和健康对照组ELISA检测吸光值的比较Table 3 Com parison of ELISA results between severe secondary TB,mild secondary TB patients and healthy controls
3 讨论
继发性肺结核临床特征有别于原发结核和原发后结核,以肺内实质性病变为主,其病理过程可以有浸润、渗出、干酪、增殖、纤维化、钙化等,肺结构损害轻重程度差异很大,轻者病灶局限,而重者有空洞、干酪坏死、实变、毁损肺等病变使肺结构严重受损,成为肺部感染、呼吸功能障碍的基础。不同的预后被认为是结核菌和机体特异性免疫反应间复杂相互作用的结果。对病情与病变差异的原因和机制尚不十分明确,病变的加重与很多因素有关,如吸烟、酗酒、各种合并症(糖尿病、肝炎、器官移植、肾功能衰竭等)、治疗依从性、社会经济因素等,但可能最终影响的仍是免疫功能。病例的临床资料也提示重症与轻症相比吸烟、饮酒发生率高、病程长、痰菌阳性率高,营养状况差等可能都是导致病变加重的因素。还有研究证实与遗传素质有关[6],因此我们用基因表达谱芯片来筛选无基础疾病和合并症的重症继发性肺结核患者与轻症、健康人相比的差异基因,以期发现重症患者肺部病变严重与其他人群有不同的基因表达。结果 显示,重症组有大量差异基因,其中CCL3、CCL4等免疫相关基因表现为表达下调,差异基因表达的改变及其对信号通路的影响可能是导致重症继发性肺结核病变严重的分子基础。由于芯片实验也存在一定系统误差,对于筛选出的差异表达基因仍需进一步用分子生物学手段验证。本研究分别用实时荧光定量PCR和ELISA方法验证了CCL3、CCL4在重症、轻症患者及健康对照组的表达情况,验证结果与芯片相符,因此验证差异基因的方法和结果是可靠的。
CCL3和CCL4属于趋化因子CC配体[chemokine(C-C motif)ligand,CCL]家族,分别称为巨噬细胞炎症蛋白MIP-1α和MIP-1β。感染结核菌后可通过宿主细胞表面分子和结核菌细胞膜、细胞壁相互作用诱导巨噬细胞产生趋化因子[7]。研究发现肺结核患者的肺泡巨噬细胞、单核细胞THP-1细胞系、支气管肺泡灌洗液和胸腔积液中都有CCL3、CCL4等因子产生[8]。感染牛型结核分支杆菌的树突细胞CCL3、CCL4等趋化因子增高表达,并可诱导NK细胞亚群NKp46(+)CD2(-)向树突细胞迁移[9]。因此,我们认为 CCL3、CCL4的产生是抗结核免疫反应的体现,机体感染结核菌后应有一个升高的过程,从而参与早期固有免疫机制。印度人群的研究显示,CC趋化因子的基因多态性和肺结核易感性或抗结核能力相关,其中涉及CCL3、CCL4的基因多态性[10],可见,CCL3和CCL4在抗结核免疫中有重要的防御作用。但我们的验证实验显示轻症患者表达CCL3、CCL4与健康人相比无统计学意义,并没有明显升高表达现象,可能与研究的标本和方法不同有关。
研究证实CCL3和CCL4均参与了结核肉芽肿的形成[11]。而肉芽肿的形成被认为是抗结核细胞介导的免疫反应良好的表现,如果参与免疫的细胞反应失控将导致大量坏死和组织结构破坏,空洞形成[12]。参与肉芽肿形成的细胞如肺泡巨噬细胞、多核巨细胞和树突细胞等均可被结核菌诱导产生CCL3、CCL4。活化的 T细胞能被调节表达分泌CCL5、CCL3、CCL4等趋化因子,在募集淋巴细胞、Th1表达和肉芽肿形成中发挥了必不可少的作用[13]。因此,CCL3、CCL4通过趋化多种细胞在结核菌感染部位形成肉芽肿来发挥抗结核作用。本研究CCL3、CCL4在重症肺结核患者表达下调,提示其参与肉芽肿形成进而局限结核菌引起的炎症反应功能下降,使抗结核的免疫保护受到抑制,可能与病变加重、病灶扩大有关。重症患者CCL3、CCL4表达下调的原因机制尚不清楚。我们推测感染结核菌后CCL3、CCL4及其他趋化因子是升高表达的,但由于多种原因病情未得到控制和好转,使得病情加重后患者的免疫功能受到抑制,其表达反而下调。由于结核病是一种慢性消耗性疾病,病变持续存在和扩大导致机体过度消耗和营养不良等情况发生,直接影响了免疫功能。
综上所述,本研究通过芯片筛选重症继发性肺结核的差异表达基因,发现部分免疫相关基因下调,CCL3和CCL4通过RT-PCR和ELISA验证,结果显示与芯片相符。CCL3和CCL4能吸引炎性细胞并通过参与肉芽肿形成来发挥抗结核作用,但其表达下调可能使感染结核菌的炎症反应和病灶不能局限而成为促使病变加重的因素之一,其表达下调在免疫病理中的机制不清楚,尚待进一步研究。
[1]刘同伦.实用结核病学[M].沈阳:辽宁科学技术出版社,1987:284-289.
[2]Ryu YJ,Koh WJ,Kang EH,et al.Prognostic factors in pulmonary tuberculosis requiring mechanical ventilation for acute respiratory failure[J].Respirology,2007,12(3):406-411.
[3]Kobayashi K,Kaneda K,Kasama T.Immunopathogenesis of delayed-type hypersensitivity[J].Microsc Res Tech,2001,53(4):241-245.
[4]苏瑾文,刘艳华,杨秉芬,等.重症继发性肺结核患者基因表达谱的分析和验证[J].中华医学杂志,2014,94(42):3304-3309.
[5] 中华医学会.临床诊疗手册(结核病分册)[M].北京:人民卫生出版社社,2005:7.
[6]施雯慧,陈伟.结核病发病影响因素研究进展[J].中华流行病学杂志,2012,33(12):1296-1300.
[7]Collins HL,Kaufmann SH.The many faces of host responses to tuberculosis[J].J Immunol,2001,103(1):1-9.
[8]Zlotnik A,Yoshie O.Chemokines:a new classification system and their role in immunity[J].Immunity,2000,12(2):121-127.
[9]Siddiqui N,Hope J.Differential recruitment and activation of natural killer cell sub-populations by mycobacterium bovis-infected dendritic cells[J].Eur J Immunol,2013,43(1):159-169.
[10]Singh B,Chitra J,Selvaraj P.CCL2,CCL3 and CCL4 gene polymorphisms in pulmonary tuberculosis patients of South India[J].Int J Immunogenet,2014,41(2):98-104.
[11]Zhu XW,Friedland JS.Multinucleate giant cells and the control of chemokine secretion in response to Mycobacterium tuberculosis[J].Clin Immunol,2006,120(1):10-20.
[12]Brighen ti S,Andersson J.Local immune responses in human tuberculosis:learning from the site of infection[J].J Infect Dis,2012,205:S316-324.
[13]Gonzalez-Juarrero M,Hattle JM,Izzo A,et al.Disruption of granulocyte macrophage-colony stimulating factor production in the lungs severely affects the ability of mice to control Mycobacterium tuberculosis infection[J].J Leukoc Biol,2005,77(6):914-922.

