奥美沙坦抑制低渗液诱导的豚鼠心房肌细胞I Ks电流增加和动作电位时程缩短
高 洁,盛 婴,叶 莎,刘传镐,赵 进(西安交通大学第二附属医院干部二病区,西安 7000;西安交通大学第一附属医院干五病区;西安交通大学医学部药理学系;西安交通大学医学部机能教学中心;通讯作者,E-mail:shengying@mail.xjtu.edu.cn)
越来越多资料表明[1-4],肾素-血管紧张素系统(renin-angiotensin system,RAS)与实验性房性心律失常的发生有关。最新的临床研究也发现[5-10],RAS阻滞剂包括血管紧张素转换酶(ACE)抑制剂和1型血管紧张素Ⅱ受体(AT1R)阻滞剂能够有效治疗房颤。然而,此类药物治疗房颤的机制尚未完全阐明,特别是对房颤发生的心脏电生理特性影响更是知之甚少。
心肌细胞动作电位时程(APD)和有效不应期(ERP)的缩短通常被认为是以折返为基础的房颤发生的关键因素。房颤发生期间,心房收缩功能受损造成心房肌细胞肿胀或牵张[11,12],血管紧张素Ⅱ分泌增加[13,14]。Zankov 等[15]证实,外源性血管紧张素Ⅱ和低渗液诱导的豚鼠心肌细胞膜扩张可增加心肌细胞缓慢整流性外向钾电流 (slow delayed outward rectifying potassium channel,IKs)并使心房肌细胞APD缩短,此作用是通过激活心房肌细胞AT1受体来实现的。这表明AT1受体激活后引发的IKs电流增强和心房肌细胞APD缩短在房颤的发生及维持中起着重要作用[15,16]。Moreno 等报道,AT1受体阻滞剂厄贝沙坦(irbesartan)能够抑制异源表达的KCNQ1/KCNE1通道电流[17],此结果提示1型血管紧张素Ⅱ受体(AT1R)阻滞剂有可能是通过阻滞AT1受体来产生治疗房颤作用的。
本研究观察了选择性AT1R阻滞剂奥美沙坦(olmesartan)对低渗液(Hypo-S)诱导的豚鼠心房肌细胞IKs电流增强和APD缩短的影响。结果 表明,奥美沙坦对扩张豚鼠心房细胞膜诱导的电生理变化与阻断AT1受体有关,这可能就是AT1R阻滞剂治疗房颤的重要作用机制之一。
1 材料和方法
1.1 豚鼠心房肌细胞分离
成年Hartley豚鼠,体重(300±25)g,雌雄兼用。腹腔注射戊巴比妥钠40 mg/kg麻醉后,采用Langendorff灌流装置灌注豚鼠心脏,酶法分离单个心房肌细胞[16]。
1.2 溶液和药品
标准台氏液:即“等渗”细胞外液(Iso-S,平均渗透压 285 mOsm/kg)包括 140 mmol/L NaCl、5.4 mmol/L KCl、1.8 mmol/L CaCl2、0.5 mmol/L MgCl2、0.33 mmol/L NaH2PO4、5.5 mmol/L 葡萄糖和 5.0 mmol/L HEPES(用1 mol/L NaOH将pH调节至7.4)。“低渗”细胞外液(Hypo-S,平均渗透压 ~210 mOsm/kg):将标准台式液中NaCl浓度降至100 mmol/L 即可,余相同[17]。
奥美沙坦(Sigma-Aldrich公司,美国),先用二甲亚砜(DMSO,Sigma公司,美国)配制成7 mmol/L的母液,临用前再用标准台氏液或“低渗”细胞外液稀释成所需浓度。DMSO在灌流浴槽中的终浓度<0.1%(V/V),对 IKs电流无影响。
电极内液:70 mmol/L门冬氨酸钾、50 mmol/L KCl、10 mmol/L KH2PO4、1 mmol/L MgSO4、3 mmol/L Na2ATP(Sigma 公司,美国)、0.1 mmol/L Li2GTP(罗氏诊断有限公司,曼海姆,德国)、5 mmol/L EGTA和5 mmol/L HEPES(用1 mol/L KOH将pH调节至 7.2)。
1.3 电生理记录和数据分析
将分离好的心房肌细胞置于安装在倒置显微镜上的5 ml灌流浴槽中,(36±1)℃恒温下1-2 ml/min灌流细胞外液。观察药物作用时,将灌流液换成用标准台氏液或“低渗”液稀释成所需浓度药物。实验分别观察了1 μmol/L和7 μmol/L奥美沙坦对豚鼠心房肌细胞IKs影响。采用EPC-8膜片钳放大器(HEKA Electronics,Lambrecht,Germany)全细胞记录心房肌细胞电流或电压。采样频率2 kHz,数据信号经5 kHz的低通滤波器后,LIH-1600型数模转换器(HEKA)输入计算机,PATCHMASTER软件(HEKA)处理数据。硼硅玻璃电极充灌电极内液后电阻值2.5-4.0 MΩ。观察IKs电流时采用从钳制电位-50 mV去极化至不同的测定电位。通过设置钳制电位-50 mV使钠通道失活,分别将0.4 μmol/L尼索地平(nisoldipine,拜耳公司,德国)和 0.5 μmol/L多非利特(dofetilide,Sigma公司,美国)加入到细胞外液中阻断L型Ca2+通道(ICa,L)和快速整流性外向钾电流(rapidly delayed outward rectifying potassium channel,IKr)。
测定IKs电流时,先去极化至+30 mV(刺激波宽2 s,间隔10 s),以复极至-50 mV时的尾电流作为IKs电流幅度并据此测定电流时程。通过Boltzmann方程 IK,tail=1/[1+exp((Vh– Vm)/k)]拟合 IKs尾电流的电流-电压关系来测定IKs的电压依赖性激活关系,其中IK,tail是尾电流值,Vh是半效最大激活电位,Vm是测定电位,k是斜率。利用单指数方程拟合尾电流曲线来测定IKs通道的去活化时间常数。细胞膜电容(Cm)测定采用波宽20 ms、振幅±5 mV脉冲对细胞施加刺激,然后利用公式Cm=τCI0/ΔVm(1-Iss/I0)求出膜电容。其中τC是电容瞬态时间常数,I0是初始峰电流,Iss是稳态电流值,ΔVm为刺激电压幅度(5 mV)。钳制电流模式下,通过记录电极对心房细胞施加频率0.2 Hz、波宽2 ms的阈上刺激诱发动作电位(AP)。以复极90%的动作电位时间作为动作电位时程(APD90)。
1.4 统计学分析
2 结果
2.1 奥美沙坦不影响基础I Ks电流,但可减弱Hypo-S诱导的I Ks增强
图1A显示,将灌流液换成低渗液Hypo-S时,心房肌细胞IKs尾电流明显增加。其中第二次将灌流液换成 Hypo-S液之前,预先在浴槽中加入7 μmol/L奥美沙坦处理心房肌细胞。结果 表明,1 μmol/L和7 μmol/L奥美沙坦不影响豚鼠心房肌细胞的基础IKs电流(图1B中1和3分别为图1A中的时间点测得IKs电流曲线),Hypo-S明显增加IKs稳态及尾电流幅度(图1B所示电流曲线2和4)。

图1 奥美沙坦不影响豚鼠心房肌细胞的基础I Ks电流Figure 1 Olmesartan did not affect baseline I Ks in guinea-pig atrial myocytes
图2A和图2B分别显示灌流低渗液Hypo-S及Hypo-S+1 μmol/L奥美沙坦时,采用台阶刺激(钳制电位-50 mV,步幅10 mV)去极化至+50 mV时所获得的典型IKs电流曲线。图2C为灌流Hypo-S、Hypo-S+1 μmol/L 奥美沙坦和 Hypo-S+7 μmol/L奥美沙坦三种不同条件下IKs电流增加百分率。结果 表明,Hypo-S、Hypo-S+1 μmol/L 奥美沙坦和 Hypo-S+7 μmol/L奥美沙坦的IKs电流增加的百分率分别为(105.60 ± 10.25)%(n=22),(70.64 ±9.39)%(n=11,与 Hypo-S 比较,P <0.05)和(68.22 ±8.52)%(n=14,与 Hypo-S 比较,P <0.05)。方差分析结果表明,Hypo-S+奥美沙坦的IKs电流增加百分率明显低于单纯Hypo-S(图2C)。图2 D为灌流 Iso-S、Hypo-S和 Hypo-S+1 μmol/L奥美沙坦时IKs电流-电压关系曲线。利用Boltzmann方程对曲线进行拟合,求出Iso-S、Hypo-S及Hypo-S+1 μmol/L奥美沙坦三种不同条件下IKs通道的半效激活电压(Vh)分别为(9.06 ±1.28)mV(n=22)、(2.08 ±1.29)mV(n=13,与 Iso-S 比较,P < 0.01)及(2.10 ±1.40)mV(n=10,与 Iso-S 比较,P <0.01)。结果 显示,Hypo-S可使激活曲线明显向左偏移,即低渗使IKs通道更加容易开放,但奥美沙坦不能使之改变。
表1显示了1 μmol/L奥美沙坦在四种不同复极化电位下对IKs通道去活化时间常数的影响。Hypo-S明显减慢-60 mV到-30 mV电位之间的IKs电流去活化时间,而奥美沙坦对Hypo-S的作用并无明显影响(P >0.05)。
2.2 奥美沙坦减弱Hypo-S诱导的豚鼠心房肌细胞动作电位缩短
图3A-3C分别显示了Iso-S和Hypo-S(对照组,图 3A)、Iso-S 和 Hypo-S+1 μmol/L 奥美沙坦(图3B)、Iso-S 和 Hypo-S+7 μmol/L 奥美沙坦(图3C)三组豚鼠心房肌细胞动作电位。图3D条形图显示,Hypo-S使心房肌细胞APD90缩短了(20.22±1.28)%(n=15),而 Hypo-S+1 μmol/L 奥美沙坦和Hypo-S+7 μmol/L奥美沙坦则分别仅使APD90缩短(11.89±1.15)%(n=11,与对照组比较,P <0.01)、(11.56 ±1.23)%(n=12,与对照组比较,P<0.01)。以上结果说明1-7 μmol/L奥美沙坦可对抗Hypo-S引发的心房动作电位缩短。

图2 奥美沙坦减弱Hypo-S诱导豚鼠心房肌细胞I Ks电流增强Figure 2 Olmesartan attenuated the increase of I Ks induced by Hypo-S

表1 奥美沙坦在不同复极化电位下对I Ks通道去活化时间常数(τ)的影响 (ms)Table 1 Effect of olmesartan on the I Ks channel deactivation time constant(τ)in guinea-pig atrial myocytes perfused with hypotonic solution (ms)
3 讨论
心肌细胞电生理研究表明,房颤对离子通道最主要的影响是 ICa,L向内电流显著减少[11],导致心房收缩功能障碍,引发细胞膜牵张和外向IKs电流增加[16,18,19]。ICa,L和 IKs通道电流变化引起心房肌细胞APD缩短,心房生理性节律紊乱,进而促进心房发生电生理和组织结构重构,这些均是持久性房颤的形成基础[11,20]。Hypo-S引发的心房细胞扩张拟似房颤早期通常发生的心肌细胞膜牵张[11,21],以及所涉及到的各种离子通道转运变化,包括心房肌细胞IKs增强[16,20,22]。
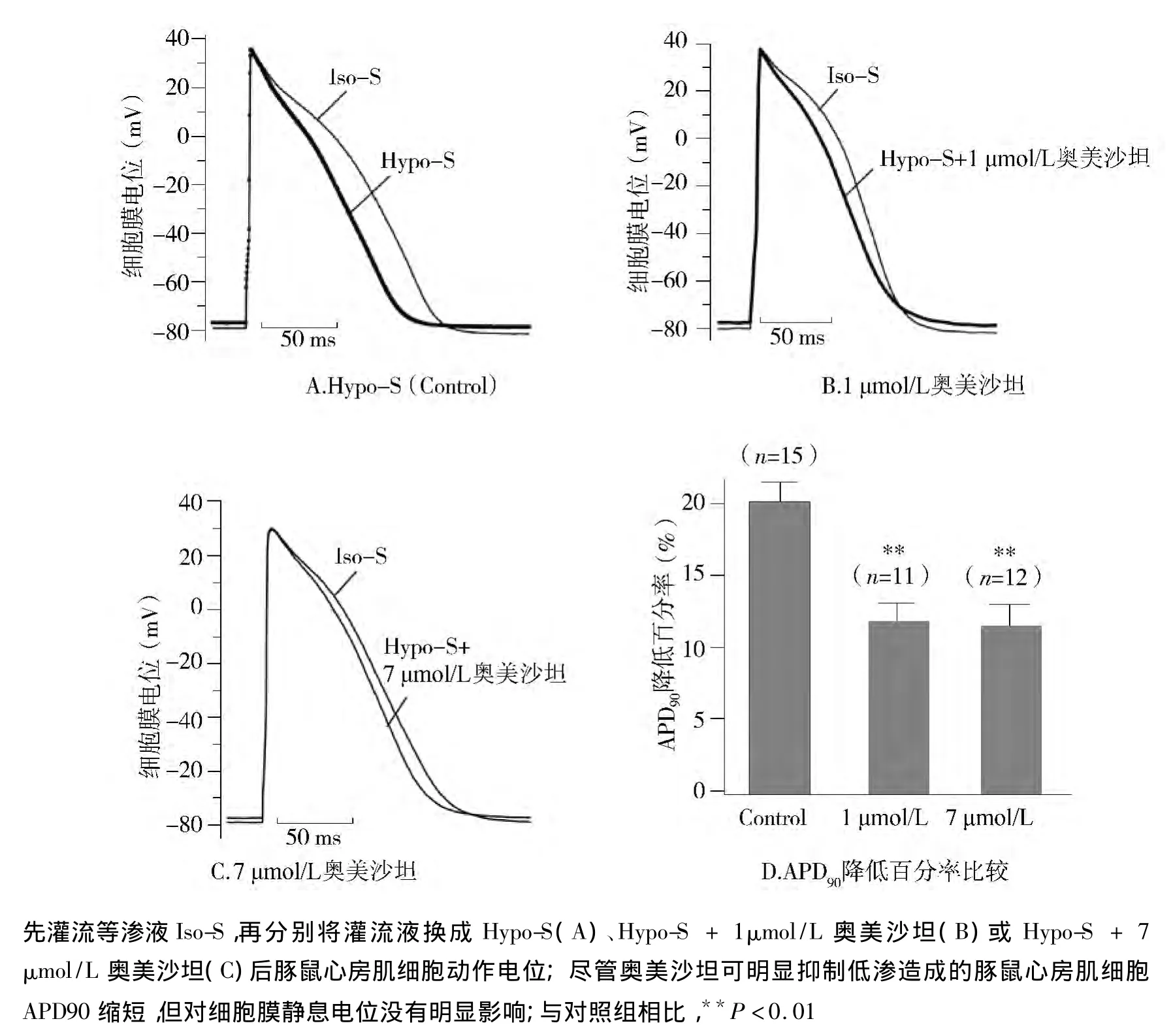
图3 奥美沙坦降低低渗液Hypo-S诱导的豚鼠心房肌细胞APD90缩短Figure 3 Olmesartan attenuated the shortening of APD90 induced by Hypo-S
本研究发现奥美沙坦可抑制牵张豚鼠心房肌细胞诱导的IKs增强,提示该药物具有改善房颤作用。近期临床研究发现[23,24],引发家族性房颤的 KCNQ1基因(编码IKs通道的α-亚基)变异S140G和R14C可使IKs电流增强,这些研究结果为我们的实验推测提供了临床支持。心房细胞膜牵张导致IKs电流增强,心房肌细胞APD缩短,继而引发房颤并使其得以长期维持[16,25-27]。奥美沙坦可抑制豚鼠心房肌细胞膜受牵张后引发的APD缩短。提示奥美沙坦治疗房颤的机制与其抑制心房肌细胞膜受牵张后引发的APD缩短有关。
RAS在房颤的发生和维持过程中起着极为关键的作用。房颤发生时心房牵张不仅激活AT1R[27,28],而且会引起心肌细胞分泌血管紧张素Ⅱ[13,14]。Madrid 等[29]报道,与单独使用胺碘酮相比,AT1受体阻滞剂厄贝沙坦与胺碘酮联用能够更有效地防止房颤的复发。虽然存在争议[30],但一系列近期临床报道[5-9]和动物实验均证实了AT1R阻滞剂对房颤的治疗作用[1,22]。在本实验中,奥美沙坦抑制牵张豚鼠心房肌细胞引发的IKs增加,但不影响基础IKs电流,表明该药所引起心肌细胞电生理变化与阻断AT1受体有关。这与Von Lewinski等研究结果相近[31],他们发现厄贝沙坦通过阻断人心房肌AT1受体可防治血管紧张素Ⅱ诱导的心律失常。有研究报道[15,16],选择性 AT1R 阻滞剂缬沙坦(valsartan)和坎地沙坦(candesartan)通过激活豚鼠心房肌细胞AT1受体分别抑制AngⅡ和牵张豚鼠心房肌细胞诱发的IKs增强和APD缩短。结合本实验对奥美沙坦的观察结果,我们认为,ARB类药物可改善心房扩张所产生的细胞电生理变化,其机制涉及对AT1受体的阻滞,有利于阻止房颤时发生的急性电生理重构。以往有关ARB类药物与房颤的关系研究,主要关注的是药物对心脏组织结构再建的影响[2,4,6],本实验研究表明在 ARB 类药物的作用下,心脏电生理再建也会发生。提示,ARB类药物治疗房颤的机制不但涉及心脏组织再建,对心脏电生理再建也具有重要影响。
本实验还观察到,Hypo-S可使豚鼠心房肌细胞膜静息电位上移。但与坎地沙坦一样[16],奥美沙坦并不影响心房牵张引起的细胞膜静息电位变化(见图3)。由于心房肌细胞膜静息电位的形成主要与内向整流电流 IK1关系密切[20],提示 IK1通道不是AT1受体阻滞剂治疗房颤的作用靶点[31]。
[1]Nagayama T,Hirooka Y,Kishi Y,et al.Blockade of brain angiotensinⅡtype I receptor inhibits the development of atrial fibrillation in hypertensive rats[J].Am J Hypertens,2015,28(4):444-451.
[2]Fujita M,Cheng XW,Inden Y,et al.Mechanisms with clinical implications for atrial fibrillation-adssociated remodeling:cathepsin K expression,regulation,and therapeutic target and biomarker[J].J Am Heart Assoc,2013,2(6):e000503.
[3]Ehrlich JR,Nattel S.Novel approaches for pharmacological management of atrial fibrillation[J].Drugs,2009,69(7):757-774.
[4]Spinarova L,Spinar J.Pharmacotherapy of dilated cardiomyopathy[J].Curr Pharm Des,2014,21(4):449-458.
[5]Madrid AH,Peng J,Zamora J,et al.The role of angiotensin receptor blockers and/or angiotensin converting enzyme inhibitors in the prevention of atrial fibrillation in patients with cardiovascular diseases:meta-analysis of randomized controlled clinical trials[J].Pacing Clin Electrophysiol,2004,27(10):1405-1410.
[6]Kiryu M,Niwano S,Niwano H,et al.Angiotensin II-mediated upregulation of connective tissue growth factor promotes atrial tissue fibrosis in the canine atrial fibrillation model[J].Europace,2012,14(8):1206-1214.
[7]Healey JS,Baranchuk A,Crystal E,et al.Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers:a meta-analysis[J].J Am Coll Cardiol,2005,45(11):1832-1839.
[8]Novo G,Guttilla D,Fazio G,et al.The role of the renin-angiotensin systemin atrial fibrillation and the therapeutic effects of ACEIs and ARBS[J].Br J Clin Pharmacol,2008,66(3):345-351.
[9]Schneider MP,Hua TA,Bohm M,et al.Prevention of atrial fibrillation by rennin-angiotensin systeminhibition a meta-analysis[J].J Am Coll Cardiol,2010,55(21):2299-2307.
[10]Goette A,Schon N,Kirchhof P,et al.Angiotensin II-antagonist in paroxysmal atrial fibrillation(ANTIPAF)trial[J].Circ Arrhythm Electrophysiol,2012,5(1):43-51.
[11]Allessie M,Ausma J,Schotten U.Electrical,contractile and structural remodelling during atrial fibrillation[J].Cardiovasc Res,2002,54(2):230-246.
[12]Nattel S.New ideas about atrial fibrillation 50 years on[J].Nature,2002,415(6868):219-226.
[13]Sadoshima J,Xu Y,Slayter HS,et al.Autocrine release of angiotensinⅡmediates stretch-induced hypertrophy of cardiac myocytes in vitro[J].Cell,1993,75(5):977-984.
[14]Gassanov N,Brandt MC,Michels G,et al.Angiotensin II-induced changes of calcium sparks and ionic currents in human atrial myocytes:potential role for early remodeling in atrial fibrillation[J].Cell Calcium,2006,39(2):175-186.
[15]Zankov DP,Omatsu-Kanbe M,Isono T,et al.Angiotensin II potentiates IKspotassium current via AT1receptors in guinea-pig atrial myocytes[J].Circulation,2006,113(10):1278-1286.
[16]Zankov DP,Toyoda F,Omatsu-Kanbe M,et al.Angiotensin II type 1 receptor mediates partially hyposmotic-induced increase of IKscurrent in guinea pig atrium[J].Pflugers Arch,2009,458(5):837-849.
[17]Moreno I,Caballero R,Gonzalez T,et al.Effects of irbesartan on cloned potassium channels involved in human cardiac repolarization[J].J Pharmacol Exp Ther,2003,304(2):862-873.
[18]Kocic I.Modulators of ion channels activated by hypotonic swelling in cardiomyocytes:new perspectives for pharmacological treatment of life-threatening arrhythmias[J].Curr Med Chem Cardiovasc Hematol Agents,2005,3(4):333-339.
[19]GISSI-AF Investigators,Disertori M,Latini R,et al.Valsartan for prevention of recurrent atrial fibrillation[J].N Engl J Med,2009,360(16):1606-1617.
[20]Schotten U,Verheule S,Kirchhof P,et al.Pathophysiological mechanisms of atrial fibrillation:a translational appraisal[J].Physiol Rev,2011,91(1):265-325.
[21]Sasaki N,Mitsuiye T,Wang Z,et al.Increase of the delayed rectifier K+and Na+-K+pump currents by hypotonic solutions in guinea pig cardiac myocytes[J].Circ Res,1994,75(5):887-895.
[22]Xue XD,Huang JH,Wang HS.Angiotensin II activates signal transducers and activators of transcription 3 via rac1 in the atrial tissue in permanent atrial fibrillation patients with rheumatic heart disease[J].Cell Biochem Biophys,2015,71(1):205-213.
[23]Otway R,Vandenberg JI,Guo G,et al.Stretch-sensitive KCNQ1 mutation:A link between genetic and environmental factors in the pathogenesis of atrial fibrillation[J].J Am Coll Cardiol,2007,49(5):578-586.
[24]Chen YH,Xu SJ,Bendahhou S,et al.KCNQ1 gain-of-function mutation in familial atrial fibrillation[J].Science,2003,299(5604):251-254.
[25]Vandenberg JI,Bett GCL,Powell T.Contribution of a swelling-activated chloride current to changes in the cardiac action potential[J].Am J Physiol,1997,273(2 Pt 1):C541-C547.
[26]Kocic I,Hirano Y,Hiraoka M.Ionic basis for membrane potential changes induced by hypoosmotic stress in guinea-pig ventricular myocytes[J].Cardiovasc Res,2001,51(1):59-70.
[27]Zou Y,Akazawa H,Qin Y,et al.Mechanical stress activates angiotensin II type 1 receptor without the involvement of angiotensinⅡ[J].Nat Cell Biol,2004,6(6):499-506.
[28]Yasuda N,Miura S,Akazawa H,et al.Conformational switch of angiotensinⅡtype 1 receptor underlying mechanical stress-induced activation[J].EMBO Rep,2008,9(2):179-186.
[29]Madrid AH,Bueno MG,Rebollo JM,et al.Use of irbesartan to maintain sinus rhythmin patients with long-lasting persistent atrial fibrillation:a prospective and randomized study[J].Circulation,2002,106(3):331-336.
[30]Von Lewinski D,Kockskamper J,Rubertus SU,et al.Direct proarrhythmogenic effects of angiotensinⅡcan be suppressed by AT1receptor blockade in human atrial myocardium[J].Eur J Heart Fail,2008,10(12):1172-176.
[31]Ehrlich JR.Inward rectifier potassium currents as a target for atrial fibrillation therapy[J].J Cardiovasc Pharmacol,2008,52(2):129-135.

