抑郁症大鼠脑组织、血清中PICK 1的表达及意义
王日德,卫兵艳(朔州市复退军人精神病院精神科,怀仁 038300;山西医科大学实验动物中心)
抑郁症是常见的心境障碍性疾病之一,主要表现为情绪、意志及思维活动的低落和退行性改变,随着社会竞争的日益激烈和人们生活节奏的改变,抑郁症的发病率逐年上升,但其发病机制至今尚不明确。PICK1全称为蛋白激酶Cα相互作用蛋白(protein interacting with Cα kinase 1),在哺乳动物各组织广泛表达,并以脑组织含量最高[1]。据报道,PICK1参与学习、记忆、神经递质传递、外周神经感觉等多种生理功能[2-4],与癫痫、帕金森综合征、精神分裂等神经精神疾病相关[5-7],最近的研究表明,PICK1可能在抑郁症的发病中发挥潜在作用[8]。本研究通过建立大鼠抑郁症模型,观察PICK1在抑郁症大鼠脑组织、血清中的表达水平,为抑郁症的机制研究提供新的思路。
1 材料与方法
1.1 实验动物分组
30只清洁级雄性Wistar大鼠由山西医科大学实验动物中心提供,体重(210±17)g,随机分为两组:抑郁症模型组(n=15)和正常对照组(n=15)。饲养环境:温度22℃,湿度95%,对照组大鼠12 h明暗交替,抑郁组大鼠按照刺激方法给予持续光照或黑暗。
1.2 大鼠抑郁症模型的建立及评价
[9]的方法,采用慢性温和不可预见性刺激(chronic unpredicted mild stress,CUMS)建立模型,主要刺激包括:禁水及禁食24 h、冷热水游泳5 min、猫叫声音30 min、持续光照及黑暗24 h、限制行为24 h、倾斜鼠笼24 h、摇床晃动30 min、夹尾悬吊5 min、电刺激足底1 min。每日一种刺激,顺序随机,使动物不能预料刺激的发生,每种刺激累计使用2-3次,刺激持续28 d。通过体重测量、畅箱实验、糖水消耗实验及Morris水迷宫实验进行行为学检测。体重测量:计算实验始末体重变化率,公式:体重变化率=(第28天体重-第1天体重)/第1天体重×100%。畅箱实验:单只大鼠置于整洁光亮的敞箱(体积:100 cm×100 cm×50 cm)中央,敞箱底面分为25个等边方格,记录大鼠5 min内水平运动、垂直运动得分;糖水消耗实验:剥夺饮水2.5 h后,每笼同时给予纯净水及1%蔗糖水各一份,计算1 h蔗糖水消耗量;Morris水迷宫实验:每天5个循环,记录大鼠在1 min内寻找水面下平台的时间,连续测试3 d,取3 d的测试成绩计为动物的空间记忆成绩。
1.3 酶联免疫吸附试验
最后一次行为测定后采集两组大鼠尾静脉血1 ml,室温静置10 min,离心(10 min,3 000r/min)取血清。ELISA法检测两组大鼠血清PICK1的表达水平,检测步骤严格按照试剂说明书(Mercodia,EIA-04500)进行。
1.4 蛋白印迹法
最后一次行为测定后,采用颈椎脱臼猝死法迅速处死大鼠,皮肤消毒后打开颅腔取脑组织。电子天平称取脑组织0.1 g,常规提取蛋白,分光光度计检测OD值,标准曲线法计算蛋白含量。采用蛋白印迹法(Western blot)检测脑组织PICK1蛋白的相对表达量:8%聚丙烯酰胺凝胶分离电泳,电泳电压100 V,时间50 min;冰水湿转膜法将蛋白转至硝酸纤维膜上,转膜电压100 V,时间30 min;蛋白封闭,滴加一抗(PROTEINTECH,PICK1浓度1∶800;Santa-cruz,GAPDH浓度1∶1 000)4℃过夜反应;洗膜,滴加二抗(北京中杉金桥,浓度1∶3 000)室温反应1 h;ECL发光液显色,凝胶成像系统曝光显色并进行灰度分析,目的蛋白PICK1的相对表达量取其与GAPDH的灰度值比值。
1.5 统计学方法
采用SPSS16.0软件进行统计学处理。计量数据以±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 抑郁症模型行为评价
与正常对照组大鼠相比,抑郁模型组大鼠体重增长、糖水偏好、水平运动、垂直运动明显降低(P<0.05),逃避潜伏期明显延长(P <0.05,见表1),说明抑郁模型建立成功。
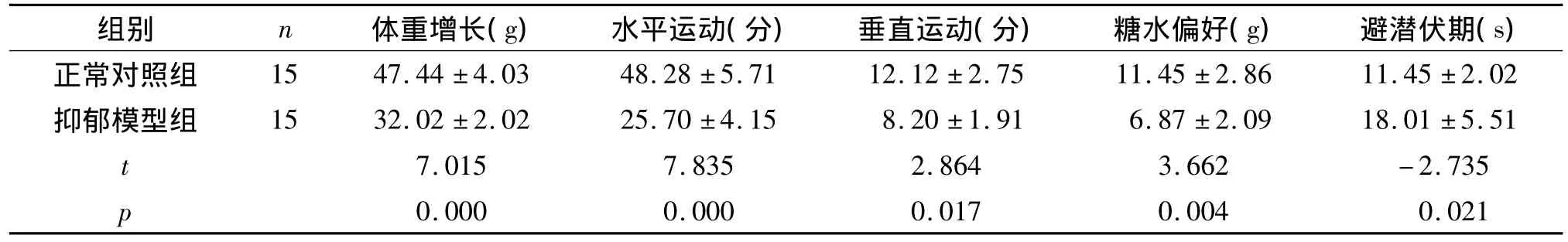
表1 CUMS对大鼠体重增长、敞箱实验运动、糖水偏好及逃避潜伏期的影响Table 1 The effect of CUMS on body weight,open field test,sucrose preference test and escape latency
2.2 两组大鼠外周血中PICK1的表达水平
ELISA结果显示,正常对照组大鼠外周血PICK1的表达量为(30.83 ±8.20)ng/L,抑郁模型组大鼠外周血PICK1的表达量为(34.84±5.57)ng/L,两组比较差异无统计学意义(t=-0.993,P=0.344 >0.05)。
2.3 两组大鼠脑组织中PICK1的表达水平
Western blot结果显示,正常对照组大鼠脑组织中PICK1的相对表达量为0.164±0.025,抑郁模型组大鼠脑组织中PICK1的相对表达量为0.706±0.080,明显高于正常对照组,差异有统计学意义(t=-14.435,P=0.000 <0.05,见图1)。
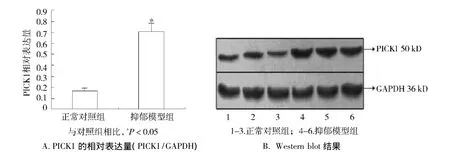
图1 两组大鼠脑组织中PICK1的表达水平Figure 1 The expression of PICK1 protein in brain tissues in two groups
3 讨论
PICK1是一种结构复杂、功能广泛的蛋白质,同时兼有PDZ、BAR及酸性氨基酸区三种特殊功能区,由于其结构的特殊性,PICK1发挥着多种生理功能,并且与多种疾病的病理过程相关。在帕金森综合征中,PICK1蛋白的单泛素化来介导使酸性敏感性离子通道蛋白2α通路活性增强,促进帕金森病中的神经退行性变[6]。PICK1相关位点等位基因的组成在精神分裂症患者和正常人之间有显著差异,说明PICK1很可能在精神分裂症的发病机制中发挥一定的作用[10]。此外,PICK1还与药物成瘾、疼痛以及癌症等疾病相关[11-13],而目前,PICK1在抑郁症中的研究报道较少。
本研究采用慢性温和不可预见性的应激方法建立抑郁症大鼠模型,经过不可预见的禁水、禁食、冷热水游泳、猫叫声音、持续光照及黑暗、限制行为、倾斜鼠笼、摇床晃动、夹尾悬吊、电刺激足底等刺激后,采用体重增长、糖水偏好、敞箱实验、Morris水迷宫实验来进行动物行为变化评价,研究结果显示:与正常对照组大鼠相比,28 d时抑郁模型组大鼠体重增长、糖水偏好、水平运动、垂直运动明显降低,逃避潜伏期明显延长,说明抑郁症大鼠模型建立成功。进一步,我们分析了两组大鼠脑组织中PICK1蛋白的表达情况,结果显示,抑郁症大鼠脑组织中PICK1蛋白的表达量较正常对照大鼠显著上调,提示PICK1可能参与了抑郁症发生发展的病理过程,并且这样的作用主要发生在中枢神经系统,就可能的机制而言,目前的报道表明 PICK1可与多巴胺、去甲肾上腺素以及5-羟色胺等单胺转运蛋白相结合,这种功能紊乱可导致神经递质传递异常,从而引起中枢退行改变[14]。另外,大脑的酸性敏感性离子通道蛋白属于哺乳动物退化蛋白及上皮Na+通道蛋白家族,PICK1中的PDZ结构域可同酸性敏感性离子通道蛋白相互作用,在酸性物质引起的伤害感受中起作用[15]。通过ELISA分析不同组别外周血发现,虽然抑郁症大鼠血清PICK1的浓度较正常对照大鼠有所升高,但差异并不明显,我们认为这可能与PICK1在体内分布情况有关,由于PICK1在脑组织中的含量最高,在其他组织中的含量较低,因此在脑组织中的变化最为明显。
综上所述,PICK1作为一种功能多样的蛋白质,在抑郁症动物模型脑组织中表达异常,可能参与了抑郁症发生发展的病理过程,而究竟PICK1的表达异常与抑郁症的发生何为因果,尚待功能研究进一步证实。
参考文献:
[1]Staudinger J,Zhou J,Burgess R,et al.PICK1:a perinuclear binding protein and substrate for protein kinase C isolated by the yeast two-hybrid system[J].J Cell Biol,1995,128(3):263-271.
[2]Hanley JG,Henley JM.PICK1 is a calcium-sensor for NMDA-induced AMPA receptor trafficking[J].EMBO J,2005,24(18):3266-3278.
[3]Baron A,Deval E,Salinas M,et al.Protein kinase C stimulates the acid sensing ion channel ASIC2a via the PDZ domain containing protein PICK1[J].J Biol Chem,2002,277(52):50463-50468.
[4]Xu F,Gainetdinov RR,Wetsel WC,et al.Mice lacking the norepinephrine transporter are supersensitive to psychostimulants[J].Nat Neurosci,2000,3(5):465-471.
[5]Bettaso F,Zhang C,Scheschonka A,et al.PICKl uncoupling from mGluR7a causes absence-like seizures[J].Nat Neurosci,2008,11:940-948.
[6]Joch M,Ase AR,Chen CX,et al.Parkin-mediated monoubiquitination of the PDZ protein PICK1 regulates the activity of acid-sensing ion channels[J].Mol Biol Cell,2007,18(8):3105-3118
[7]Ma TM,Abazyan S,Abazyan B,et al.Pathogenic disruption of DISC1-serine racemase binding elicits schizophrenia-like behavior via D-serine depletion[J].Mol Psychiatry,2013,18(5):557-567.
[8]Anggono V,Koç-SchmitzY,Widagdo J,et al.PICK1 interacts with PACSIN to regulate AMPA receptor internalization and cerebellar long-termdepression[J].Proc Natl Acad Sci,2013,110(34):13976-13981.
[9]王海涛,刘昊,徐爱军,等.抑郁症大鼠杏仁核微管相关蛋白表达及神经元凋亡[J].解剖学报,2013,44(1):30-33.
[10]Hong CJ,Liao DL,Shih HL,et al.Association study of PICK1 rs3952 polymorphism and schizophrenia[J].Neuroreport,2004,15(12):1965-1967.
[11]Ghasemzadeh MB,Mueller C,Vasudevan P.Behavioral sensitization to cocaine is associated with increased glutamate receptor trafficking to the postsynaptic density after extended withdrawal period[J].Neuroscience,2009,159(1):414-426.
[12]Garry EM,Moss A,Rosie R,et al.Specific involvement in neuropathic pain of AMPA receptors and adapter proteins for the GluR2 subunit[J].Mol Cell Neurosci,2003,24:10-22.
[13]Zhang B,Cao WF,Zhang F,et al.Protein interacting with Cαkinease 1(PICK1)is involved in promoting tumor growth and correlates with poor prognosis of human breast cancer[J].Cancer Sci,2010,101:1536-1542.
[14]Torres GE,Yao WD,Mohn AR,et al.Functional interaction between monoamine plasma membrane transporters and the synaptic PDZ domain-containing protein PICK1[J].Neuron,2001,30:121-134.
[15]Hruska-Hageman AM,Wemmie JA,Price MP,et al.Interaction of the synaptic protein PICK1(protein interacting with C kinase 1)with the non-voltage gated sodium channels BNC1(brain Na+channel 1)and ASIC(acid-sensing ion channel)[J].Biochem J,2002,361(Pt3):443-450.

