口腔癌相关成纤维细胞对人淋巴管内皮细胞增殖、迁移、侵袭、成管的影响
陈思源 高攀 常征 宣鸣
1.四川大学华西医院西藏驻成都办事处分院口腔科;2.口腔疾病研究国家重点实验室 华西口腔医院头颈肿瘤外科(四川大学),成都 610041
淋巴转移是恶性肿瘤的最致命性因素之一[1]。肿瘤的淋巴管增生,为肿瘤细胞转移至区域性淋巴结提供了通道[2]。过去的研究[3-5]主要集中在肿瘤诱导淋巴管生成,而癌周的间质细胞是否促进癌周淋巴管生成尚不清楚。本实验旨在研究口腔癌间质细胞之一的癌相关成纤维细胞(cancer-associated fibroblasts,CAFs)及其可能分泌的多种生长因子在淋巴管生成过程中的作用,为肿瘤淋巴管生成及转移的分子机制研究奠定基础。
1 材料和方法
1.1 主要试剂和仪器
高糖DMEM培养基(Hyclone公司,美国),1%打孔液(Amresco公司,美国),3%双氧水(成都市科龙化工试剂厂),4%多聚甲醛(武汉博士德生物工程有限公司)、小鼠抗人平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)单克隆抗体、小鼠抗人广谱细胞角蛋白(cell keratin,CK)单克隆抗体、兔抗人波形蛋白(vimentin)单克隆抗体、SP免疫组织化学检测试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司),人淋巴管内皮细胞(human lymphatic endothelial cells,HLEC)、内皮细胞培养基(endothelial cell medium,ECM)、牛血浆纤维粘连蛋白(bovine plasma fibronectin,BPF)(Sciencell公司,美国),基质胶(ECM gel)、胶原蛋白Ⅰ型(Sigma公司,美国)、8 μm/0.4 μm孔径transwell小室(Corning公司,美国)。
二氧化碳恒温培养箱(Queue公司,美国)、超净工作台(Sanyo公司,日本)、倒置相差显微镜、Olympus显微摄像仪(Olympus公司,日本)。
1.2 方法
1.2.1 分离和培养人CAFs和正常成纤维细胞(normal fibroblasts,NFs) 标本的取得遵守世界医学会(World Medical Association,WMA)《赫尔辛基宣言》所阐述的原则,经四川大学华西口腔医学院伦理委员会批准,并获得患者及其监护人知情同意。标本取自就诊于四川大学华西口腔医院头颈肿瘤外科,临床和病理诊断为口腔鳞状细胞癌且术前未进行放化疗的患者。取患者手术后切除的鳞癌组织及癌旁组织(>2 cm),标本新鲜、完整,包括上皮及其邻近的结缔组织。用PBS和抗生素清洗标本,修剪掉上皮和脂肪组织,将剩余结缔组织剪成1 mm×1 mm×1 mm的小块,放入含有高糖DMEM培养基的培养瓶中,培养基中含有20%胎牛血清、2 mmol·L-1L-谷氨酰胺、100 U·mL-1青霉素、100 μg·mL-1链霉素。37 ℃、5%CO2、饱和湿度条件下培养,每2~3 d换液1次。待细胞铺满瓶底后,用棉签刮除成团生长的上皮细胞[6]。0.25%胰蛋白酶消化,用吸管反复轻轻吹打成纤维细胞生长的区域,制备细胞悬液,计数后进行扩大培养。
1.2.2 免疫组织化学染色鉴定CAFs和NFs 将第3代的CAFs和NFs接种于加入盖玻片的六孔板中培养,待细胞铺满60%时进行免疫组织化学染色。4%多聚甲醛固定15 min,打孔液处理20 min,3%双氧水避光孵育10 min以切断内源性过氧化物酶,滴加SP的试剂A,室温孵育10~15 min,分别滴加一抗,以PBS代替一抗作阴性对照,置于湿盒中4 ℃过夜。滴加SP试剂B,37 ℃孵育10~15 min,滴加SP试剂C,37 ℃孵育10~15 min。滴加新鲜配制的DAB溶液(50~100 μL),光镜下观察,于反应部位产生棕色沉淀且无明显背景时终止显色。
1.2.3 共培养对HLEC增殖能力的影响 用含5%FBS的ECM复苏HLEC,接种于BPF包被的培养瓶中并扩大培养。0.25%胰酶消化HLEC后,用含5%FBS的ECM制成细胞混悬液,调整细胞密度为1×105个·mL-1,接种于24孔孔径为0.4 μm的transwell小室的下室。用无血清的DMEM培养基将CAFs和NFs的密度调整为每孔1×105个,分别接种于实验A组(HLEC+CAFs)、实验B组(HLEC+NFs)的transwell小室的上室,空白对照组中只加入DMEM高糖培养基。间隔48 h在倒置相差显微镜下(×100)观察HLEC,随机观察6个不重叠的高倍视野,直至192 h为止。
1.2.4 共培养对HLEC迁移能力的影响 0.25%胰酶消化HLEC后,用含有5%FBS的ECM制成细胞混悬液,调整细胞密度为1×105个·mL-1,接种于24孔孔径为8 μm trenswell小室的上室。用无血清的DMEM培养基将CAFs和NFs的密度调整为每孔1×105个,分别接种于实验A组、实验B组的transwell小室的下室,空白对照组中只加入DMEM高糖培养基。培养96 h后用4%多聚甲醛固定滤膜上下表面附着的细胞20 min,用棉签擦去滤膜上表面的细胞后PBS冲洗3次。在倒置相差显微镜下(×100)计数已迁移至滤膜下面的细胞,每个滤膜随机观察6个不重叠的高倍视野。
1.2.5 共培养对HLEC侵袭能力的影响 0.25%胰酶消化HLEC后,制成细胞混悬液,调整细胞密度为1×105个·mL-1,接种于已铺好基质胶的24孔孔径为8 μm trenswell小室的上室。其余步骤同迁移能力实验。
1.2.6 共培养对HLEC成管能力的影响 将基质胶铺在24孔孔径为0.4 μm transwell小室的下室,纤连蛋白包被在基质胶上,置于37 ℃、5%CO2的孵箱中1 h。0.25%胰酶消化HLEC后,用含有5%FBS的ECM制成细胞混悬液,调整细胞密度为1×105个·mL-1,接种于transwell小室的下室。待细胞相互融合后,加入0.5 mLⅠ型胶原蛋白。用无血清的DMEM培养基将CAFs和NFs的密度调整为每孔1×105个,分别接种于实验A组、实验B组的transwell小室的上室,空白对照组中只加入DMEM高糖培养基。培养24 h后在倒置相差显微镜下(×100),随机观察6个不重叠的高倍视野,计数成管数目。
1.3 统计学处理
采用GraphPad Prism 5软件对数据进行统计分析。计量资料统计结果以均数±标准差表示,实验多组样本均数之间的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CAFs和NFs的分离和纯化
原代细胞培养纯化第3代细胞的镜下表现见图1。CAFs呈长梭形,胞质突少,细胞大小不一,生长密集,排列无方向性、较杂乱,可见重叠生长、接触抑制和密度抑制丧失等现象。NFs呈多胞质突的扁平星状,细胞大小基本一致,排列有一定方向性,铺满瓶底后可呈栅栏状或放射状外观,无重叠生长,存在接触抑制及密度抑制现象。

图1 组织块法培养的第3代CAFs和NFs 倒置相差显微镜 × 100Fig 1 The third generation of CAFs and NFs by method of tissue block inverted phase contrast microscope × 100
2.2 CAFs和NFs的鉴定
免疫组织化学染色可见,CAFs中CK阴性表达,波形蛋白和α-SMA阳性表达,胞质呈棕黄色着色(图2)。NFs中α-SMA和CK阴性表达,波形蛋白阳性表达,胞质呈棕黄色着色(图3)。
2.3 CAFs、NFs与HLEC共培养促进HLEC的增殖
由HLEC的增殖曲线(图4)可见,随着时间推移各组HLEC数目均增加。统计分析表明,培养48 h,各组HLEC数目增加的差异无统计学意义(P>0.05);培养96、144、192 h,实验A组HLEC的数目均多于B组和空白对照组,实验B组HLEC的数目多于空白对照组(P<0.01)。CAFs、NFs与HLEC共培养促进了HLEC的增殖,且CAFs的促进作用大于NFs。

图2 CAFs波形蛋白和α-SMA阳性表达 免疫组织化学 × 100Fig 2 Positive expression of CAFs by vimentin and α-SMA immunohistochemistry × 100
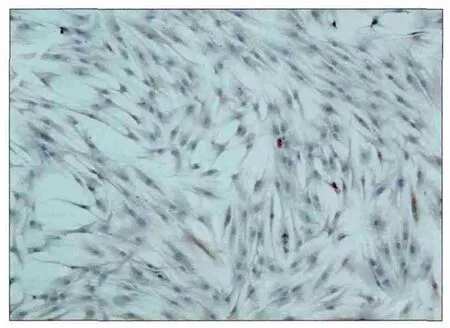
图3 NFs波形蛋白染色阳性 免疫组织化学 × 100Fig 3 Positive expression of NFs by vimentin immunohistochemistry × 100
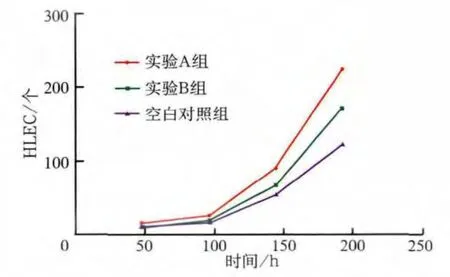
图4 不同共培养体系中HLEC的增殖曲线Fig 4 HLEC proliferation curve in different co-culturing systems
2.4 CAFs、NFs与HLEC共培养促进HLEC的迁移
各组HLEC的迁移情况见图5。实验A、B组和空白对照组HLEC迁移至膜下表面每高倍视野下的细胞数分别是(71.0±4.60)、(46.00±5.40)、(26.17±6.08)个,统计分析表明,3组之间的差异均有统计学意义(P<0.01),实验A组HLEC的迁移数目多于B组和空白对照组,实验B组HLEC的迁移数目多于空白对照组。CAFs和NFs增加了HLEC的迁移能力,且HLEC对CAFs的趋化效应强于NFs。
2.5 CAFs、NFs与HLEC共培养促进HLEC的侵袭
各组HLEC的侵袭情况见图6。实验A、B组和空白对照组HLEC侵袭至膜下表面每高倍视野下的细胞数分别是(65.0±4.00)、(40.5±3.27)、(18.8±3.87)个,统计分析表明,3组之间的差异均有统计学意义(P<0.01),实验A组HLEC的侵袭数目多于B组和空白对照组,实验B组HLEC的侵袭数目多于空白对照组。CAFs和NFs增加了HLEC的侵袭能力,且CAFs对HLEC的侵袭能力强于NFs。
2.6 CAFs、NFs与HLEC共培养促进HLEC的成管
实验组HLEC的成管情况见图7。实验A、B组和空白对照组的HLEC成管数分别为(25.5±4.81)、(15.7±2.58)、(10.7±2.16)个,统计分析表明,3组之间的差异均有统计学意义(P<0.01),实验A组HLEC的成管数目多于B组和空白对照组,实验B组HLEC的成管数目多于空白对照组。CAFs和NFs增加了HLEC的成管能力,且CAFs对HLEC的成管能力强于NFs。
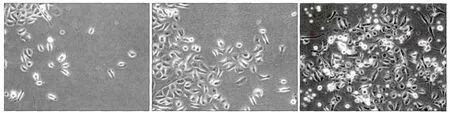
图5 各组HLEC的迁移 倒置相差显微镜 × 100Fig 5 The migration of HLEC in each group inverted phase contrast microscope × 100
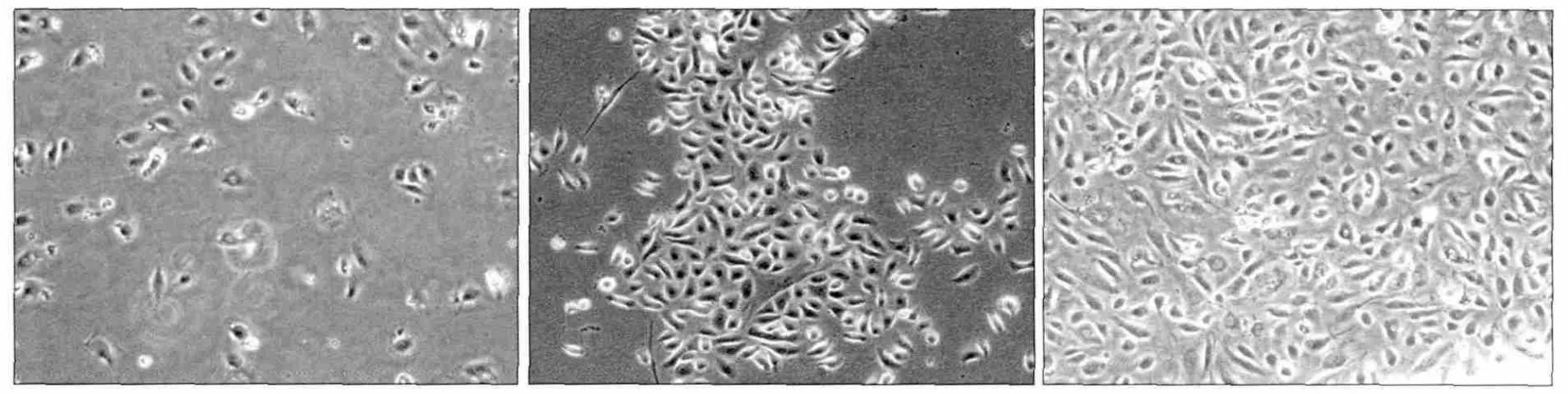
图6 各组HLEC的侵袭 倒置相差显微镜 × 100Fig 6 The invasion of HLEC in each group inverted phase contrast microscope × 100
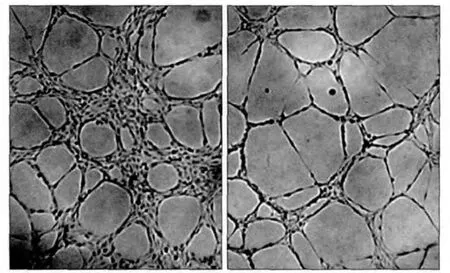
图7 实验组HLEC的成管 倒置相差显微镜 × 100Fig 7 The tube formation of HLEC in experimental group inverted phase contrast microscope × 100
3 讨论
在肿瘤生长的过程中,肿瘤淋巴管生成是淋巴转移的预先步骤。近年来,研究方向由肿瘤细胞本身分泌的多种生长因子在肿瘤中的表达与肿瘤的淋巴管密度和淋巴结转移中出现的显著相关性逐渐转向肿瘤基质的作用上。目前尚无关于肿瘤间质细胞分泌的生长因子对于口腔鳞癌淋巴管生成和淋巴转移促进作用的直接研究。本研究最终选取CAFs作为研究对象是由于以下几个原因。首先,CAFs是肿瘤基质中最主要的调节细胞,肿瘤基质内的成纤维细胞与创伤修复中的成纤维细胞一样,其表型发生了改变[6],这种“活化”的成纤维细胞也称作肿瘤周围成纤维细胞、肿瘤相关成纤维细胞[7];其次,原代成纤维细胞的培养技术已趋于成熟[8-10];最后,CAFs作为肿瘤基质中最主要的宿主细胞之一,通过直接的细胞-细胞接触、可溶性因子的分泌和细胞外基质修饰对该体系的平衡起着重要的调控作用[11-12]。
本实验成功地分离培养了口腔癌CAFs和NFs,通过形态学观察及对某些蛋白表达的检测初步鉴定了CAFs和NFs;采用transwell小室模型进一步将CAFs、NFs与HLEC共培养,证实了CAFs与NFs均能促进HLEC的增殖、迁移、侵袭和成管,并且CAFs的作用明显大于NFs(P<0.05)。这说明CAFs与NFs中都可能有促进淋巴管生长的生长因子的表达,且前者的表达量大于后者。由此可见,肿瘤基质中的CAFs所分泌的某种或某些生长因子在淋巴管生成过程中起重要作用[13]。在今后的研究中,将继续检测相关表达上调的基因,对于CAFs可能分泌的生长因子进行定性、定量分析,研究相关的生长因子对于HLEC相关蛋白表达的影响,以及在信号通路水平研究口腔癌相关成纤维细胞对口腔鳞癌淋巴管生成及转移作用的分子机制,为寻找治疗口腔癌淋巴转移的新靶点奠定基础。
[1]Achen MG, Stacker SA. Tumor lymphangiogenesis and metastatic spread-new players begin to emerge[J]. Int J Cancer,2006, 119(8):1755-1760.
[2]Nagahashi M, Ramachandran S, Rashid OM, et al. Lymphangiogenesis: a new player in cancer progression[J]. World J Gastroenterol, 2010, 16(32):4003-4012.
[3]Tobler NE, Detmar M. Tumor and lymph node lymphangiogenesis—impact on cancer metastasis[J]. J Leukoc Biol, 2006,80(4):691-696.
[4]Liersch R, Biermann C, Mesters RM, et al. Lymphangiogenesis in cancer: current perspectives[J]. Recent Results Cancer Res, 2010, 180:115-135.
[5]Sleeman JP, Thiele W. Tumor metastasis and the lymphatic vasculature[J]. Int J Cancer, 2009, 125(12):2747-2756.
[6]Witowski J, Jörres A. Peritoneal cell culture: fibroblasts[J].Perit Dial Int, 2006, 26(3):292-299.
[7]Chang HY, Chi JT, Dudoit S, et al. Diversity, topographic differentiation, and positional memory in human fibroblasts[J]. Proc Natl Acad Sci USA, 2002, 99(20):12877-12882.
[8]周红梅, 刘英, 胡涛, 等. 口腔癌相关成纤维细胞的分离培养及初步鉴定[J]. 中华口腔医学杂志, 2004, 39(2):122-125.
[9]Kunz-Schughart LA, Heyder P, Schroeder J, et al. A heterologous 3-D coculture model of breast tumor cells and fibroblasts to study tumor-associated fibroblast differentiation[J].Exp Cell Res, 2001, 266(1):74-86.
[10]Wang CS, Têtu B. Stromelysin-3 expression by mammary tumor-associated fibroblasts underin vitrobreast cancer cell induction[J]. Int J Cancer, 2002, 99(6):792-799.
[11]Okazaki H, Tokumaru S, Hanakawa Y, et al. Nuclear translocation of phosphorylated STAT3 regulates VEGF-A-induced lymphatic endothelial cell migration and tube formation[J].Biochem Biophys Res Commun, 2011, 412(3):441-445.
[12]Parkin DM. Global cancer statistics in the year 2000[J]. Lancet Oncol, 2001, 2(9):533-543.
[13]Nathanson SD. Insights into the mechanisms of lymph node metastasis[J]. Cancer, 2003, 98(2):413-423.

