全长型脾酪氨酸激酶在口腔鳞状细胞癌组织中的表达及其与肿瘤侵袭和转移的关系
王钊 陈洁 储伟明 达明杰 马露 吴敏 钟旖 王子露 宋晓萌 吴煜农
1.南京医科大学口腔疾病研究江苏省重点实验室;2.南京医科大学附属口腔医院口腔颌面外科;3.口腔病理科,南京 210029
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)作为一种口腔颌面部高发的,淋巴结转移早且以淋巴转移为主要转移途径的恶性肿瘤,在全球范围内其发病率排第6位,每年新增约60万病例。近30年来,OSCC的5年生存率无明显改善,维持在60%[1-2]。为了改善OSCC的预后,很多抑癌基因随之发现,并用于临床,取得了较好的临床效果。脾酪氨酸激酶(spleen tyrosine kinase,SYK)作为一种候选抑癌基因,在多种恶性肿瘤的病理过程中起着极为重要的作用[3-4]。SYK基因在转录过程中会选择性拼接,产生两种蛋白异构体[5],即全长型SYK[SYK(L)]和短缩型SYK[SYK(S)]。近年来,有研究[6-7]发现SYK(L)在乳腺癌、肝癌中发挥着抑癌基因的功能,但迄今尚未见其在OSCC组织中表达的相关报道。
本实验运用实时荧光定量聚合酶链反应(realtime quantitative polymerase chain reaction,RT-qPCR)、免疫印迹(Western blot)、免疫组织化学法检测SYK(L)在OSCC组织中的表达,初步探讨其与OSCC发生以及转移的关系,为进一步研究SYK(L)在OSCC中的作用提供理论基础。
1 材料和方法
1.1 组织标本
选取江苏省口腔医院口腔颌面外科2012—2013年期间OSCC患者27例,其中13例为单纯OSCC患者,无颈部淋巴结转移;14例为OSCC患者伴一侧或双侧颈淋巴结转移,每例患者收集其癌组织和癌旁组织各一份。所有的组织标本及淋巴结转移均经过手术和病理证实,同时收集正常口腔黏膜标本14例作为正常对照,其中10例来自口腔黏膜良性增生物的正常边缘,4例来自口腔创伤黏膜组织。每份标本都分成3份,一份进行RNA的提取,一份进行总蛋白的提取,一份运用石蜡切片技术处理。
1.2 SYK(L)特异性抗体定制与检测
SYK(L)特异性抗体的定制参照文献[6],针对SYK(L)特有而SYK(S)缺失的23个氨基酸,合成氨基酸序列TWSAGGIISRIKSYSFPKPGHRKC,经过钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)偶联后免疫新西兰白兔,提取免疫后阳性血清并与抗原亲和纯化,得到与抗原特异性结合的抗体(抗体制作由苏州Abgent生物科技有限公司完成)。
1.3 RT-qPCR引物序列
聚合酶链反应(polymerase chain reaction,PCR)引物由上海捷瑞生物工程有限公司合成。SYK(L)上游引物序列为:5'-GAATCAAATCATACTCCTTCCCAAA-3',下游引物序列为:5'-GGCTCATACGGATTGAATGACA-3'。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,上游引物序列为:5'-GAAGGTGAAGGTCGGAGTC-3',下游引物序列为:5'-GAGATGGTGATGGGATTTC-3'。
1.4 方法
1.4.1 RT-qPCR技术检测SYK(L)基因的相对表达量 用Trizol法提取组织标本总RNA(Invitrogen公司,美国),紫外分光光度计测定其纯度和浓度,并用PrimeScript RT Reagent Kit(TaKaRa公司,日本)试剂盒逆转录为cDNA。PCR过程选用FastStart Universal SYBR Green Master(Roche公司,瑞士)试剂盒,在ABI7300HT RT qPCR仪(Applied Biosystems公司,美国)上进行。具体反应体系参照文献[8],总体系20 μL,95 ℃ 10 min,95 ℃ 10 s,退火温度为60 ℃,共35循环。原始数据值(Ct值)换算为基因的相对表达量,R=2-(ΔCP样品-ΔCP对照),其中R是SYK(L)相对于内参GAPDH的表达量,ΔCP=CtSYK(L)-CtGAPDH。
1.4.2 Western blot技术检测SYK(L)蛋白的表达 用RIPA裂解液和苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)液提取组织总蛋白,BCA法测定蛋白浓度,定量总蛋白样品为15 μg并上样,经7.5%十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)电泳后,转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉室温下封闭1 h,与相应的一抗4 ℃杂交过夜,磷酸盐吐温(phosphate-buffered saline tween,PBST)缓冲液漂洗,室温下用含辣根过氧化酶标记的二抗(1︰3 000稀释)室温孵育1 h,洗膜后与化学发光HRP底物ECL发光液显影剂结合,经ImageQuant LAS 4000发光成像分析仪曝光并用Image J软件测定各组SYK(L)与β-actin的灰度值比值作为SYK(L)蛋白的相对表达量。
1.4.3 免疫组织化学染色检测SYK(L)蛋白的表达组织标本经多聚甲醛溶液固定并脱水包埋,连续5 μm切片。二甲苯脱蜡和乙醇梯度水化后,用PBS冲洗。柠檬酸钠修复液中微波抗原修复20 min,待切片自然冷却至室温后置于3%过氧化氢中10 min,PBS冲洗,即用型正常山羊血清封闭20 min,4 ℃下SYK(L)(1︰300稀释)一抗孵育过夜。用Polink-2 plus(GBI公司,美国)试剂盒结合一抗,DAB试剂盒(北京中杉金桥生物技术公司)染色3 min,苏木精复染,二甲苯透明,中性树脂封片。以β-actin抗体(1︰1 000稀释,Bioworld公司,美国)染色作为阳性对照,以山羊血清代替一抗作为阴性对照。染色判断与评分标准参考文献[9],由2位病理科医师分别双盲阅片。每张切片随机选取5个包含上皮组织的视野,每个视野计数100个细胞,由阳性细胞所占比例和染色程度综合评分:阳性细胞<10%为0分,10%~30%为1分,31%~50%为2分,>50%为3分;细胞无显色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。每例综合积分为前述2个评分的乘积。积分≤2评判为阴性表达,>2为阳性表达。
1.5 统计学方法
采用SPSS 18.0软件进行统计分析。用T检验分析不同组别SYK(L)基因的相对表达量;用χ2检验分析免疫组织化学SYK(L)的表达差别,以P<0.05为差异有统计学意义。
2 结果
2.1 SYK(L)在OSCC组织中的表达
RT-qPCR检测结果见图1。SYK(L)基因在口腔正常牙龈组织、癌旁组织及癌组织中表达量依次降低,各指标间差异均有统计学意义。
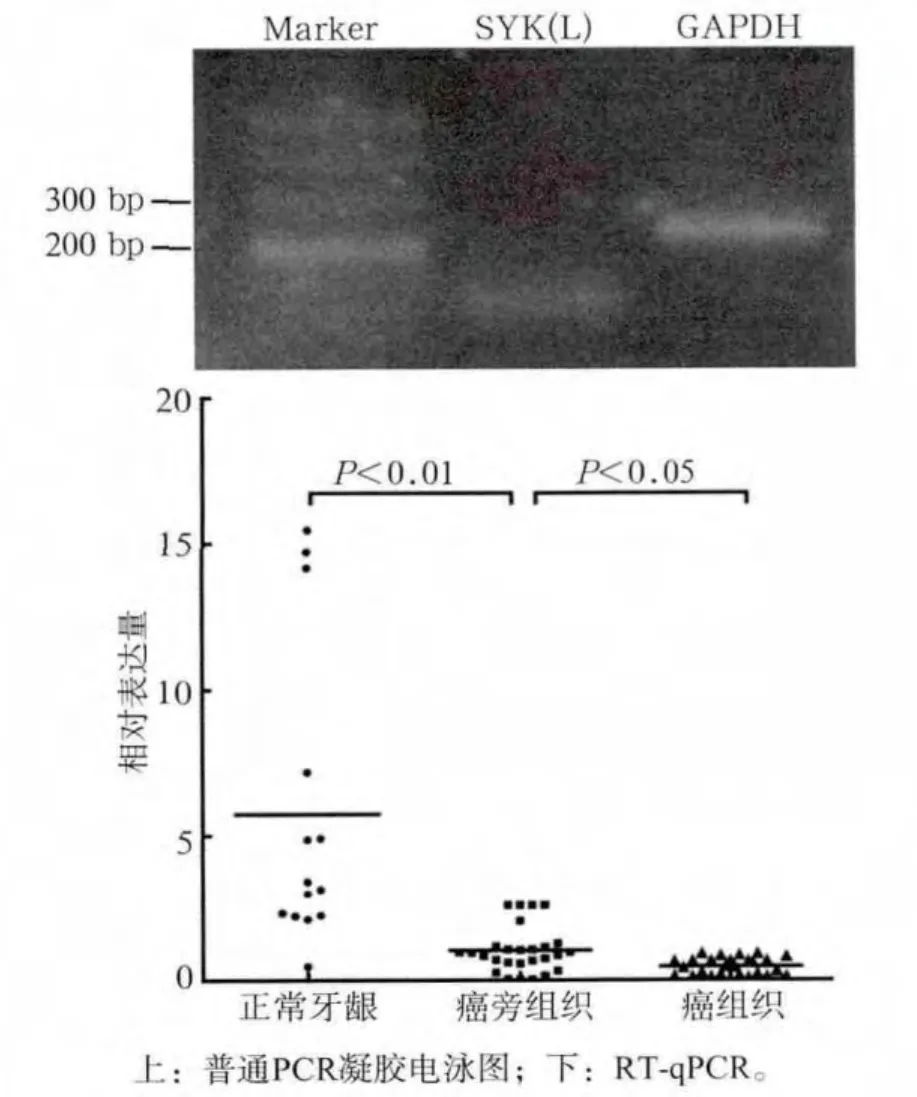
图1 SYK(L)基因在正常牙龈、癌旁组织、癌组织中的相对表达量Fig 1 Relative expression of SYK(L) mRNA in normal tissues, OSCC tissues and its matched adjacent non-cancerous tissues
Western blot灰度值分析结果见图2。在14例正常口腔黏膜、27例癌旁组织和对应27例癌组织中,SYK(L)蛋白的相对表达量依次降低,且均有统计学差异,与RT-qPCR结论相一致。同时免疫组织化学结果也显示(图3):SYK(L)在正常组织中强阳性表达,在癌组织中表达降低或缺失。正常牙龈组织中SYK(L)蛋白阳性表达率为71.4%(10/14),癌组织中阳性表达率为29.6%(8/27),差异有统计学意义。对于同一患者,其癌组织和癌旁组织中SYK(L)表达也具有统计学差异(图4)。
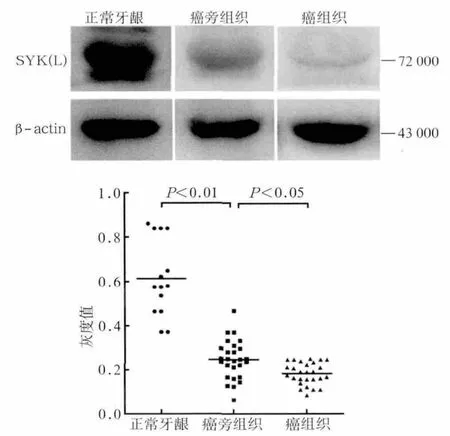
图2 SYK(L)蛋白在正常牙龈、癌旁组织、癌组织中的表达Fig 2 Expression of SYK(L) protein in normal tissues, OSCC tissues and its matched adjacent non-cancerous tissues
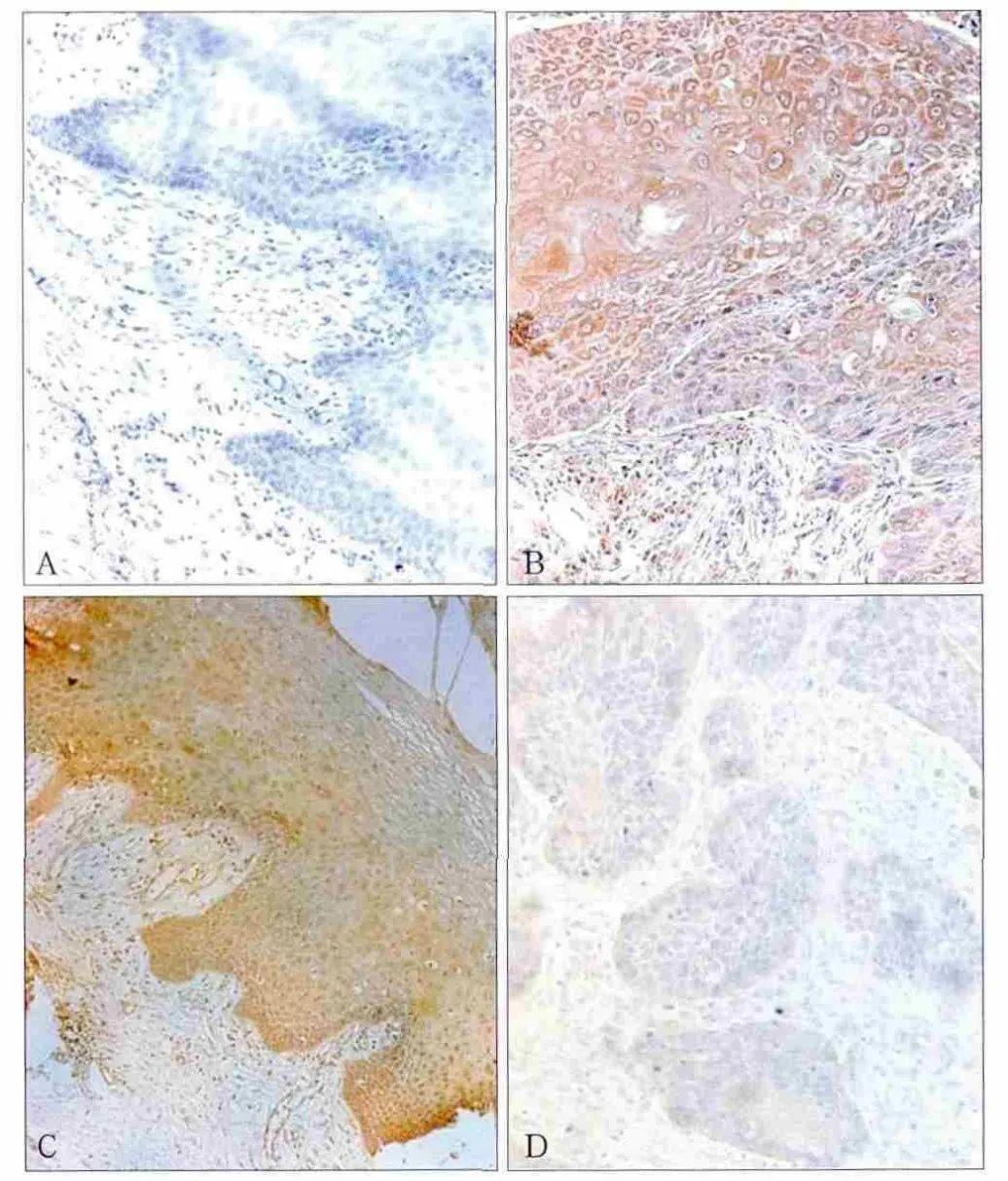
图3 SYK(L)在不同组织中的表达差异 免疫组织化学Fig 3 Expression of SYK(L) in different tissues immunohistochemistry
2.2 SYK(L)的表达与OSCC淋巴结转移的关系
由图5可见,在癌组织及癌旁组织中,转移组的SYK(L)的相对表达量与癌组织淋巴结转移的相关关系见图5。SYK(L)表达量都比对应未转移组的表达量低,其中SYK(L)蛋白在癌组织中差异具有统计学意义(P=0.01),而在癌旁组织中差异无统计学意义(P>0.05)。
2.3 SYK(L)蛋白表达的定位差异
免疫组织化学检测结果显示:正常的牙龈组织中,SYK(L)蛋白在胞浆中均有表达,阳性表达率为100%(14/14),其在胞核中的阳性表达率为64.3%(9/14);而在癌组织中,SYK(L)蛋白在胞浆中阳性表达率为100%(14/14),但在胞核中的阳性表达率明显降低,仅为25.9%(7/27),SYK(L)蛋白在胞核中的表达差异具有统计学意义(P=0.017)。
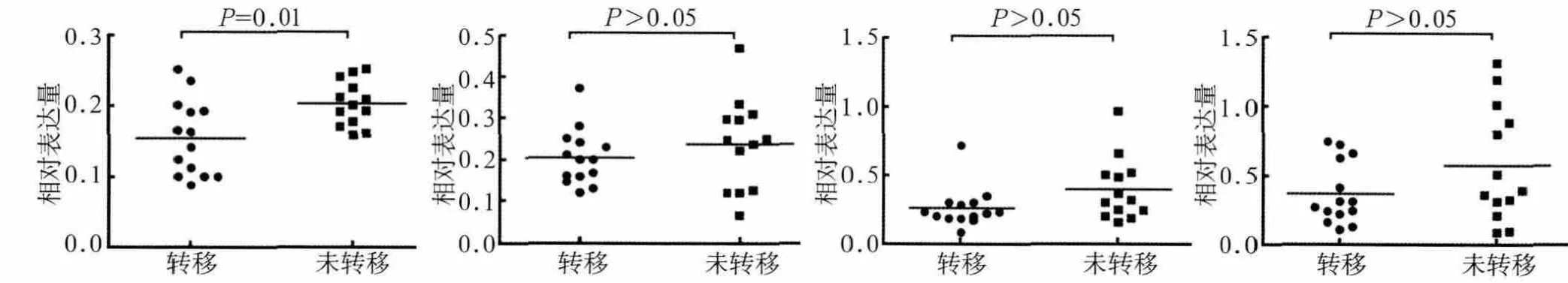
图5 SYK(L)在癌组织和癌旁组织中的表达差异Fig 5 Relative expression of SYK (L) in OSCC and its matched adjacent non-cancerous tissues
3 讨论
OSCC是头颈部最常见的恶性肿瘤,约占全身恶性肿瘤的3%[10]。近年来口腔癌的发病率逐年增高,且有年轻化、女性化趋势。治疗失败或局部复发、转移是口腔癌患者主要死亡原因。虽然经过以手术、放疗和化疗为主的综合治疗后,口腔癌患者5年生存率达到60%,但晚期患者5年生存率为20%~40%[11]。因此,寻找口腔癌新的治疗靶点一直是该领域的研究重点。淋巴转移是OSCC主要的转移方式,转移率为50%~59%,且对预后有着重要影响。OSCC颈淋巴结转移受诸多因素的影响,其中包括患者的免疫状态、临床病理相关因素、转移相关基因等,但其相关分子机制尚未阐明。
SYK基因最早由日本学者[12]于1991年从猪脾cDNA中克隆出来,该基因位于人染色体9q22,蛋白相对分子质量为72 000,在较长时间内被认为是造血细胞特有的分子,后来发现SYK在多种非造血细胞中也有表达。SYK作为酪氨酸激酶家族成员,其在免疫系统中参与广泛的信号级联的网络调控,随着细胞类型、底物、受体的不同,能调节多种信号通路。核转录因子κB(nuclear factor-κB,NF-κB)是近年来研究热门的核转录因子,其在组织损伤、应激、细胞分化、凋亡以及肿瘤微环境中作用广泛。SYK可以通过磷酸化NF-κB的抑制物IκB来激活核NF-κB信号通路,发挥下游转录功效,启动或者抑制下游靶基因的转录功能。Src和表皮生长因子受体(epidermal growth factor receptor,EGFR)作为在肿瘤中研究较为深入的酪氨酸激酶,在肿瘤中表达异常增高,介导着肿瘤的发生与发展。而SYK可通过降低Src的活性,干扰EGFR及其下游信号分子的磷酸化来抑制Src和EGFR的信号通路。另外,SYK还可以通过激活磷脂酰肌醇激酶、丝裂原活化蛋白激酶等信号通路直接或间接影响细胞的生长[13]。
自2000年Coopman等[14]首先发现SYK在乳腺癌细胞中表达下调以来,陆续发现其在肝癌、胃癌、肺癌、黑色素瘤等多种癌细胞中表达下调,推断SYK可能是一种潜在的抑癌基因[3]。以往关于SYK在头颈癌中表达的研究甚少,Luangdilok等[8]发现SYK在头颈部鳞癌(squamous cell carcinoma of the head and neck,SCCHN)细胞中表达上调,且增加了SCCHN细胞的运动性。而Ogane等[15]研究结果却发现,SYK在OSCC中表达缺失,是潜在的抑癌基因。SYK在SCCHN和OSCC中作用的截然相反是否由组织来源的差异导致的,仍需进一步证实。
更深入的研究发现,SYK在转录过程中会选择性地拼接,产生两种蛋白异构体,一种为SYK(L),有研究[5-7]发现其发挥着抑癌基因的功能,而选择性拼接导致IDB域缺失了23个氨基酸的SYK(S)没有此项功能[16]。SYK(L)与SYK(S)在亚细胞定位上也存在差异,这为更加深入研究SYK在OSCC中的亚型差异提供了结构基础。
近年来,洪健等[17]关于SYK(S)亚型蛋白的研究显示,SYK(S)可促进肝癌细胞的侵袭转移能力,首次提示SYK可能扮演着癌基因的角色,这也显示出区分SYK不同亚型在研究癌症发生发展过程中的必要性。本研究将SYK(L)在口腔癌中单独检测,结果显示SYK(L)在OSCC中表达下调,并在转移和非转移患者中表达趋势也不同,表明SYK(L)与OSCC的发生和发展有关。这一结论和既往大部分的报道相一致,验证了其抑癌基因的作用,同时也为不同结论提出合理的解释,即SYK“抑癌基因”的角色实际是由SYK(L)亚型担任,而SYK(S)可能具有癌基因的功能,两者功能相反,可能是获得不同结论的原因。本研究还发现SYK(L)在口腔癌中失去核定位能力,这也为SYK(L)在口腔癌中的作用缺失提供了有力证据。
本研究发现SYK(L)的表达缺失是OSCC高淋巴结转移率和高侵袭性的重要原因,为进一步揭示恶性肿瘤淋巴转移相关分子机制提供了新思路。目前针对肿瘤的治疗除传统的手术治疗、放射治疗和化疗外,肿瘤的综合治疗,特别是基因治疗和免疫治疗为肿瘤的治疗提供了新途径。随着SYK在肿瘤的研究不断深入及技术的发展,相信可为肿瘤的诊断提供新的科学依据。同时提供基因治疗,比如对突变或缺失的SYK基因进行修补,有望成为治疗肿瘤新的方法,将SYK基因转染入免疫细胞及肿瘤细胞,激活更多的免疫细胞发挥抗肿瘤免疫作用并阻止肿瘤细胞的生长与扩散。这就进一步提示,在头颈部肿瘤中对于SYK的检测将能进一步促进基因治疗的步伐,有极强的临床意义。
[1]Leemans CR, Braakhuis BJ, Brakenhoff RH. The molecular biology of head and neck cancer[J]. Nat Rev Cancer, 2011,11(1):9-22.
[2]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J].CA Cancer J Clin, 2013, 63(1):11-30.
[3]Coopman PJ, Mueller SC. The Syk tyrosine kinase: a new negative regulator in tumor growth and progression[J]. Cancer Lett, 2006, 241(2):159-173.
[4]Mócsai A, Ruland J, Tybulewicz VL. The SYK tyrosine kinase: a crucial player in diverse biological functions[J].Nat Rev Immunol, 2010, 10(6):387-402.
[5]Wang L, Duke L, Zhang PS, et al. Alternative splicing disrupts a nuclear localization signal in spleen tyrosine kinase that is required for invasion suppression in breast cancer[J].Cancer Res, 2003, 63(15):4724-4730.
[6]杨龙君, 洪健, 廖亚帝, 等. 全长型脾酪氨酸激酶对肝细胞癌侵袭和转移的抑制作用[J]. 中山大学学报: 医学科学版, 2011, 32(2):23-27.
[7]王磊, 胡英, 杨祖立, 等. 乳腺癌细胞中Syk(L)调节基因转录的生物学机制[J]. 癌症, 2007, 26(5):469-472.
[8]Luangdilok S, Box C, Patterson L, et al. Syk tyrosine kinase is linked to cell motility and progression in squamous cell carcinomas of the head and neck[J]. Cancer Res, 2007, 67(16):7907-7916.
[9]Yuan Y, Wang J, Li J, et al. Frequent epigenetic inactivation of spleen tyrosine kinase gene in human hepatocellular carcinoma[J]. Clin Cancer Res, 2006, 12(22):6687-6695.
[10]Fan S, Tang QL, Lin YJ, et al. A review of clinical and histological parameters associated with contralateral neck metastases in oral squamous cell carcinoma[J]. Int J Oral Sci,2011, 3(4):180-191.
[11]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917.
[12]Taniguchi T, Kobayashi T, Kondo J, et al. Molecular cloning of a porcine gene syk that encodes a 72-kDa protein-tyrosine kinase showing high susceptibility to proteolysis[J]. J Biol Chem, 1991, 266(24):15790-15796.
[13]Krisenko MO, Geahlen RL. Calling in SYK: SYK's dual role as a tumor promoter and tumor suppressor in cancer[J].Biochim Biophys Acta, 2015, 1853(1):254-263.
[14]Coopman PJ, Do MT, Barth M, et al. The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells[J]. Nature, 2000, 406(6797):742-747.
[15]Ogane S, Onda T, Takano N, et al. Spleen tyrosine kinase as a novel candidate tumor suppressor gene for human oral squamous cell carcinoma[J]. Int J Cancer, 2009, 124(11):2651-2657.
[16]Nakashima H, Natsugoe S, Ishigami S, et al. Clinical significance of nuclear expression of spleen tyrosine kinase(Syk) in gastric cancer[J]. Cancer Lett, 2006, 236(1):89-94.
[17]洪健, 唐云强, 廖亚帝, 等. 缩短型脾酪氨酸激酶促进肝细胞癌的侵袭转移[J]. 中华实验外科杂志, 2013, 30(6):1216-1219.

