盐酸小檗碱对大鼠心肌梗死模型心室重塑的作用研究
晋金兰,韦建瑞,尹海燕,梁艳雯,郭键,吕荣贵,刘喜鸿
基础与实验研究
盐酸小檗碱对大鼠心肌梗死模型心室重塑的作用研究
晋金兰,韦建瑞,尹海燕,梁艳雯,郭键,吕荣贵,刘喜鸿
目的:研究盐酸小檗碱对大鼠心肌梗死(心梗)模型心室重塑的作用并探讨其机制。
方法:采用冠状动脉结扎法复制大鼠心梗模型,建好模型随机分为两组,心梗对照组和盐酸小檗碱组,同时设立假手术组。盐酸小檗碱组大鼠每日灌胃给予盐酸小檗碱20 mg/kg,假手术组和心梗对照组每日给予同等剂量生理盐水。8 W后超声心动图检测大鼠心功能和心脏结构,马松(Masson)染色法检测心肌间质胶原容积分数,Tunel法检测心肌细胞凋亡情况,并检测心肌细胞核因子-κB活化情况。
结果:超声心动图检测结果显示,心梗对照组与假手术组相比,左心室舒张末期内径(LVDd)扩大[(7.28 ± 0.29)mm比(6.86 ± 0.36)mm,P < 0.05]、左心室收缩末期内径(LVDs)扩大[(5.88 ± 0.33)mm比(4.61 ± 0.31)mm,P< 0.01]、左心室后壁收缩末期厚度(LVPWTs)增厚[(1.81 ± 0.85)mm比(1.67 ± 0.16)mm,P < 0.05],左心室射血分数(LVEF)下降[(45.77 ± 3.17)% 比(67.28 ± 4.15)%,P < 0.01];盐酸小檗碱组与心梗对照组相比:LVDs[(4.68 ± 1.17)mm]缩小,LVPWTs[(1.65 ± 0.14)mm]下降,LVEF[(64.64 ± 5.82)%]增加,差异均有统计学意义(P均< 0.01);而LVDd[(6.89 ± 0.99)mm]缩小,差异无统计学意义(P>0.05)。Masson染色结果显示,心梗对照组与假手术组相比,胶原容积分数增加[(11.39 ± 0.45)% 比(2.65 ± 0.45)%,P < 0.01],盐酸小檗碱组 [(7.00 ± 0.87)% ]较心梗对照组减少(P < 0.01)。Tunel实验结果显示,心梗对照组与假手术组相比,心肌细胞凋亡指数增加(21.31 ± 2.34比0.99 ± 0.38,P < 0.01),盐酸小檗碱组(14.15 ± 1.62)较心梗对照组减少(P < 0.01)。核因子-κB活化情况检测结果示,术后8 W时,心梗对照组与假手术组相比,细胞核内的p65含量增加[(0.14±0.02)ng/ml比(0.06±0.01)ng/ml],盐酸小檗碱组[(0.10±0.02)ng/ml]较心梗对照组减少。差异均有统计学意义(P < 0.01)。
结论:盐酸小檗碱可改善大鼠心梗模型心室重塑和心功能,其机制考虑与其部分抑制心肌细胞核因子-κB活化、降低非心梗区心肌间质胶原沉积、抗心肌细胞凋亡有关。
盐酸小檗碱;心肌梗死模型;心室重塑;核因子-κB
(Chinese Circulation Journal, 2015,30:795.)
急性心肌梗死(心梗)后发生的心室重塑是导致此类患者发展为心力衰竭(心衰)的重要原因。如何有效防止心室重塑的发生发展成为近年来心衰防治的研究热点。目前针对急性心梗的发生机制及心室重塑的病理生理而采用的血运再通、拮抗神经内分泌异常激活等治疗方法虽取得了较好疗效,但心衰患者5年死亡率仍然接近50%[1]。这提示关于如何预防及逆转心室重塑的发生发展仍存在一些未知领域有待人们深入探索研究。
盐酸小檗碱(Sigma-Aldrich)近年来被发现具有抗心衰的作用,但具体机制尚不明确。炎症反应在心梗后心室重塑发生发展过程中起了重要作用。研究发现在因缺血或扩张型心肌病导致心衰的患者,其移植换下来的心脏和大鼠心衰模型的心肌细胞上,核因子-κB都是显著激活的[2]。另有研究发现盐酸小檗碱对许多组织器官的核因子-κB活性具有抑制作用[3-6],但其对大鼠心梗模型心肌细胞核因子-κB的作用如何罕有文献报道。本实验旨在研究盐酸小檗碱对大鼠心梗模型心室重塑的作用并探讨其机制,以期为心衰的防治找到新的辅助治疗方法。
1 材料与方法
实验时间:2013-06至2014-05。实验动物:成年雄性SD大鼠,体重(250±10)g,50只,广东省医学实验动物中心提供(动物合格证号:SCXK粤 2008-0002)。水合氯醛(上海试剂二厂),小动物呼吸机Model 683(美国自然基因有限公司),BL-420E生物机能实验系统(成都泰盟科技有限公司),单腔中心静脉导管(7 Fr单腔20 cm导管,Biosensors International Pteltd, 新加坡),盐酸小檗碱(Sigma-Aldrich,美国),Power Vision 8000超声诊断仪(TOSHBA,日本),马松(Masson)三色染色试剂盒(南京森贝伽生物有限公司),Tunel细胞凋亡试剂盒(武汉博士德公司)。TransAM NF-κB p65 Transcription Factor Assay Kits(Active motif, 美国)。
大鼠心梗模型的复制及实验分组:10%水合氯醛(3.8 ml/kg)腹腔注射麻醉大鼠,颈部正中皮肤切一长约1.5 cm的小口,逐层分离肌肉、筋膜,暴露气管,导引钢丝刺入3、4气管软骨环间隙,朝口腔方向缓慢送出至口腔外,将深静脉导管沿导丝送入气管,退出导丝,导管开口连接小动物呼吸机辅助通气(潮气量:3 ml/100 g体重;呼吸频率:60次/ min;吸呼比:1:1)。选择胸骨左缘第3~4肋间开胸,充分暴露心脏,在左心耳与肺动脉圆锥连线中点下方2 mm处结扎冠状动脉,当结扎区域心肌组织变白、心脏运动减弱及心电图两个以上肢体导联出现ST段上抬≥0.2 mV时判断造模成功。逐层缝合肌肉和皮肤。术后大鼠单笼饲养。连续3 d腹腔注射青霉素10万U以预防伤口感染。将术后24 h存活大鼠分为假手术组10只(仅在血管下穿线而不结扎血管),40只制作心梗模型存活大鼠30只,随机分为2组,心梗对照组和盐酸小檗碱组,每组15只。盐酸小檗碱组大鼠每日给予盐酸小檗碱20 mg/kg灌胃,假手术组和心梗对照组大鼠给予同等剂量生理盐水灌胃。给药时间为8 W。
大鼠模型超声心动图检测:将用10%水合氯醛溶液腹腔注射麻醉的大鼠仰置于自制木板上,用超声诊断仪(频率12 MHz)进行心脏超声检查。左心室长轴切面测量大鼠左心室舒张末期内径(LVDd),左心室收缩末期内径(LVDs),左心室短轴M型切面测量左心室后壁收缩末期厚度(LVPWTs),读取左心室射血分数(LVEF),连续测量3个心动周期数值,取其均值进行数据统计分析。
Masson染色法检测心肌间质胶原沉积情况:术后8 W时处死大鼠,摘除心脏,取心脏非心梗区心肌组织多聚甲醛固定24 h梯度酒精脱水石蜡包埋,组织切片,苏木素伊红染色5 min,丽春红染色7 min,苯胺蓝复染10 min,1 %冰醋酸处理2 min;95 %、100%梯度酒精脱水,二甲苯透明,中性树脂封片。用IPP 6.0图像采集分析系统采图分析计算每个视野中胶原组织所占的百分比,最后各组取平均数代表胶原容积百分比并计算胶原容积分数。
脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Tunel法)测定心肌细胞凋亡情况:心肌组织多聚甲醛固定24 h,梯度酒精脱水石蜡包埋,组织切片,37 ℃恒温箱烤片过夜、脱蜡。切片分别滴加蛋白酶K溶液37℃30 min,末端脱氧核糖核酸转移酶和生物素化抗地高辛抗体各1 μl ,标记缓冲液18 μl,混匀后甩干切片上液体后加标记液20 μl /片,置湿盒37℃标记 2 h终止;室温封闭内源性过氧化物酶15 min,50 μl /片1:100 稀释生物素化抗地高辛抗体,置湿盒37℃反应30 min;50 μl /片1:100 稀释链霉素—生物素复合物,37℃ 30 min,二氨基联苯胺显色液显色,苏木素伊红轻度复染,中性树脂封片,镜下观察:凋亡阳性细胞分布情况,每张片双人双盲拍摄3个阳性视野,以阳性细胞数所占观察心肌细胞的比例作为凋亡指数,凋亡指数=凋亡细胞数/(凋亡细胞数目+正常细胞数目)× 100 % 。
大鼠心梗模型心肌细胞核因子-κB活化情况:核因子-κB静息状态下以二聚体形式与其天然的阻遏蛋白IκB结合,以无活性状态存在于细胞浆。当细胞受到外源性刺激时,引起IκB降解,核因子-κB得以活化进入细胞核内发挥其转录调节作用。
实验中我们采用TransAM NF-κB p65 Transcription Factor Assay Kits检测大鼠模型心肌细胞核因子-κB活化情况,通过试剂盒检测转移到细胞核内的p65含量来反应核因子-κB的活化程度。根据不同浓度的标准品及其对应的吸光度值绘制p65蛋白吸光度—浓度标准曲线,样品p65蛋白浓度为标准曲线上吸光度值相对应的浓度。具体实验步骤按照试剂盒说明书进行操作[7]。
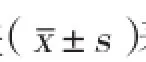
2 结果
大鼠心梗模型造模结果:术后8 W时假手术组存活大鼠8只,心梗对照组存活大鼠12只,盐酸小檗碱组存活大鼠15只。
大鼠心梗模型超声心动图检测结果(表1):心梗对照组与假手术组相比, LVDd扩大(P < 0.01)、LVDs扩大(P < 0.01)、LVPWTs增厚(P < 0.05),LVEF下降(P < 0.01);盐酸小檗碱组与心梗对照组相比LVDs缩小、LVPWTs下降,LVEF增加(P均<0.01),差异均有统计学意义。盐酸小檗碱组与心梗对照组相比LVDd差异无统计学意义(P>0.05)。
表1 术后8 W时大鼠模型心功能及心脏结构超声心动图检测结果
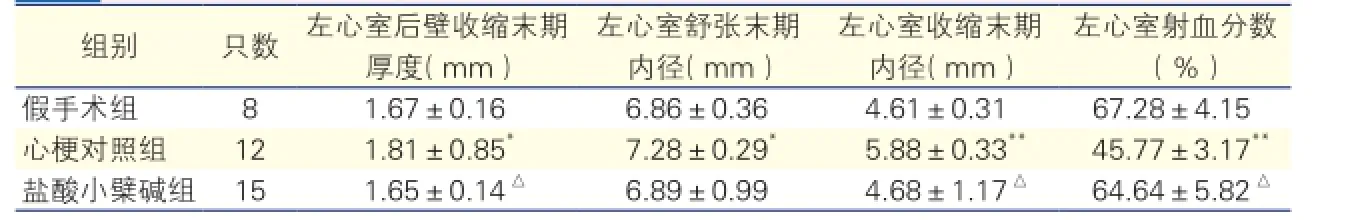
表1 术后8 W时大鼠模型心功能及心脏结构超声心动图检测结果
注:与假手术组相比*P< 0.05**P< 0.01;与心梗对照组相比△P< 0.01
?
心肌组织胶原容积分数检测结果(图1):心梗对照组与假手术组相比,胶原容积分数增加,而盐酸小檗碱组较心梗对照组减少(P < 0.01),差异有统计学意义。
心肌细胞凋亡检测结果(图2):心梗对照组与假手术组相比,心肌细胞凋亡指数增加,而盐酸小檗碱组较心梗对照组减少,差异有统计学意义(P <0.01)。
心肌细胞核因子-κB活化情况:术后8 W时,心梗对照组与假手术组相比,细胞核内的p65含量增加[(0.14±0.02)ng/ml比(0.06±0.01)ng/ml],而盐酸小檗碱组[(0.10±0.02)ng/ml]较心梗对照组减少,差异有统计学意义(P < 0.01)。
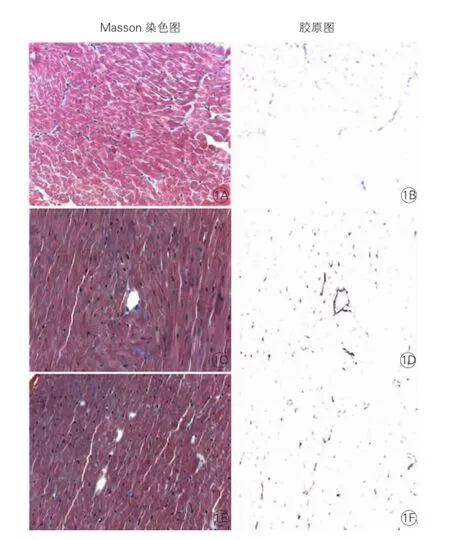
图1 术后8 W时三组大鼠心脏非心梗区光学显微镜图(×400)
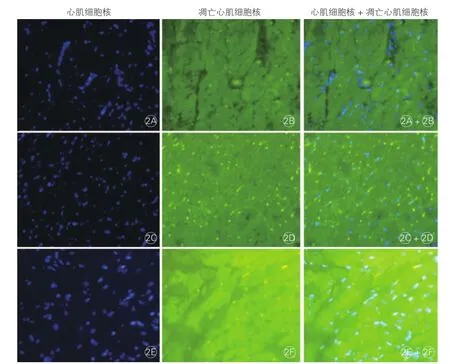
图2 术后8 W时三组大鼠心梗模型心脏非心梗区凋亡心肌细胞荧光显微镜图(×400)
3 讨论
如何预防和逆转心梗后心室重塑成为心衰防治的研究热点[8,9]。近年研究发现炎症反应在心梗后心室重塑病理生理过程中起重要作用[10,11]。心梗后,热休克蛋白、透明质酸等成分以“危险”信号的身份参与Toll样受体结合,最终激活核因子-κB,引发无菌性炎症和天然免疫应答[12]。目前研究人员认为对于以炎症为靶点的心梗后心室重塑干预策略至关重要。
近年药理学研究发现盐酸小檗碱具有显著抗心衰作用,但具体机制尚未完全阐明。研究发现盐酸小檗碱对许多组织器官的核因子-κB活性具有抑制作用[3-6],但其是否可通过调控大鼠心梗模型心肌细胞核因子-κB的活性而起到抗心衰作用目前少见文献报道。
实验中我们给大鼠心梗模型盐酸小檗碱8 W,然后检测其对大鼠心功能和心脏结构的影响,检测了大鼠模型心脏非心梗区心肌胶原容积分数和心肌细胞的凋亡情况以及心肌细胞核因子-κB活化情况,以探讨其对心梗后心室重塑产生作用的机制。实验结果显示盐酸小檗碱对大鼠心梗模型心室重塑具有保护作用,它可改善大鼠心梗模型的心肌间质纤维化,抑制心肌细胞凋亡,部分抑制核因子-κB的活化。
核因子-κB是广泛存在于细胞内的一种具有多向性调节作用的转录因子,广泛参与多个基因的转录调控。Frantz等[13]在实验研究中发现核因子-κB亚单位p50的缺乏可改善心梗后心衰小鼠模型的心室膨胀,他们认为其机制可能与心脏胶原含量降低和基质金属蛋白酶-9的表达降低有关。Davies等[14]也得出类似的结论。另有研究显示核因子-κB受抑制时,可能通过减轻前炎症反应以及调节细胞外基质以阻止心梗后心室重塑的进展[13,15]。当心肌纤维细胞的核因子-κB被激活后可诱导血管紧张素原或血管紧张素Ⅱ受体1型的表达,促进血管紧张素Ⅱ在心室重塑中的作用,加剧心肌肥厚及心功能恶化[16]。近期亦有学者提出核因子-κB与Notch信号通路的相互作用可能也参与了心梗后心室重塑的发生发展,但它们之间究竟存在何种相互作用及如何利用它们之间的关系来达到预防和(或) 逆转心梗后心室重塑成为新的研究方向。
综上所述,本实验结果提示盐酸小檗碱可改善大鼠心梗模型心室重塑,其机制考虑与其部分抑制心肌细胞核因子-κB活化、降低心肌间质胶原沉积及抗心肌细胞凋亡有关,具体分子作用机制有待进一步研究。
[1] Sabbah HN, Goldstein S. Ventricular remodeling: consequences and therapy. Eur Heart J, 1993, 14(suppl C): 24-29.
[2] Frantz S, Fraccarollo D, Wagner H, et al. Sustained activation of nuclear factor kappa B and activator protein 1 in chronic heart failure. Cardiovasc Res, 2003, 57: 749-756.
[3] 何国厚, 王建, 刘勇. 小檗碱对家兔颈动脉粥样硬化组织核因子-κB、血管细胞粘附分子1及单核细胞趋化蛋白1表达的影响.中国动脉硬化杂志, 2008, 16: 889-892.
[4] 王建, 何国厚, 李承宴, 等. 小檗碱对颈动脉粥样硬化家兔NF-κB的影响. 武汉大学学报(医学版), 2009, 30: 156-158.
[5] Liu SJ, Yin CX, Ding MC, et al. Berberine suppresses in vitro migration of human aortic smooth muscle cells through the inhibitions of MMP-2/9, u-PA, AP-1, and NF-κB. BMB Rep, 2014, 47: 388-392.
[6] Wang Y. Attenuation of berberine on lipopolysaccharide-induced inflammatory and apoptosis responses in β-cells via TLR4-independent JNK/NF-κB pathway. Pham Biol, 2013, [Epub ahead of print].
[7] Timmer L, Van Keulen JK, Hoefer IE, et al. Targeted deletion of nuclear factor κB p50 enhances cardiac remodeling and dysfunction following myocardial infraction. Circ Res, 2009, 104: 699-706.
[8] 崔贞玉, 韩素霞, 冯磊, 等. 氯沙坦影响大鼠心肌梗死后心室重塑的机制研究. 中国循环杂志, 2014, 29: 629-633.
[9] 李恩, 孙利强, 刘宗芳, 等. 瑞舒伐他汀对大鼠心肌梗死后活性氧物质产生及骨膜蛋白和心肌营养素表达的影响. 中国循环杂志, 2014, 29: 823-827.
[10] 廖玉华. 急性心肌梗死后心室重塑中的炎症反应. 岭南心血管病杂志, 2004, 20: 129.
[11] 刘英, 廖玉华, 程翔, 等. 急性心肌梗死心室重塑中心肌炎症反应与细胞因子表达. 中华心血管病杂志, 2004, 32(增刊2): 716-717.
[12] 卢芮伊, 周欣, 姬文婕, 等. 心肌梗死后心室重塑的治疗新靶点:免疫细胞中介的炎症反应. 中华临床医师杂志(电子版), 2013, 7: 11102-11105.
[13] Frantz S, Hu K, Bayer B, et al. Absence of NF-kappaB subunit p50 improves heart failure after myocardial infarction. FASEB J, 2006, 20: 1918-1920.
[14] Davies MJ, Gordon JL, Gearing AJ, et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM and E-selectin were in human atherosclerosis. J Pathol, 1998, 171: 223-229.
[15] Onai Y, Suzuki J, Maejima Y, et al. Inhibition of NF-{kappa}B improves left ventricular remodeling and cardiac dysfunction after myocardial infarction. Am J Physiol Heart Circ Physiol, 2007, 292: 530-538.
[16] Sármán B, Skoumal R, Leskinen H, et al. Nuclear factor-kappaB signaling conteibute to severe, but not moderate, angiotensin II-induced left ventricular remodeling. J Hypertens, 2007, 25: 1927-1939.
Effect of Bererine on Ventricular Remodeling in Experimental Rats With Myocardial Infarction
JIN Jin-lan, WEI Jian-rui, YIN Hai-yan, LIANG Yan-wen, GUO Jian, LV Rong-gui, LIU Xi-hong.
Central Intensive Care Unit, Guangzhou Red Cross Hospital, Fourth Affiliated Hospital of Medical College, Jinan University, Guangzhou (510220), Guangdong, China
Objective: To study the effect of berberine (BR) on ventricular remodeling in experimental rats with myocardial infarction (MI) and its mechanisms.Methods: The MI model of experimental rats was established by ligation of the left anterior descending coronary artery and the MI animals were randomly divided into 3 groups: MI+BR group, in which the rats received BR 20 mg/kg.d, Sham group and MI group, the rats in those 2 groups received the same volume of normal saline. All animals were treated for 8 weeks. The cardiac function and structure were assessed by echocardiography, cardiac interstitial collagen deposition was evaluated by Masson stain, the myocardial cell apoptosis was detected by Tunel method, and the activation of nuclear factor (NF-κB) was also examined.Results: For echocardiography, MI group had enlarged left ventricular end diastolic diameter (7.28 ± 0.29) mm than Sham group (6.86 ± 0.36) mm, P<0.05, but it decreased in MI+BR group (6.89 ± 0.99) mm, P>0.05. MI group had increased left ventricular end systolic diameter (5.88 ± 0.33) mm than Sham group (4.61 ± 0.31) mm, but it decreased in MI+BR group (4.68 ± 1.17) mm, all P< 0.01. MI group showed increased left ventricular posterior wall compensatory hypertrophy (1.81 ± 0.85) mm than Sham group (1.67 ± 0.16 mm), P<0.05, while in MI+BR group, it was deereased to (1.65 ± 0.14) mm. MI group presented decreased LVEF (45.77 ± 3.17) % than Sham group (67.28 ± 4.15) %, but it increased in MI+BR group (64.64 ± 5.82) %, all P<0.01. For Masson stain, cardiac interstitial collagen deposition in MI group (11.39 ± 0.45) % was higher than Sham group (2.65 ± 0.45) %, but less in MI+BR group (7.00 ± 0.87) %, all P<0.01. For Tunel examination, the myocardial cell apoptosis index was increased in MI group (21.31 ± 2.34) than Sham group (0.99 ± 0.38), but decreased in MI+BR group (14.15 ± 1.62), all P<0.01. For NF-κB activation study, the nuclear protein p65 content was higher in MI group (0.14 ± 0.02) ng/ml than Sham group (0.06 ± 0.01) ng/ml, but lower in MI+BR group (0.10 ± 0.02) ng/ml, all P<0.01.Conclusion: Application of BR may improve the ventricular remodeling and cardiac function in experimental MI rats, it might be because of BR partially inhibit NF-κB activation, reduce collagen deposition and help anti-apoptosis in myocardial cells.
Berberine; Myocardial infarction model; Ventricular remodeling; Nuclear factor-κB
2015-02-03)
(编辑:漆利萍)
广东省建设中医药强省科研课题(20141217);广东省医学科研基金项目(B2012034);广州市医药卫生科技项目(20151A011015);广州市医药卫生科技项目(20141A011019)
510220 广东省广州市,暨南大学医学院第四附属医院 广州市红十字会医院 中心ICU(晋金兰、尹海燕、梁艳雯),心内科(韦建瑞、吕荣贵),超声科(刘喜鸿);中山大学医学院 药理学实验室(郭键)
晋金兰 副主任医师 博士 研究方向为心力衰竭的防治 Email: jinjinlan@163.com 通讯作者:韦建瑞 Email:jianruiwei@163.com
R541
A
1000-3614(2015)08-0795-05
10.3969/j.issn.1000-3614.2015.08.019

