丹参酮ⅡA对自发性高血压大鼠左心室心肌肥厚及心肌细胞凋亡的影响
王诗才,陈太军,黄美松,朱少铭
丹参酮ⅡA对自发性高血压大鼠左心室心肌肥厚及心肌细胞凋亡的影响
王诗才,陈太军,黄美松,朱少铭
目的:研究丹参酮ⅡA对自发性高血压大鼠(SHR) 左心室心肌肥厚及心肌细胞凋亡的影响。
方法:将60只8周龄SHR随机分为3组,即空白对照组(第8 W时处死)、丹参酮ⅡA处理组 [1 ml/(kg·d)]和溶剂对照组 [1 ml/(kg·d)] ,每组15只大鼠(各组均另留5只为备用)。丹参酮ⅡA处理组和溶剂对照组继续喂养至18 W后测定SHR的收缩压和左心室质量指数(LVMI);左心室组织经苏木素伊红(HE)染色后拍照,应用全自动形态测量仪测定心肌细胞的直径和表面积;应用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)测定心肌细胞凋亡率,同时运用蛋白免疫印迹(Western-blot)测定心肌组织中凋亡相关蛋白Bcl-2、Bax和p53的表达水平。
结果:(1)与溶剂对照组(18 W)比较, 丹参酮ⅡA处理组(18 W)SHR的LVMI[ (3.23±0.24) mg/g vs(4.58±0.68) mg/g ]、细胞的直径[(16.13±1.77) µm vs (27.15±3.52) µm]、表面积[(230.23±69.37) µm2vs(490.12±118.96) µm2]和心肌细胞凋亡率[(7.45±1.78)% vs (10.61±2.77)%]均降低,差异均有统计学意义(P均<0.01);(2)蛋白相对表达水平[经内参还原型辅酶Ⅱ(NAPDH)校正后以Bcl-2/NAPDH、Bax/NAPDH、p53/ NAPDH表示]:与溶剂对照组(18 W)比较, 丹参酮ⅡA处理组(18 W)SHR的Bcl-2/NAPDH升高(0.97±0.31vs 0.40±0.11),Bax/NAPDH降低(0.37±0.15 vs1.81±0.44)和p53/NAPDH降低(0.83±0.18 vs2.72±0.28),差异均有统计学意义(P均<0.05或<0.01)。而丹参酮ⅡA处理组(18 W)与空白对照组(8 W)比较,上述指标均无明显变化,差异均无统计学意义(P均>0.05)。
结论:丹参酮ⅡA能抑制SHR左心室心肌肥厚的发生,同时能降低心肌细胞凋亡的程度,提示丹参酮ⅡA可能通过上调Bcl-2蛋白表达和下调Bax、p53蛋白表达来调节心肌细胞的凋亡水平。
丹参酮ⅡA;自发性高血压大鼠;心肌肥厚;细胞凋亡
Methods: A total of 60 SHRs at 8 weeks of age were randomly divided into 3 group: Blank control group, the rats were sacrificed at 8 weeks, TSN group, the rats were treated with TSN at 1 ml/(kg·d) for 18 weeks and Solvent control group, the rats were treated with the solvent at 1 ml/(kg·d) for 18 weeks. n=20 in each group and 15 rats were used for the experiments. The systolic blood pressure (SBP) and left ventricular mass index (LVMI) were examined, cardiomyocyte’s diameter and surface area were measured by HE staining, the apoptosis rate was evaluated by TUNEL method and the apoptosis related protein expression s of Bcl-2, Bax and p53 were determined by Western blot analysis.
Results: ①Compared with Solvent control group, TSN group had decreased LVMI (3.23 ± 0.24) mg/g vs (4.58 ± 0.68) mg/g,
cardiomyocyte’s diameter (16.13 ± 1.77) µm vs (27.15 ± 3.52) µm and surface area (230.23 ± 69.37) µm2vs (490.12 ± 118.96) µm2and decreased apoptosis rate (7.45 ± 1.78) % vs (10.61 ± 2.77) %, all P<0.01.②With NAPDH reference correction, compared with Solvent control group, TSN group presented increased protein expression of Bcl-2 (0.97 ± 0.31)vs (0.40 ± 0.11) and decreased Bax (0.37 ± 0.15) vs (1.81 ± 0.44), decreased p53 (0.83 ± 0.18) vs (2.72 ± 0.28), all P<0.05 or P<0.01. The above indexes were similar between TSN group and Blank control group, P>0.05.
Conclusion: TSN could inhibit the development of LVH and decrease the cardiomyocyte apoptosis, which might be via up-regulating the protein expressions of Bcl-2 and down-regulating Bax and p53 in SHRs.
(Chinese Circulation Journal, 2015,30:694.)
左心室细胞过度肥厚是高血压患者的常见并发症,也是冠心病发生发展过程中的显著特征,左心室细胞过度肥厚是冠心病发生的一种风险因子[1]。研究发现左心室细胞过度肥厚将导致心肌缺氧、心律失常、心脏衰竭甚至猝死[2,3]。丹参酮ⅡA (tanshinoneⅡA) 为唇形科多年生草本植物,是一种传统中药,具有活血化瘀、宁心安神等功效,已广泛用于临床治疗心脑血管疾病[4]。在自发性高血压大鼠(SHR)模型中的研究发现,丹参酮ⅡA具有心肌保护功能防止左心室细胞过度肥厚[5]。丹参酮ⅡA预防左心室细胞过度肥厚发生可能的作用机制在于其抑制肾素—血管紧张素—醛固酮系统(RAAS)[6]。研究发现在左心室细胞过度肥厚时高活性的RAAS与心肌细胞凋亡率呈正相关[7]。因此,本研究以SHR为实验对象研究丹参酮ⅡA在左心室细胞肥厚过程中的作用以及抗凋亡蛋白的表达变化,初步探讨丹参酮ⅡA对SHR左心室心肌肥厚及心肌细胞凋亡的影响。
1 材料与方法
动物模型建立及分组:2013-05至2014-02用于实验的大鼠严格按照国家动物实验要求规则执行,并得到湖北医药学院实验动物管理委员会的批准。60只雄性SHR购自于上海市高血压研究所,用于实验的大鼠在实验前正常进食,在(25±1)℃和50%~55%湿度条件下饲养8 W。随后将大鼠随机分为3组,每组15只大鼠,另每组再各留5只为备用,防止SHR大鼠意外死亡。实验分组为空白对照组(第8周时处死);丹参酮ⅡA处理组[1 ml/(kg·d)]:实验开始即给丹参酮ⅡA[1 ml/(kg·d) ],第1 天开始给药,每周给药1次;溶剂对照组[1 ml/(kg·d)]:以二甲基亚砜(DMSO)为溶剂,给药方式同丹参酮ⅡA处理组。丹参酮ⅡA处理组和溶剂对照组培养至18 W时将大鼠麻醉致死,保藏于-80℃用于后续实验。
试剂:丹参酮ⅡA(纯度≥98%,货号:S02001300)购自于中国药品和生物制品检测中心;兔抗鼠Bcl-2,Bax和p53单克隆抗体购自Santa Cruz公司(美国);辣根过氧化物酶标记的二抗LgG购自北京中山金桥;TUNEL细胞凋亡检测试剂盒购自迈新生物技术开发有限公司;DAB染色试剂盒(货号:070004-D)购自北京赛驰生物科技有限公司;BCA蛋白浓度检测试剂盒(货号:23225)购自Thermo公司(美国);Hoechst 33258及其他生化试剂购自Sigma公司(美国)。
SHR收缩压的测定:将处理后的SHR于38℃放置15 min,用血压计袖带(MRS2 III)测量每只老鼠的收缩压,每只老鼠重复测量5次,计算每只老鼠的平均收缩压,所有的操作都是在老鼠有意识的情况下进行。
SHR左心室质量指数(LVMI)的测定:SHR处死后,取出心脏,将主要的血管、心房、右心室从左心室中分离出来,随后把左心室置于预冷的磷酸盐缓冲液(PBS,pH=7.2)中洗涤,晾干,称重。然后根据下列公司计算LVMI。
左心室质量指数(LVMI)=左心室的体重(mg)/大鼠总体重(g)
苏木素伊红(HE)染色及心肌细胞直径和表面积的测量:取出大鼠左心室组织,样本通过4%多聚甲醛固定,PBS冲洗,乙醇脱水,石蜡包埋,冷冻切片,乙醇脱蜡,制成组织切片。再将制好的切片置于Harris苏木精溶液中染色5 min,使细胞核着色,自来水冲洗;再将组织切片放入0.5%的伊红酒精溶液中染色2 min,使细胞质着色,再经过乙醇脱水,二甲苯透明,中性树胶封片;运用Nikon ECLIPSE 80i生物显微镜进行观察,随机选择3个视野进行拍照。运用全自动形态测量仪(HPIAS21000,
中国)对左心室心肌细胞直径和面积进行测量,每张切片测量5次并计算其平均值。
心肌细胞凋亡分析:按照TUNEL试剂盒说明书对心肌细胞凋亡进行分析,左心室组织经过脱蜡,乙醇脱水,加入20 µg/ml 蛋白激酶K 37℃孵育15 min,随后加入0.3%的H2O2使组织中氧化酶失活。组织切片经PBS洗涤3次,加入30 µl TUNEL混合液,随后将组织切片放入湿盒内37℃孵育1 h。组织切片用PBS洗涤3次,再加入30 μl TUNEL混合液,放入湿盒内37℃孵育30 min。切片经PBS冲洗后用二氨基联苯胺显色液(DAB)显色,组织切片再经过HE染色。运用Nikon ECLIPSE 80i生物显微镜进行观察,并对结果进行拍照,这时细胞核呈蓝色而凋亡的细胞呈红色,随机选择3个视野计算心肌细胞凋亡率。
蛋白免疫印迹(Western-blot):取出左心室组织,用匀浆机将其捣碎,10 580 g,4℃离心10 min,收集上清,按照BCA试剂盒说明书测定蛋白浓度。将总蛋白50 μg进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,孵育一抗(p53抗体1:500, Bax抗体1:1000, Bcl-2抗体1:1000和β-肌动蛋白(actin)抗体1:3000),4℃过夜。TBST(Tris-HCl缓冲液包含10 mmol/L Tris-HCl, 150 mmol/L NaCl, 0.5‰吐温-20, pH7.4)洗膜、加入辣根过氧化物酶标记的兔抗鼠IgG(1:2000)室温孵育1 h。照片经免疫印迹化学发光试剂显影后扫描,蛋白表达灰度值经Quanity-One软件分析。

2 结果
3组SHR 18 W 时收缩压的比较:第18周时SHR的收缩压在丹参酮ⅡA处理组为(155±12)mmHg(1 mmHg=0.133 kPa),溶剂对照组为(152±7)mmHg,均处于较高水平(表1),两组与空白对照组(8 W)比较差异均有统计学意义(P<0.05或P<0.01)。
表1 3组SHR 18 W时收缩压、左心室质量指数、心肌细胞直径和心肌细胞表面积的比较(

表1 3组SHR 18 W时收缩压、左心室质量指数、心肌细胞直径和心肌细胞表面积的比较(
注:SHR:自发性高血压大鼠。与空白对照组比较*P<0.05**P<0.01。与溶剂对照组比较△△P<0.01。1 mmHg=0.133 kPa
?
3组SHR 18 W时LVMI、心肌细胞直径及表面积的比较:表1显示,SHR培养至18 W时,(1)LVMI:与溶剂对照组比较,丹参酮ⅡA处理组SHR的LVMI降低,差异有统计学意义(P<0.01),而丹参酮ⅡA处理组和空白对照组(8 W)间比较差异无统计学意义(P>0.05)。(2)心肌细胞的直径和表面积:心肌细胞经HE染色后显微镜观察拍照,经图像软件对心肌细胞直径和表面积计算分析显示,与溶剂对照组比较,丹参酮ⅡA处理组SHR的心肌细胞的直径和表面积减小(表1、图1),差异有统计学意义(P<0.01)。但丹参酮ⅡA处理组心肌细胞的直径和表面积与空白对照组(8 W)比较差异无统计学意义(P>0.05)。

图1 苏木素伊红(HE) 染色观察丹参酮IIA对SHR左心室心肌细胞形态的影响(HE,×400)
3组SHR 18 W时心肌细胞凋亡率和蛋白表达水平的比较(表2):SHR培养至18 W时,(1)心肌细胞凋亡率:与溶剂对照组比较,丹参酮ⅡA处理组SHR的心肌细胞凋亡率降低,差异有统计学意义(P<0.01); 而与空白对照组(8 W)比较差异无统计学意义(P>0.05)。(2) 蛋白表达水平(表2、图2、3):运用Western-blot测定SHR经丹参酮ⅡA处理后的左心室组织中凋亡相关蛋白Bcl-2,Bax和p53表达,结果经内参还原型辅酶Ⅱ(NAPDH)校正后(Bcl-2/NAPDH、Bax/NAPDH、p53/NAPDH)表示。结果显示SHR培养至18 W时,与溶剂对照组比较,丹参酮ⅡA处理组SHR的Bcl-2/ NAPDH升高,Bax/NAPDH和p53/NAPDH降低,提示Bcl-2蛋白水平升高,而Bax和p53蛋白表达降低;同时Bcl-2/Bax值(图3)也升高,差异均有统计学意义(P<0.05或P<0.01)。尽管图3显示丹参酮ⅡA处理组Bcl-2/Bax值也小于空白对照组,但两组比较差异无统计学意义(P>0.05)。此外与空白对照组(8 W)相比,丹参酮ⅡA处理组(18 W)SHR的Bcl-2、Bax和p53蛋白相对表达水平差异也无统计学意义(P>0.05)。表明,丹参酮ⅡA能抑制SHR左心室中与细胞凋亡相关蛋白和p53蛋白的表达,提示丹参酮ⅡA通过抑制细胞凋亡通路来防止SHR发生左心室过度肥厚。
表2 3组SHR 18 W时心肌细胞凋亡率和蛋白表达水平的比较

表2 3组SHR 18 W时心肌细胞凋亡率和蛋白表达水平的比较
注:NAPDH:还原型辅酶Ⅱ。与空白对照组比较**P<0.01;与溶剂对照组比较△P<0.05△△P<0.01。余缩略语注释见表1
?

图2 蛋白免疫印迹检测SHR 18 W时心肌组织中Bcl-2,Bax和p53蛋白表达
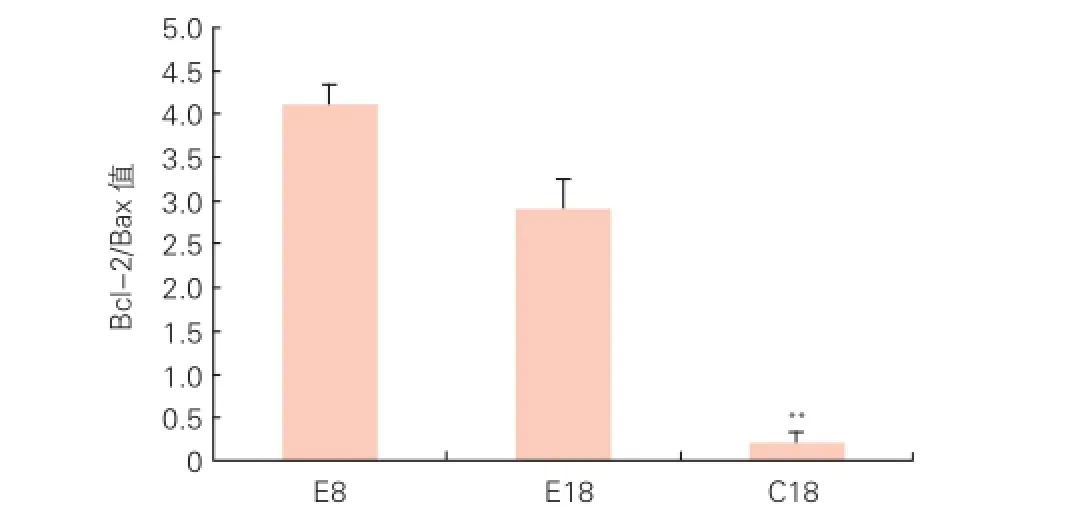
图3 丹参酮ⅡA对SHR 18 W时心肌组织Bcl-2/Bax值相对表达的影响
3 讨论
丹参酮ⅡA属于丹参酮类物质,从丹参中提取获得。大量研究表明丹参酮ⅡA具有血管舒张[8],抗动脉硬化[9],防止心律失常[10],抗炎症[11]等作用。临床研究则发现丹参酮ⅡA能改善患者的临床症状[12-14]。进一步研究表明丹参酮ⅡA能阻滞心肌细胞中L型钙离子通道,从而发挥钙离子通道抑制剂的功能[15,16]。另有研究报道丹参酮ⅡA能抑制心肌细胞中核转录因子-кB(nuclearfactor kappa B,NF-кB)蛋白表达[11]。Zhou等[17]发现丹参酮ⅡA能抑制心脏中血管紧张素Ⅱ的生成,阻止儿茶酚胺向交感神经中释放,从而降低α/β肾上腺素受体的含量,推测其可预防SHR左心室细胞过度肥厚的发生。本研究利用HE染色法发现丹参酮ⅡA处理组SHR左心室心肌细胞直径大小和表面积均显著低于溶剂对照组,说明丹参酮ⅡA具有抗SHR的左心室心肌肥厚功能。
已有研究报道细胞凋亡与左心室细胞过度肥厚密切相关[18]。Bcl-2蛋白是一种抗凋亡蛋白,其功能在于抑制细胞凋亡,而Bax蛋白是一种促凋亡蛋白,正常生理条件下促进细胞凋亡[19]。细胞是否发生凋亡取决于Bcl-2/Bax的比例,当Bcl-2蛋白表达量高于Bax蛋白时细胞凋亡被抑制,反之亦然[20]。p53基因是一种抑癌基因,在细胞凋亡过程中发挥着重要作用。研究表明,p53基因通过上调Bax蛋白和下调Bcl-2蛋白的表达进而使细胞发生凋亡[21,22]。本研究利用TUNEL法检测发现丹参酮ⅡA能够显著抑制SHR左心室心肌细胞的调亡,为进一步揭示其作用机制,我们检测了细胞凋亡相关的蛋白Bcl-2、Bax和p53在SHR经丹参酮ⅡA作用后
左心室组织中的表达变化。结果显示,溶剂对照组发生明显的细胞肥厚,与空白对照组(8 W)和丹参酮ⅡA处理组(18 W)比较有统计学差异(P<0.05)。与空白对照组相比,溶剂对照组(18 W)大鼠在左心室细胞过度肥厚的同时,左心室组织中Bax和p53蛋白表达也显著增加,而抗凋亡Bcl-2表达水平显著降低,同时Bcl-2/Bax值也随之显著降低,差异有统计学意义(P<0.05)。当给予丹参酮ⅡA后Bcl-2蛋白表达明显增加,而Bax和p53蛋白表达则被抑制,Bcl-2/Bax值水平随之上升。本研究结果还发现丹参酮ⅡA处理组(18 W)和溶剂对照组(18 W)SHR的收缩压无明显差异,提示丹参酮ⅡA预防大鼠发生左心室细胞肥厚不是通过降低血压或改善心脏后负荷而实现。我们猜测SHR发生左心室细胞肥厚与细胞凋亡密切相关,研究结果提示丹参酮ⅡA通过抑制细胞凋亡过程最终抑制左心室细胞肥厚的发生。然而,细胞凋亡导致SHR左心室肥厚详细的分子机制仍需要进一步研究。
本研究以SHR为研究模型,发现丹参酮ⅡA能抑制大鼠左心室细胞肥厚和细胞凋亡过程,其可能的分子机制在于丹参酮ⅡA通过上调Bcl-2蛋白的表达和下调Bax和p53蛋白的表达而实现。
[1] 樊朝美, 许莉, 杨宏, 等. 阿罗洛尔对扩张型心肌病患者左心室功能的影响. 中国循环杂志, 2009, 23: 117-119.
[2] Sundström J, Lind L, Ärnlöv J, et al. Echocardiographic and electrocardiographic diagnoses of left ventricular hypertrophy predict mortality independently of each other in a population of elderly men . Circulation, 2001, 103: 2346-2351.
[3] 章友华, 徐守春. 心脏肾素—血管紧张素系统与心肌肥厚, 心肌缺血再灌注损伤 . 中国循环杂志, 1992, 7: 598-600.
[4] Liu L, Yin Y, Guo G, et al. P725Anti-inflammatory effect of tanshinone IIA on oxidative-injured vascular endothelial cells is mediated by estrogen receptor activation and through ERK signaling pathway . Cardiovasc Res, 2014, 103: S132.
[5] 龚丽娅, 郑智, 熊玮, 等. 丹参预防自发性高血压大鼠左心室肥厚.高血压杂志, 2003, 11: 257-259.
[6] Yang L, Zou X, Liang Q, et al. Sodium tanshinone IIA sulfonate depresses angiotensin II-induced cardiomyocyte hypertrophy through MEK/ERK pathway. Exp Mol Med, 2007, 39: 65-73.
[7] 张海燕, 李强. 心肌梗死后心室重构病理过程的研究进展. 实用老年医学, 2012, 26: 251-253.
[8] Wang P, Wu X, Bao Y, et al. Tanshinone IIA prevents cardiac remodeling through attenuating NAD(P)H oxidase-derived reactive oxygen species production in hypertensive rats. Pharmazie, 2011, 66: 517-524.
[9] Tang FT, Cao Y, Wang TQ, et al. Tanshinone IIA attenuates atherosclerosis in ApoE(-/-) mice through down-regulation of scavenger receptor expression. Eur J Pharmacol, 2011, 650: 275-284.
[10] Shan H, Li X, Pan Z, et al. Tanshinone IIA protects against sudden cardiac death induced by lethal arrhythmias via repression of microRNA-1. Brit J Pharmacol, 2009, 158: 49-50.
[11] Jang SI, Kim HJ, Kim Y, et al. Tanshinone IIA inhibits LPS-induced NF-κB activation in RAW 264. 7 cells: Possible involvement of the NIK-IKK, ERK1/2, p38 and JNK pathways. Eur J Pharmacol, 2006, 542: 1-7.
[12] Bishopric NH, Andreka P, Slepak T, et al. Molecular mechanisms of apoptosis in the cardiac myocyt . Curr Opin Pharmacol, 2001, 1: 141-150.
[13] 罗富良, 孙嘉康, 唐跃, 等. 缺血后适应对大鼠移植心脏心肌细胞凋亡的影响. 中国循环杂志, 2013, 27: 470-472.
[14] Goga LM, Vasiliu OM, Ionescu CR. Molecular mechanisms of apoptosis. Fas and TNF systems. ICE protease system. Bcl-2 family. Rev Med Chir Soc Med Nat Iasi, 2001, 105: 23-29.
[15] Jiang FL, Leo S, Wang XG, et al. Effect of tanshinone IIA on cardiomyocyte hypertrophy and apoptosis in spontaneously hypertensive rats. Exp Ther Med, 2013, 6: 1517-1521.
[16] Sun L P, Zheng Z. Effect of Salvia miltiorrhiza Bge on left ventricular hypertrophy and the expression of tumor necrosis factor-alpha in spontaneously hypertensive rats. J Huazhong Univ Sci Technolog Med Sci, 2007, 27: 245-247.
[17] Zhou DX, Liang QS, He XX, et al. Changes of c-fos and c-jun mRNA expression in angiotensin II-induced cardiomyocyte hypertrophy and effects of sodium tanshinone IIA sulfonate . J Huazhong Univ Sci Technolog Med Sci, 2008, 28: 531-534.
[18] Lu F, Xing J, Zhang X, et al. Exogenous hydrogen sulfide prevents cardiomyocyte apoptosis from cardiac hypertrophy induced by isoproterenol . Mol Cell Biochem, 2013, 381: 41-50.
[19] 董丽君, 汤宝鹏, 周贤惠, 等. 心房肌基质金属蛋白酶及其抑制剂,凋亡相关基因表达改变与增龄性心房颤动关系的研究. 中国循环杂志, 2014, 29: 1034-1038.
[20] Jiang H, Yu P, Qian D H, et al. Hydrogen-rich medium suppresses the generation of reactive oxygen species, elevates the Bcl-2/Bax ratio and inhibits advanced glycation end product-induced apoptosis . Int J Mol Med, 2013, 31: 1381-1387.
[21] Haines CD, Harvey PA, Luczak ED, et al. Estrogenic compounds are not always cardioprotective and can be lethal in males with genetic heart disease . Endocrinology, 2012, 153: 4470-4479.
[22] Sheng R, Gu ZL, Xie ML. Epigallocatechin gallate, the major component of polyphenols in green tea, inhibits telomere attrition mediated cardiomyocyte apoptosis in cardiac hypertrophy . Int J Cardiol, 2013, 162: 199-209.
Effect of Tanshinone IIA on Left Ventricular Hypertrophy and Cardiomyocyte Apoptosis in Spontaneous Hypertensive Rats
WANG Shi-cai, CHEN Tai-jun, HUANG Mei-song, ZHU Shao-ming.
Department of Internal Medicine, Shiyan Hospital of Integrated Traditional and Western Medicine, Shiyan (442000), Hubei, China
Objective: To investigate the effect of tanshinone IIA (TSN) on left ventricular hypertrophy (LVH) and cardiomyocyte apoptosis in spontaneous hypertensive rats (SHRs).
Tanshinone IIA; Spontaneous hypertensive rats; Myocardial hypertrophy; Apoptosis
2014-10-12)
(编辑:梅 平)
442000 湖北省,十堰市中西医结合医院 内科
王诗才 副主任医师 学士 研究方向为冠心病基础与临床研究 Email:syzxywsc@163.com 通讯作者:朱少铭 Email:zhusaoming@163.com
R541
A
1000-3614(2015)07-0694-05
10.3969/j.issn.1000-3614.2015.07.019

