PEBP1在大鼠脊髓损伤后的表达和意义
钟占琼 马鹏云 曾 茜 张 婷 杨 拯 王廷华 张 晓△
1(成都医学院 基础医学院机能实验中心,成都610500)
2(四川大学 基础医学与法医学院 神经疾病研究室,成都610041)
3(昆明医科大学 神经科学研究所,昆明650504)
脊髓损伤(spinal cord injury,SCI)是一种致残率高的脊柱脊髓疾患,严重威胁到人类健康、影响人们的生活及就业情况。SCI所引起的并发症也是临床治疗上的一大难点,往往会出现炎症,细胞凋亡,感觉和运动功能降低或消失等一系列的变化。因此,脊髓损伤后,减少并发症可能会成为治疗脊髓损伤的关键步骤之一。
磷脂酰乙醇胺结合蛋白1(PEBP1)是一种广泛表达的具有高度保守的特殊调控因子。PEBP蛋白家族已经被发现20多年。PEBP家族共有4个亚类,包括PEBP1-4。其中,PEBP1又称RKIP,在人体的心、肺、脑、肝和睾丸等组织中的胞质与胞膜中表达。PEBP家族参与多种信号传导途径的调节。PEBP1 是 Raf-1/MEK/ERK,IKK/IKB/NF-kB,GRK-2信号通路中的关键因子,PEBP1通过选择性地调节c-Raf-1而不是通过调节b-raf,激活MAPK信号分子对于生长因子的反应,在生长和发育中发挥重要作用。另外,PEBP1是癌转移中的抑癌基因,PEBP1也参与神经系统的发育、胞膜的生成及精子的发生等生理过程有关,在生长、增殖、分化、凋亡、肿瘤发生和癌症转移中具有重要作用。然而,PEBP1在正常大鼠脊髓中表达还不清楚,并且,在脊髓损伤之后的表达也未见报道。本实验研究PEBP1在正常脊髓组织中的定位表达和在脊髓损伤后的表达变化,探讨可能的作用机制。因此,研究PEBP1在脊髓损伤后的变化情况,可以为脊髓损伤后的分子治疗和基因治疗提供新的靶点,具有重要的临床意义。
1 材料及方法
1.1 实验动物
健康成年Sprague-Dawley大鼠105只(由成都达硕公司提供),雌性,体重(210±20)g,单笼饲养,环境温度为20℃~28℃。实验动物随机分为假手术组(sham)和实验组,其中实验组包含6个亚组,动物术后分别允许存活12h、1d、3d、7d、14d和28d,每组15只。
1.2 动物模型制备
动物采用3.6%水合氯醛腹腔麻醉。俯卧位固定,背部剃毛,碘伏常规消毒。体表定位,然后于T10处纵行切开皮肤及皮下组织。剥离椎旁肌肉,暴露棘突和椎板,随后咬除T10棘突及其椎板,暴露脊髓。用改良的Allen’s法损伤动物。即10g金属棒在30mm处下落,砸伤脊髓,造成脊髓钝损伤模型。假手术组只剥离椎板,暴露脊髓但不损伤脊髓。术毕,逐层缝合伤口,持续3天给予大鼠注射青霉素(80 000IU/kg·d)。术后大鼠正常进食、饮水,独笼饲养。每日两次挤压膀胱协助大鼠排尿,直至大鼠恢复自主排尿。
1.3 组织获取
大鼠分别在对应的存活时间点进行取材。动物用3.6%水合氯醛腹腔注射麻醉,仰卧固定,暴露胸腔,通过心脏灌注生理盐水和4%多聚甲醛。充分暴露脊髓,取出整个脊髓损伤段,并放于4%多聚甲醛中后固定,用于后期的免疫组织化学分析。而用于实时定量PCR反应和免疫印迹反应的脊髓损伤段标本在心脏灌注生理盐水后立即取材并存放于-80℃冰箱。
1.4 免疫组织化学
将后固定的假手术组和实验组动物脊髓标本进行组织脱水后,用石蜡包埋,制备石蜡切片(5μm)。烤片2h后,脱蜡,用梯度酒精水化,高压修复5 min,自然冷却。采用SP法,进行免疫组化染色。根据试剂盒(中杉金桥)进行一下操作。即用3%过氧化氢封闭15min,PBS液洗后用5%羊血清37℃条件下孵育15min。滴加一抗PEBP1(1∶200,Rb,博士德),4℃条件下孵育过夜。加辣根过氧化酶偶联的羊抗兔IgG二抗于37℃条件下孵育30min后用DAB显色。常规脱水,透明,封片。阴性对照用PBS代替一抗,其余步骤不变。
染色切片在光学显微镜(Motic)下观察免疫阳性反应的分布,图像用Image pro-plus计算免疫阳性细胞数。
1.5 免疫印迹反应
为了检测PEBP1蛋白表达变化,本研究采用免疫印迹法检测。取假手术组和实验组动物脊髓损伤段组织,粉碎后加入适量RIPA裂解液冰上裂解和匀浆,并采用超声进行粉粹。离心后取上清液,根据试剂盒(碧云天公司)测定总蛋白浓度。各组取等量蛋白上样,进行SDS-PAGE电泳,电转移到PVDF膜上,5%脱脂牛奶室温下封闭后,用一抗PEBP1(1∶300,Rb,博士德)和beta-actin(1∶6000,Mouse,proteintech)于4℃冰箱中过夜孵育。洗膜后加HRP偶联羊抗兔IgG(1∶50 000,中杉金桥)和羊抗小鼠IgG(1∶20 000,proteintech)二抗室温下孵育2 h。然后根据试剂盒(凯基)采用ECL发光法。用胶片进行曝光,图像用图像分析软件(Quantity One)进行灰度值测定。
1.6 实时定量PCR反应
为了检测脊髓损伤后PEBP1mRNA的表达变化,本研究采用聚合酶链式反应。取假手术组和实验组动物的脊髓损伤段组织,加入TRIzol裂解液体试剂并于冰上匀浆,提取总RNA。根据试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)说明书逆转录为cDNA。
配置含有2×PCR Mix,上游引物,下游引物,探针,PCR water nucle-free,cDNA 模板的反应体系,并于 Real-time PCR system(BIO RAD 7300)在95℃,2min预变性;95℃,15s;53℃,20s;60℃,40 s,45个循环的条件下测试。所采用的引物由上海生工公司合成,基因序列如下,PEBP1Forwad primer sequence:5′-ATGCTCCCAGCAGGAAGGA-3′,backwad primer sequence:5′-GACAGTGCCACTGCTAAT-3′;beta-actin Forwad primer sequence:5′-GAAGATCAAGATCATTGCTCCT-3′, backwad primer sequence:5′-ACAGTGCCACTGCTAAT-3′。
1.7 统计学分析
SPSS 18.0用于数据处理。实验结果表示为均数±标准误。采用单因素方差分析方法(ANOVA)用于比较各组之间的差异性,采用<0.05表示数据间存在显著性差异。
2 结果
2.1 PEBP1在脊髓中的分布和表达变化
运用免疫组织化学的方法检测PEBP1在脊髓中的定位表达。实验结果显示PEBP1在脊髓后角的胶质细胞的胞浆中有阳性表达,也有少量定位于细胞核内。免疫阳性细胞数结果显示脊髓损伤后PEBP1的表达在12h(<0.001),1d(=0.025),3d(<0.001),7d(=0.001),14d(=0.006)和28d(=0.001)降低,有统计学意义(见图1)。
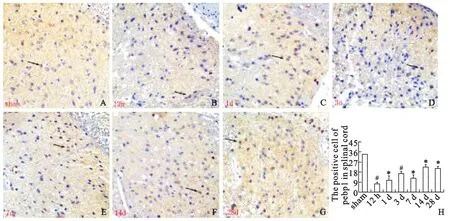
图1 PEBP1在脊髓后角的定位表达Fig.1 The locoation of PEBP1in posterior horn of spinal cord
2.3 脊髓损伤后PEBP1蛋白的表达变化
为了进一步研究PEBP1的作用,采用免疫印迹实验检测脊髓损伤后PEBP1蛋白的表达变化。结果显示,与假手术组术组比较,在大鼠脊髓损伤后7d(=0.025),14d(=0.035)和28d(=0.023)PEBP1蛋白的表达量降低,且具有统计学意义(见图2)。
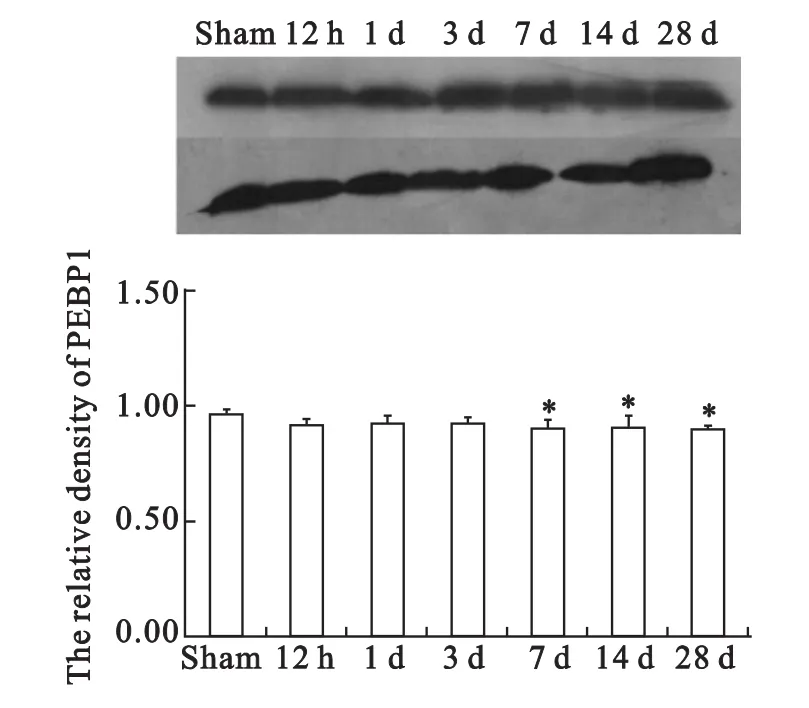
图2 PEBP1蛋白脊髓损伤中表达Fig.2 The level of PEBP1protein in rats with spinal cord injury
2.4 脊髓损伤后PEBP1mRNA的表达变化
为了进一步检测脊髓损伤后PEBP1mRNA的表达变化,我们采用的聚合酶链式反应。如图1结果显示,与假手术组(sham)比较,大鼠脊髓损伤后PEBP1mRNA表达量在12h(<0.001),1d(<0.001),3d(<0.001),7d(<0.001),14d(<0.001)和28d(<0.001)明显降低,具有统计学意义(见图3)。

图3 PEBP1mRNA在脊髓损伤中表达Fig.3 The relative expression of PEBP1mRNA in spinal cord after injury
3 讨论
PEBP1作为磷脂酰乙醇胺结合蛋白家族(PEBP)的成员之一,参与细胞的生长、增殖、分化、凋亡、神经系统的发育以及肿瘤相关等生理过程。然而,PEBP1在正常脊髓中的定位表达和在脊髓损伤后的表达变化还未见报道。本研究通过大鼠脊髓损伤模型,采用免疫组织化学的方法进行定位研究,运用聚合酶链式反应和免疫印迹法检测PEBP1 mRNA和蛋白的表达变化。
3.1 PEBP1在脊髓中的分布
本实验通过免疫组织化学方法检测到PEBP1在正常脊髓后角的神经胶质细胞胞浆和胞核表达,在脊髓损伤后PEBP1免疫阳性细胞数在12h,1d,3d,7d,14d和28d降低。因此,我们推测PEBP1在脊髓损伤后的表达降低可能与脊髓损伤后感觉功能的恢复有关,这可能因为PEBP1参与脊髓损伤后神经胶质细胞的存活和凋亡有关。Burgula等将大鼠置于模拟海拔高度中5d,检测大脑组织中PEBP1蛋白表达降低,推测PEBP1可能与痴呆症和缺氧有关。George等通过基因表达系列分析在阿尔兹海默病小鼠模型中基因的表达变化,发现PEBP1在阿尔兹海默症的大脑组织中表达减少,提示PEBP1可能作为阿尔兹海默症的标志物。在给大鼠服用冰毒后,发现位于突触的PEBP1表达降低,说明PEBP1参与药物成瘾行为,因此,其可能会作为潜在的治疗药物成瘾行为的靶点。结合本实验研究,我们的结果显示PEBP1在脊髓中有表达,在脊髓损伤后的表达降低,这与以前研究显示在人类疾病中PEBP1的表达降低一致。PEBP1在正常脊髓后角的神经胶质细胞表达,提示PEBP1在脊髓中对于维持正常的生理功能有重要作用。在脊髓损伤后,PEBP1的免疫阳性细胞减少可能与脊髓损伤后神经胶质细胞的凋亡坏死有关,这提示PEBP1可能影响脊髓损伤后感觉功能。
3.2 PEBP1mRNA和蛋白在脊髓损伤之后的表达变化
为了进一步研究PEBP1在脊髓中作用,采用实时定量PCR和免疫印迹实验检测PEBP1在脊髓损伤后的蛋白和基因的表达变化。实验结果显示PEBP1蛋白在大鼠脊髓损伤后7d,14d和28d下降,此外,PEBP1mRNA的表达水平在脊髓损伤后12h,1d,3d,7d,14d和28d降低。结果提示PEBP1在脊髓损伤后参与调节神经胶质细胞的存活和凋亡,从而影响大鼠脊髓损伤后感觉功能的恢复。
PEBP1影响细胞的分化,细胞存活以及细胞迁移等重要生理过程。Sagisaka等通过体外培养大鼠海马细胞,实验结果显示PEBP1与海马祖细胞向神经元和少突胶质细胞的分化有关,提示PEBP1在海马祖细胞分化为特定细胞系的过程中可能作为关键的调节因子。Zeng等的实验结果显示PEBP1的表达与转移性肿瘤发生,它主要参与肿瘤细胞的转移,存活和迁移。另外,PEBP的在黑色素瘤中表达降低,在体内黑色素瘤中缺失PEBP会增加细胞的侵袭性。当上调PEBP在的结肠癌细胞中表达可以抑制细胞的侵袭和转移。此外,众多研究显示PEBP通过参与MAPK、G蛋白偶联受体、GSK3β和NF-κB等信号通路发挥重要的调控作用。
结合本研究,实验结果显示在脊髓损伤后PEBP1的蛋白和基因均下降,这与以往的关于PEBP1在肿瘤和神经系统退行性疾病中的作用一致,因此,我们推测PEBP1减少会影响脊髓的正常生理动能,从而影响脊髓损伤后的感觉功能。PEBP1通过激活 MAPKG,GSK3β和 NF-κB等信号通路影响神经胶质细胞的存活和凋亡,从而影响感觉功能的恢复。综上所述,在脊髓损伤后,PEBP1在脊髓后角的神经胶质细胞胞浆和胞核表达,同时PEBP1的蛋白和基因的水平下调,提示PEBP1参与调节神经胶质细胞的存活和凋亡,影响大鼠脊髓损伤后感觉功能的恢复。这种作用可能与MAPK,GSK3β和NF-κB信号通路有关。
[1] Hwang M,Zebracki K ,Vogel LC.Occupational characteristics of adults with pediatric-onset spinal cord injury[J].Top Spinal Cord Inj Rehabil,2015,21:10-19.
[2] Ragnarsson KT.Functional electrical stimulation after spinal cord injury:current use,therapeutic effects and future directions[J].Spinal Cord,2008,46:255-274.
[3] Hurlbert RJ.Strategies of medical intervention in the management of acute spinal cord injury[J].Spine(Phila Pa 1976),2006,31:S16-21.
[4] Trakul N,MR Rosner.Modulation of the MAP kinase signaling cascade by Raf kinase inhibitory protein[J].Cell Res,2005,15:19-23.
[5] Yeung K,Seitz T,Li S,et al.Suppression of Raf-1kinase activity and MAP kinase signalling by RKIP[J].Nature,1999,401,1:73-77.
[6] Karlgren A,N Gyllenstrand,T Kallman,et al.Evolution of the PEBP gene family in plants:functional diversification in seed plant evolution[J].Plant Physiol,2011,156:1967-1977.
[7] Maas C,CF Poets.Initial treatment and early weight gain of children with Robin Sequence in Germany:aprospective epidemiological study [J].Arch Dis Child Fetal Neonatal Ed,2014,99:F491-494.
[8] Houben,RS Ortmann and JC Becker.RKIP does not contribute to MAP kinase pathway silencing in the Merkel Cell Carcinoma cell line UISO [J].J Carcinog,2007,6:16.
[9] Keller ET,Fu Z,Brennan M.The biology of a prostate cancer metastasis suppressor protein:Raf kinase inhibitor protein[J].J Cell Biochem,2005,94:273-278
[10] Yeung KC,Rose DW,Dhillon AS,et al.Raf kinase inhibitor protein interacts with NF-kappaB-inducing kinase and TAK1 and inhibits NF-kappaB activation[J].Mol Cell Biol,2001,21:7207-7217.
[11] Trakul N,Menard RE,Schade GR,et al.Raf kinase inhibitory protein regulates Raf-1but not B-Raf kinase activation[J].J Biol Chem,2005,280:24931-24940.
[12] Minoo P,Zlobec I,Baker K,et al.Loss of raf-1kinase inhibitor protein expression is associated with tumor progression and metastasis in colorectal cancer[J].Am J Clin Pathol,2007,127:820-827.
[13] Lin K,Baritaki S,Militello L,et al.The Role of B-RAF Mutations in Melanoma and the Induction of EMT via Dysregulation of the NF-kappaB/Snail/RKIP/PTEN Circuit[J].Genes Cancer,2010,1:409-420.
[14] Xu YF,Yi,Y Qiu SJ,et al.PEBP1downregulation is associated to poor prognosis in HCC related to hepatitis B infection[J].J Hepatol,2010,53:872-879.
[15] Burgula S,Medisetty R,Jammulamadaka N,et al.Downregulation of PEBP1in rat brain cortex in hypoxia[J].J Mol Neurosci,2010,41:36-47.
[16] George AJ,Gordon L,Beissbarth T,et al.A serial analysis of gene expression profile of the Alzheimer’s disease Tg2576 mouse model[J].Neurotox Res,2010,17:360-379.
[17] Charntikov S,Pittenger ST,Thapa I,et al.Ibudilast reverses the decrease in the synaptic signaling protein phosphatidylethanolamine-binding protein 1 (PEBP1)produced by chronic methamphetamine intake in rats[J].Drug Alcohol Depend,2015,152:15-23.
[18] Zeng L,Imamoto A,Rosner MR.Raf kinase inhibitory protein(RKIP):aphysiological regulator and future therapeutic target[J].Expert Opin Ther Targets,2008,12:1275-1287.
[19] Granovsky AE,Rosner MR.Raf kinase inhibitory protein:a signal transduction modulator and metastasis suppressor[J].Cell Res,2008,18:452-457.
[20] Sagisaka T,Matsukawa N,Toyoda T,et al.Directed neural lineage differentiation of adult hippocampal progenitor cells via modulation of hippocampal cholinergic neurostimulating peptide precursor expression[J].Brain Res,2010,1327:107-117.
[21] Caltabiano R,Puzzo L,Barresi V,et al.Expression of Raf Kinase Inhibitor Protein(RKIP)is a predictor of uveal melanoma metastasis [J].Histol Histopathol,2014,29:1325-1334.
[22] Sun M,Gomes S,Chen P,et al.RKIP and HMGA2regulate breast tumor survival and metastasis through lysyl oxidase and syndecan-2[J].Oncogene,2014,33:3528-3537.
[23] Chen Z,Cheng Q,Ma Z,et al.Overexpression of RKIP inhibits cell invasion in glioma cell lines through upregulation of miR-98[J].Biomed Res Int,2013,2013:695179.
[24] Schuierer MM,Bataille F,Hagan S,et al.Reduction in Raf kinase inhibitor protein expression is associated with increased Ras-extracellular signal-regulated kinase signaling in melanoma cell lines[J].Cancer Res,2004,64:5186-5192.
[25] Nie F,Cao J,Tong J,et al.Role of Raf-kinase inhibitor protein in colorectal cancer and its regulation by hydroxycamptothecine[J].J Biomed Sci,2015,22:56.
[26] Lorenz K,Lohse MJ,Quitterer U.Protein kinase C switches the Raf kinase inhibitor from Raf-1to GRK-2[J].Nature,2003,426:574-579.
[27] Al-Mulla F,Bitar MS,Al-Maghrebi M,et al.Raf kinase inhibitor protein RKIP enhances signaling by glycogen synthase kinase-3beta[J].Cancer Res,2011,71:1334-1343.
[28] Keller ET,Fu Z and Brennan M.The role of Raf kinase inhibitor protein(RKIP)in health and disease[J].Biochem Pharmacol,2004,68:1049-1053.
[29] Klysik J,Theroux SJ,Sedivy JM,et al.Signaling crossroads:the function of Raf kinase inhibitory protein in cancer,the central nervous system and reproduction [J].Cell Signal,2008,20:1-9.