冷刺激对乳鼠心肌细胞缝隙连接蛋白43的影响及药物干预的研究
黄强辉,洪葵,程晓曙,胡建新
冷刺激对乳鼠心肌细胞缝隙连接蛋白43的影响及药物干预的研究
黄强辉,洪葵,程晓曙,胡建新
目的: 在急性冷刺激乳鼠心肌细胞模型下,评价缝隙连接蛋白43(Connexin43,Cx43)的表达及研究急性冷刺激时乳鼠心肌细胞间传导的变化及其机制。
方法: 乳鼠心肌细胞原代培养,随机分为正常对照组,实验4℃组;实验0℃组;并在实验4℃组和实验0℃组分别加入100 nmol/L 抗心律失常肽(APP)10,每组乳鼠8只。采用流式细胞术(FCM)分析各组细胞的凋亡率,应用聚合酶链反应(PCR)和蛋白免疫印迹法(Western blot)检测Cx43及其磷酸化水平在基因和蛋白上的表达。
结果: FCM结果显示:实验4℃组和实验0℃组随着冷刺激程度加强和低温时间的延长,心肌细胞的凋亡率增加;同时PCR结果显示:实验4℃组和实验0℃组Cx43 mRNA呈现不同程度的下降;Western blot结果显示:实验4℃组和实验0℃组随着刺激强度和低温时间的延长,Cx43蛋白表达亦出现不同程度的下降;磷酸化的Cx43(P-Cx43)蛋白表达亦下降,而AAP10干预后可提高两组Cx43和P-Cx43蛋白的表达。
结论: 心肌细胞在急性冷刺激时Cx43在基因和蛋白水平上表达均有不同程度的下降,P-Cx43表达亦下降,而AAP10能提高Cx43和P-Cx43蛋白的表达从而改善细胞间的传导。
冷刺激;心肌细胞;缝隙连接蛋白43; 磷酸化;抗心律失常肽
Methods: The primary neonatal rats’ myocardial cell culture was conducted in 4 groups. Group①, the cells were normally cultured, Group②, the cells were cultured at 4℃, Group③, the cells were cultured at 0℃ and Group④, the antiarrhythmia peptide (AAP 10) was added in Group② and Group③. The apoptosis rate of myocardial cells was evaluated by flow cytometry assay, mRNA and protein expressions of CX43 were examined by RT-PCR and Western blot analysis, and CX43 phosphorylation product (P-CX43) was detected.
Results: Compared with normally cultured cells, the myocardial cell apoptosis rate was obviously increased by acute cold stress at 4℃and 0℃with time extension. The mRNA expression of Cx43 was decreased at varying degrees at 4℃and 0℃stimulation, the protein expression of Cx43 was decreased at varying degrees at 4℃and 0℃ stimulation with time extension, and P-Cx43 level was decreased. While the APP 10 intervention may obviously elevate the protein levels of Cx43 and P-Cx43.
Conclusion: Acute cold stress could reduce the protein expression of CX43 and P-CX43, while APP 10 intervention may elevate such expression and improve the cell to cell conduction in neonatal rats’ myocardial cells.
(Chinese Circulation Journal, 2015,30:59.)
随着人类对环保问题认识逐渐加深,气候多变成为当今世界的热门话题之一,而突如其来的天气变化如大雪和冰冻灾害等极端灾害天气对人类健康带来极大影响,使各种疾病的发病率急剧升高,尤其对心血管疾病的影响。寒冷刺激产生的应激现象对心血管系统的损伤受到广泛关注[1]。在急性冷应激时对心血管系统的影响机制尚不明确。有报道示冷应激反应可致体内儿茶酚胺物质分泌增加,血压升高,心率加快,心肌缺血等并由此引发的一系列病理生理改变[2],而在许多心脏疾患中,缝隙连接蛋白的分布和功能的改变均可能影响心脏正常的电传导[3]。在人类心肌组织中,心室肌主要以缝隙连接蛋白43(Connexin,Cx43)为主[4];同时缝隙连接亦受多种因素的调控,如pH值、游离钙离子浓度、神经体液因素、生长因子以及磷酸化状态等,其磷酸化状态的改变可影响通道的门控和缝隙连接蛋白的更新和转运,进而影响缝隙连接细胞间传导通讯功能[5]。
抗心律失常肽(AAP)10是一种小分子多肽,它能促进细胞间物质交换,增强心肌细胞间的电传导[6]。目前,国内外对急性冷应激下对Cx43影响的研究甚少,具体机制不清楚;本实验拟探讨寒冷刺激对Cx43的影响,为揭示冷应激对心血管疾病的影响奠定生物学机制基础。
1 材料与方法
动物与试剂:2011-08至2012-05采用刚出生1~3天的乳鼠若干只(由南昌大学医学院动物房及生理实验室提供),雌雄不限。AAP10(Gly-Aia-Gly-4Hyp-Pro-Tyr-CONH2)杭州中肽生化有限公司。使用的试剂包括:磷酸缓冲盐溶液(PBS)(主要成分:Na2HPO4、KH2PO4、NaCl和KCl ),DMEM高糖培养基和胰蛋白酶;胶原酶Ⅱ和胎牛血清(北京绿源博得生物科技公司),逆转录酶试剂盒(厦门慧嘉生物科技有限公司),凋亡试剂盒(深圳纽邦生物);连接蛋白43多克隆抗体(美国ADI公司)、小鼠抗β-actin单克隆抗体(美国Chemicon公司);辣根过氧化物酶羊抗小鼠IgG抗体及小鼠抗磷酸化的Cx43(P-Cx43)单克隆抗体(美国SantaCruz公司)等。
心肌细胞原代培养及冷应激模型的建立:①乳鼠心肌细胞原代培养:在消毒好的超净台上,将乳鼠(刚出生1~3天)第3、4肋间剪开皮肤逐层,取出完整心脏,放入装有PBS的培养皿中,分离筋膜和脂肪组织,洗净血渍。然后将心脏组织剪碎成1 mm×1 mm×1 mm的小块碎片。向其中加入5 ml 0.08%胰蛋白酶,吹打后用移液管把液体移入锥形瓶中,置37℃水浴箱中,摇动消化5~6 min,取出锥形瓶,吸弃上清液,此步骤重复3次后观察心肌组织较粘稠,再往锥形瓶中加入9 ml无血清DMEM+1ml胶原酶Ⅱ放入CO2孵箱中孵育,每隔20 min摇动1次,视消化情况时间一般为1~3 h。再将消化好的锥形瓶内液体取出后加入与之等体积的15%胎牛血清DMEM10 ml,将上述20 ml液体分装成4个离心管中,每个5 ml进行离心,1000 r/min,每次5 min。离心后,吸弃上清液,加入5 ml培养基,再离心,重复2次。离心好后,弃上清,先加入5 ml培养基吹打混匀数十次,再加5 ml培养基至10 ml,取出滤器将4个离心管中的液体滤出至一个大的培养皿中,放置CO2孵箱中进行贴壁2 h。最后取出,在显微镜下对心肌细胞计数,并接种于培养板或培养瓶中培养。每天显微镜下观察并换液。培养至第4~5天时,可见细胞呈簇状生长,聚集成群,细胞活跃且搏动有力。②实验分组及冷应激模型的建立:将培养的心肌细胞随机分成3个组:正常对照组(常规培养),实验4℃组(冷刺激时间为4℃1 h、3 h和6 h)、实验0℃组(冷刺激时间为0℃10min、30 min和60 min),每组8只。冷应激模型的建立:选培养至5~6 d的心肌细胞,用含-25℃、95%乙醇的恒温低温浴槽分别将细胞冻至4℃1h、3h和6h;0℃10min、30 min和60min,然后立即于37℃水浴复温至接近37℃,置培养箱内,继续培养6h,建立冷应激模型[6]。
细胞凋亡率的测定:将正常对照组及实验4℃组和实验0℃组的心肌细胞分别用0.25%胰蛋白酶消化,显微镜下观察消化情况,待消化好后加入DEME血清中和并吹打数次,然后以2000 r/min离心10 min,弃上清,加PBS吹打混匀,离心3次。最后加Binding buffer吹打沉淀细胞,移入5 ml离心管中,分别加Annexin V-FITC和Propidium Iodide(PI)5 µl混匀后置4℃避光30min,用流式细胞术(FCM)检测,在激发光波长488 nm,检测发射光波长540 nm处红色荧光,计数10 000个细胞。
聚合酶链反应(PCR)检测Cx43 mRNA的表达:提取RNA:在消毒好的超净台上操作,上述各组细胞分别加入Trizo 1ml,转入EP管中,室温放置5 min后,4℃ 12 000 r/min,离心5 min,弃沉淀;
再加入200 μl氯仿,震荡混匀,室温放置15 min后,4℃ 12 000 r/min 离心15 min吸取上层水相至另一EP管中,加入0.5 ml异丙醇混匀,室温放置110 min后,再次离心10 min,弃上清,RNA沉于管底。加入1 ml 75%乙醇,温和振荡离心管,悬浮沉淀,4℃ 7 500 r/min离心10 min,尽量弃上清,室温晾干10 min,20 μl焦碳酸二乙酯 (DEPC)水溶解RNA样品,定量RNA浓度,取5 μl RNA样品+逆转录酶+Cx43 mRNA引物(5’-GCTGGTGGTGTCCTTGGT-3’,5’-TTGGCATTCTGGTTGTCG-3’)或内参3-磷酸甘油醛脱氢酶(GAPDH)组成25 μl体系, 进行逆转录扩增合成cDNA,反应退火温度52℃,并制胶跑电泳,最后在凝胶成像下观察。
蛋白免疫印迹法(Western blot)检测Cx43和P-Cx43蛋白表达:各组细胞经上述干预后,经消化、离心后收集细胞,加用RIPA裂解液1ml先裂解细胞,放置4℃、10 min后,再加入蛋白提取液0.5 ml均匀摇荡,放置4℃、3 min后,将各组细胞蛋白分别放置已沸腾的热水中煮5 min。制作10%的分离胶和5%的积层胶, 10 μl蛋白+5 μl缓冲液上样至每泳道,MARK 5 μ跑电泳,电泳结束后,将蛋白转移至硝酸纤维素膜 (NC)膜上,5%脱脂奶粉溶液封闭3次,每次约10 min,然后TBST [主要成分:8.8 g NaCl、20 ml Tric-Hcl(PH8.0)、0.5 ml Tween加入800 ml去离子水中摇匀]洗膜3次,每次10 min,洗毕后加入Cx43蛋白一抗(1:200)、抗P-Cx43蛋白(1:500)一抗和抗β-actin一抗(1:200)4℃封闭过夜,TBST溶液洗膜3次,每次10~15 min,室温下加相应二抗(1:5 000)孵育3 h,同前法洗膜3次,用增强化学发光法进行抗原抗体显色,X线曝光显影,凝胶成像分析系统成像分析,将正常对照组灰度值设为1,其它组灰度值为与正常对照组比较得出的数据,并以内参β-actin进行对比标化。
统计学处理:实验数据以均数±标准差表示,统计分析方法用多因素方差分析,采用SPSS 17.0软件分析,P<0.05为差异有统计学意义。
2 结果
三组心肌细胞的形态变化:原代心肌细胞种板4 h后,在倒置显微镜下可观察到心肌细胞开始贴壁生长,初细胞形态为圆形,后为梭形。第1天细胞可视心肌细胞伸出较短的伪足,偶尔可见有单个搏动的心肌细胞,搏动频率较慢,大约为20次/分,律齐;第2天部分伪足已有融合,搏动频率有所加强,但也较缓,第4天搏动频率明显,约为75次/分,律齐,并且可观察到细胞间已开始逐渐相互融合,呈片状群体性搏动,有规律。第5~6天乳鼠心肌细胞生长旺盛,活跃,每搏频率可达100次/分以上,律规整。心肌细胞在冷刺激时可视细胞逐渐分散,核裂解,搏动范围缩小及频率亦明显缓慢。图1

图1 正常对照组与实验4℃组(冷刺激时间3 h)细胞学形态镜下比较
心肌细胞凋亡率的结果:流氏细胞术检测实验4℃组和实验0℃组乳鼠心肌细胞凋亡率的结果表明[6次独立实验,(3~30)±(0.01~0.03)]:实验4℃组及实验0℃组低温条件下,随着温度的下降及低温时间延长,使心肌细胞的凋亡率增加,由(3.02±0.02)%和(6.74±0.01)%分别增加至(10.79±0.03)%和(28.52±0.03)%,与正常对照组(1.05±0.02)%相比,差异均有统计学意义(P<0.05)。图2

图2 不同温度实验组心肌细胞凋亡率的变化
聚合酶链反应(PCR)检测结果:加入100 nmol/L APP10处理前与加入100 nmol/L APP10 处理后,实验4℃组和实验0℃组Cx43 mRNA表达均较正常对照组均有不同程度的表达下降(P<0.01),差异均有统计学意义;
而实验4℃组和实验0℃组在加入100 nmol/L APP10处理后,两组Cx43 mRNA表达均较同组加入APP10处理前有所增加(P<0.01),差异均有统计学意义。表1、图3
Western blot检测结果: 加入APP10处理前与加入APP10处理后,实验4℃组和实验0℃组Cx43、 P-Cx43蛋白表达均较正常对照组有不同程度的下降(P均<0.01),差异均有统计学意义;而在实验4℃组和实验0℃组均加入APP10处理后,实验4℃组和实验0℃组Cx43、P-Cx43蛋白表达较同组加入APP10处理前有所增加(P<0.01),差异均有统计学意义。表2、图4
表1 三组APP 10处理前细胞Cx43 mRNA和APP10处理后Cx43 mRNA定量值

表1 三组APP 10处理前细胞Cx43 mRNA和APP10处理后Cx43 mRNA定量值
注:与正常对照组比*P<0.01;与同组加入APP10处理前比△P<0.01。Cx43:缝隙接连蛋白43 APP10:抗心律失常肽10
?
表2 三组Cx43、p-Cx43蛋白表达的变化

表2 三组Cx43、p-Cx43蛋白表达的变化
注:与正常对照组比*P<0.01;与同组加入APP10处理前比△P<0.01。余注见表1
?
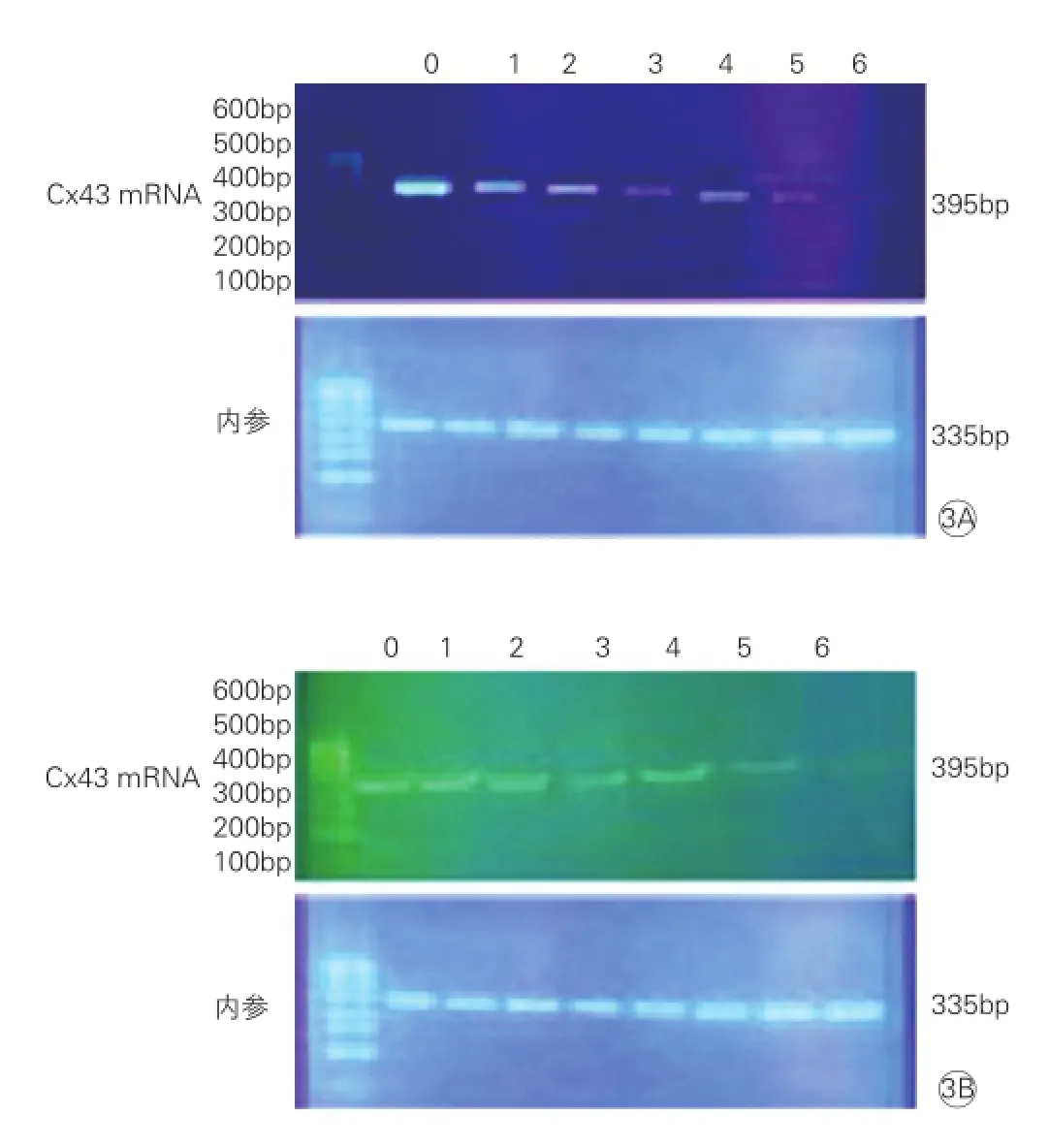
图3 逆转录-聚合酶链反应电泳图显示抗心律失常肽10干预对不同温度冷应激处理条件下乳鼠心肌细胞Cx43 mRNA水平的影响
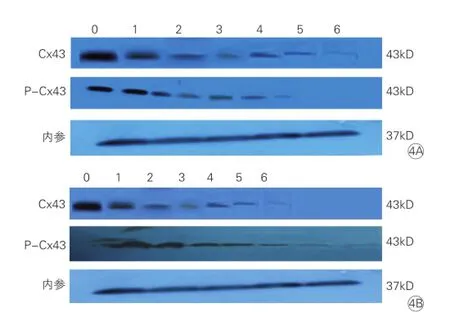
图4 三组APP10处理前后乳鼠心肌细胞Cx43及P-Cx43蛋白表达的变化
3 讨论
应激是机体应对生存环境中一种或多种不良甚至有害因素条件下所产生的全身非特异性反应,机体可表现为应对不同强度刺激下神经—内分泌系统增强,而作出的适应反应,主要以交感—肾上腺
髓质系统和下丘脑—垂体—肾上腺皮质轴(HPA)兴奋为主的内分泌反应,引起机体儿茶酚胺(如肾上腺素、去甲肾上腺素)物质和糖皮质激素的分泌增多;从而活化心肌细胞膜表面的受体,并通过多种细胞信号传导通路启动生化级联反应,介导细胞应激反应乃至应激损伤的发生。应激作为心血管疾病的重要诱因和病因已得到确认[7],有学者甚至认为心血管疾病是第一应激性疾病[8]。在寒冷刺激环境中,高强度的冷暴露使机体产生应激反应,导致机体生理功能紊乱,形成损伤及相关基因和蛋白的改变[9]。目前,关于寒冷刺激对Cx43影响的研究甚少。
本研究通过观察在不同强度及时间段给予心肌细胞急性冷刺激,发现在随着刺激强度的增加及时间的延长,心肌细胞的凋亡率逐渐增加;并观察到Cx43在基因及蛋白水平上的表达均有不同程度的降低,说明在急性极端条件下(冷刺激强度刺激时),易促发心肌细胞的损伤;而细胞偶联传导物质—Cx43在其机制中扮演着重要角色。在信号转导过程中,可通过磷酸化快速调节效应蛋白活性和通过调节基因表达的缓慢生物效应的两种主要作用方式传导。连接蛋白大多数都属于磷蛋白,它们处于不同的磷酸化水平;且磷酸化是蛋白转录后非常普遍的主要修饰之一;同时缝隙连接的功能受许多因素的影响。其中,在羧基末端的丝/苏氨酸及酪氨酸残基的磷酸化/去磷酸化水平中,它可因胞内的信号变化而改变蛋白的构象,从而对调节缝隙连接的传导性起着至关重要的作用。但也有研究正面报道[10],寒冷刺激可使棕色脂肪组织活性显著增加,参与了体外心肌自发分化能力,甚至加强心脏干细胞分化,从而有效的修复受损心肌,改善心脏功能等作用;因此仍有颇多争论。
AAP10是一种小分子多肽物质,它可以结合到一种膜蛋白受体,促进细胞间通讯和传导功能,产生抗心律失常的作用[11],但具体机制目前尚不清楚。本实验观察到在实验4℃组和实验0℃组加入100 nmol/L AAP10干预后,能使Cx43和P -Cx43的含量表达均有所提高,由此我们推测AAP10可能通过加强蛋白的磷酸化水平来改善细胞间的传导。这一结果与Weng等[12]所得的结果相一致。他们采用双探头膜片钳技术研究AAP10对成年豚鼠心肌细胞及转染了Cx43细胞的缝隙连接传导的影响,结果显示AAP10能促进这两种细胞间的电传导;并且通过使用PKC阻断剂BIM,PKCα亚型阻断剂CGP54345等,同时使用ELISA检测发现AAP10主要促进PKC介导的Cx43磷酸化作用来改善细胞间的传导;也有研究报道显示[13],缝隙连接蛋白阻滞剂—Heptanol可使Cx43表达增加,使缺血心肌与正常心肌电传导差异性减少,改善电重构,从而发挥预防缺血性室性心律失常的作用。
综上所述,极端气候条件下(急性冷应激刺激)对心肌细胞的凋亡或损伤具有显著影响,且能使细胞间通讯传导功能明显下降,使Cx43和P-Cx43表达均有下降;而AAP10改善细胞间的传导主要通过促进蛋白磷酸化水平而起作用。但至今为止,磷酸化对缝隙连接蛋白通道的调控,仍有许多问题有待进一步研究,可能涉及到许多复杂因素的参与,如缝隙连接不同的亚型、Cx43蛋白许多不同的磷酸化位点、不同的激酶和蛋白磷酸化的参与以及信号转导途径网的相互作用等等,且本实验未从动物整体研究,未涉及到复杂的信号转导机制网;因此关于磷酸化如何影响缝隙连接通道细胞间的传导,还有待今后进一步探索和研究。
[1] Revich BA, Shaposhnikov DA. Extreme temperature episodes and mortality in Yakutsk, East Siberia. Rural Remote Health, 10: 1338, 2010, 1-8.
[2] Israel A, Zavala LE, Cierco M, et al, Effect of AT1 angiotensin Ⅱreceptor antatonists on the sympathetic response to a cold pressor test in healthy volunteers. Am J Ther, 2007, 14: 183-188.
[3] Peters NS, Coromilas J, Severs NJ, et al. Disturbed connexin43 gap junction distribution correlates with the location of reentrant circuits in the epicardial border zone of healing canine infarcts that cause ventricular tachycardia. Circulation, 1997, 95: 988-996.
[4] Gros DB, Jongsma HJ. Connexins in mammalian heart function. Bioessays, 1996, 18: 719-730.
[5] Lampe PD, Lau AP. The effects of connexin phosphorylation on gap junctional communication. Int J Biochem Cell Biol, 2004, 36, 1171-1186.
[6] 李凤芝, 颜培华, 刘友梅, 等, 低温对培养的血管内皮细胞损伤作用的研究, 解放军医学杂志, 1994, 19: 98.
[7] Esch T, Stefano GB, Fricchione GL, et al. Stress-related diseases a potential role for nitric oxide. Med Sci Monit, 2002, 8: RA103-118.
[8] Dipak K Daz. Heart in stress. Annals of the New York Academy of Science. 1999, 874: 370-378.
[9] Tillinger A, Myslivecek J, Nováková M. Gene expression of adrenoceptors in the hearts of cold-acclimated rats exposed to a novel stressor. Ann NY Acad Sci, 2008, 48: 393-399.
[10] 杨俊杰, 刘志强, 王海滨, 等, 寒冷刺激诱导棕色脂肪组织中的心脏干细胞增多, 中国循环杂志, 2011, 10: 382-385.
[11] Rover R, Dhein S. Structure-activity relationships of novel peptides related to the antiarrhythmic peptide AAP10 which reduce the dispersion of epicardial action potential duration. Peptides, 2001, 22: 1011-1021.
[12] Weng S, Lauven M, Schaefer T, et al. Pharmacological modification of gap junction coupling by an antiarhythmic peptide via protein kinase C activation. FASEB J, 2002, 16: 1114-1116.
[13] 孙冰, 齐向强, 孙宝贵, 等, 缝隙连接阻滞剂预防缺血性室性心律失常及其机制的研究, 中国循环杂志, 2005, 8: 260-263.
Effect of Cold Stress on Connexin43 Protein Expression With Drug Intervention in Neonatal Rats’Myocardial Cells
HUANG Qiang-hui, HONG Kui, CHENG Xiao-shu, HU Jian-xin.
Department of Cardiology, The Second Affiliated Hospital of Nanchang University, Nanchang (330006), Jiangxi, China
Objective: To study the effects of acute cold stress on connexin43 (Cx43) protein expression with drug intervention, and cell to cell conduction with its mechanism in neonatal rats’ myocardial cells.
Cold stress; Myocardial cells; Connexin43; Phosporylation; Anti-arrhythmia peptide
2014-04-10)
(编辑: 汪碧蓉)
330006 江西省南昌市,南昌大学第二附属医院 心内科
黄强辉 住院医师 硕士 主要从事心血管病研究 Email:277066217@qq.com 通讯作者:胡建新 Email:hujianxin@medmail.com
R54
A
1000-3614( 2015 )01-0059-05
10.3969/ j. issn. 1000-3614. 2015.01.016

