固体铁氧化物与CO2-CO气体间18O交换的质谱研究
严红燕,胡晓军,周国治
(北京科技大学钢铁冶金新技术国家重点实验室,北京 100083)
固体铁氧化物与CO2-CO气体间18O交换的质谱研究
严红燕,胡晓军,周国治
(北京科技大学钢铁冶金新技术国家重点实验室,北京 100083)
为掌握冶金反应过程中氧在气-固两相间的迁移动力学,采用氧同位素交换技术研究了1 373K时固体铁氧化物与CO2-CO气体的氧同位素交换反应,考察了气相氧分压(CO2/CO比值)对氧同位素交换反应的影响。结果表明:在氧同位素交换反应前期,反应速率随时间急剧下降,后期缓慢下降,反应前期和后期的控制性环节分别为界面化学反应和氧在铁氧化物内的扩散;氧分压的提高有利于氧同位素交换反应的进行。
氧同位素交换法;铁氧化物;CO2分解反应;氧交换速率
随着气基直接还原炼铁新技术的发展,氧在还原气-固态铁氧化物两相间迁移的动力学研究受到冶金研究者的重视[1-3]。固体铁氧化物气基直接还原反应的实质是氧的迁移过程,该过程主要由界面化学反应及相内扩散组成。针对界面化学反应动力学,Wagner[4]、Fruehan[5]采用热重法研究CO2-CO混合气与块体铁氧化物间的反应。Kang等[6]研究了Fe2O3颗粒在CO2-CO气氛下的还原反应,提出了非球形铁氧化物混合控速动力学模型。丁涛等[7]利用高温流化床研究了CO2-CO气体对FeO还原率的影响,利用未反应核模型和Ronz-Marshall公式计算出气相边界层内的传质系数。以上相关反应动力学的研究都是假设限制性环节,并将数据进行稳态近似处理,对反应的动力学过程进行解析。而氧迁移反应是一个动态过程,实际的反应也总是同时包含界面反应和扩散两部分,忽略任何一个都会造成一定的偏差[8]。
为准确分析反应的动力学过程,首先必须获得准确的反应速率数据。有报道[9-12]采用碳同位素交换技术研究氧化铁熔渣体系表面的CO2分解反应。由于碳同位素交换反应只涉及界面反应,与扩散无关,因此可排除扩散对氧交换过程的影响。在催化剂领域的研究中,采用了氧同位素交换技术研究氧在固体催化剂表面的迁移及内部扩散[13-15]。考虑到铁氧化物实际的还原过程中包含界面反应和氧在固相内的扩散,Hu和Matsuura等[16-17]采用此方法研究了含氧同位素的CO2-CO气体与含铁氧化物熔渣的氧交换反应,获得了反应速率常数及传质系数。但有关氧同位素交换技术在固态铁氧化物与CO2-CO气体反应动力学的研究尚未见报道。
为了掌握氧在固态铁氧化物与CO2-CO气体间的迁移动力学,本工作将采用18O同位素交换技术研究1 373K时固态铁氧化物与CO2-CO气体间的氧交换反应,并考察气体氧分压(CO2/CO比值)对氧交换反应的影响。
1 实验部分
1.1 主要仪器与装置
实验装置由反应气路(反应气体和气体流量计部分)、反应区和在线气体质谱分析仪3部分组成,示于图1。反应气体由高纯CO2、CO以及Ar混合组成,气体组成和流量由一组电子质量流量控制计(ALICAT,控制精度为0.5%)控制。反应管为带有透气石英砂的石英管。实验过程中,气体的组成及变化情况由HPR20-QIC质谱仪在线监测,其质量扫描范围为m/z1~500,灵敏度为5×10-9~5×10-5。
1.2 实验过程
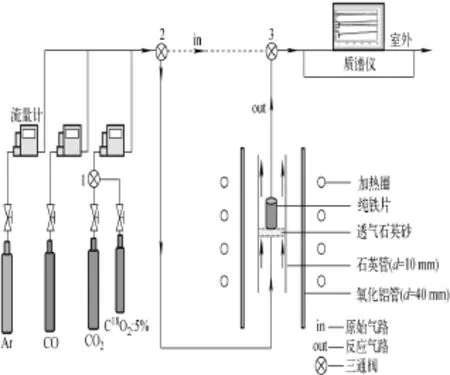
图1 实验装置图Fig.1 Diagram of experimental apparatus
将表面处理干净的铁片截成2cm×4cm的长方形,卷成圆筒状置于石英砂上。反应炉以5K/min的速率升温,并通入小流量的Ar保护气。达到反应温度后,通入实验要求的CO2-CO混合气,保持设定的气体流量进行铁片氧化反应,具体实验条件列于表1。质谱仪在
线监测整个氧化反应过程中质量数为28(CO)、44(CO2)的离子电流强度I28、I44变化,待达到化学反应平衡后,通过三通阀2、3将气路切换至原始气路(in),并切换三通阀1,把普通的CO2气体替换为含18O(含量为5%)的CO2,保持CO2/CO比例不变,此时,用质谱仪测定原始气体的组成;然后,将气路切换至反应气路(out)进行氧同位素交换反应。实验结束后,切换回普通的CO2-CO混合气体,样品在同样的实验条件下进行冷却。
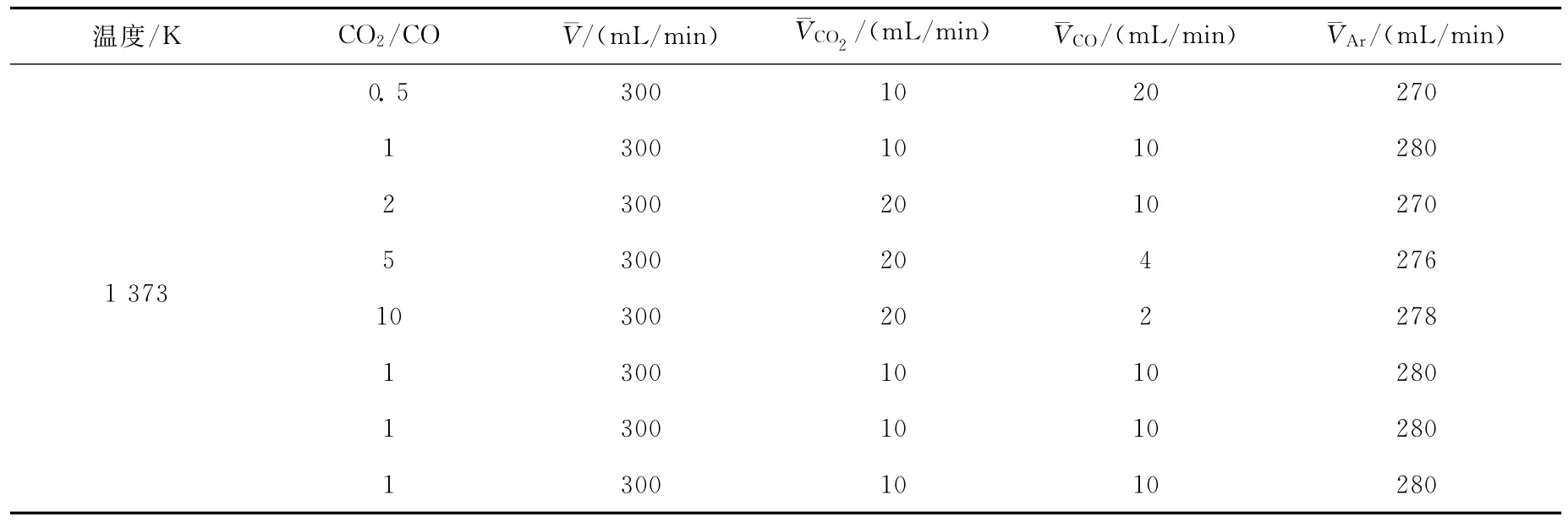
表1 实验条件Table 1 The experimental conditions
2 结果与讨论
2.1 同位素交换反应原理
同位素交换反应是在体系处于化学平衡状态下发生的,化合物中的一种同位素与另一种同位素的交换替代反应。CO2-CO气体与铁氧化物的反应包含氧参加的界面化学反应和氧在相内的迁移,这两部分是同时进行的,其反应机理如下:
界面处的反应包含C18O2吸附、解离及C18O和18O原子的脱附过程。

相内的氧扩散迁移:
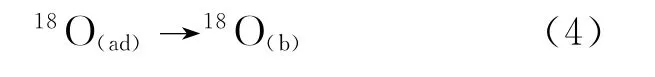
其中,下标(g)、(ad)及(b)分别表示气相中、吸附在氧化物表面及扩散至氧化物内部的物质。
氧同位素交换反应主要经历以下步骤:
1)含18O的CO2气体扩散到铁氧化物表面并发生吸附,解离出18O;
2)解离的18O向铁氧化物内部扩散,同时内部的16O向外扩散,表现出氧的交换扩散;
3)内部扩散到界面的16O与吸附的C18O和C16O结合成C16O18O、C16O16O;
4)生成的C16O18O、C16O16O及式(1)、(2)和(3)生成的C18O和C16O在铁氧化物表面脱附,并向气相中扩散。
用式(5)[17]可定义和计算氧交换反应的速率:

其中,Pθ为标准大气压;T为标准状态温度,即273K;I46、I48、I30分别表示C16O18O、C18O18O、C18O的离子强度。
2.2 同位素气体平衡反应
质谱仪在线监测氧同位素交换反应的动力学曲线示于图2。从“in”段可以看出,在原始同位素气体中,C18O18O量较少,C16O18O为主要成分。在氧同位素交换反应后,“out”段的I30、I46均升高,I48下降。结合氧同位素交换反应机理,若原始同位素气体间的交换反应达到平衡,与“in”段气体组分离子强度相比,在“out”段将出现I30升高,而I46、I48下降的趋势。图中的结果与此不一致,其原因可能是使用的同位素气体未达到平衡。因此,需要分析实验温度为
1 373K时,氧交换反应是否受同位素气体平衡反应的影响。

图2 氧同位素交换反应过程中,各气体成分离子强度随时间的变化曲线Fig.2 Curves of ion current with time during oxygen isotope exchange reaction
为确认原始反应气体是否达到同位素平衡,设计了一组空烧实验,即反应区不放样品,分别获得室温和1 373K下同位素气体离子强度的变化,结果示于图3。可见,由室温变化到1 373K时,I46变大,而I48变小。这说明,室温条件下反应气体没有达到同位素平衡。
对含18O的CO2同位素气体的理论平衡含量进行计算,并与空烧实验的测量结果进行对比,结果列于表2。在表2中,1 373K下测得的C18O16O、C18O18O含量分别为6.84%和0.21%,这与理论计算值(6.50±0.12)%及(0.11±0.01)%基本一致,而室温下的测量值与理论值相差较大。图3的结果同时表明,同位素气体经过高温区时,会自发进行同位素平衡反应。另外,根据式(5)计算气体与固体氧化铁间的氧交换反应速率,与气体同位素反应是否平衡无关,只与反应前后气体中总的同位素含量之差有关。
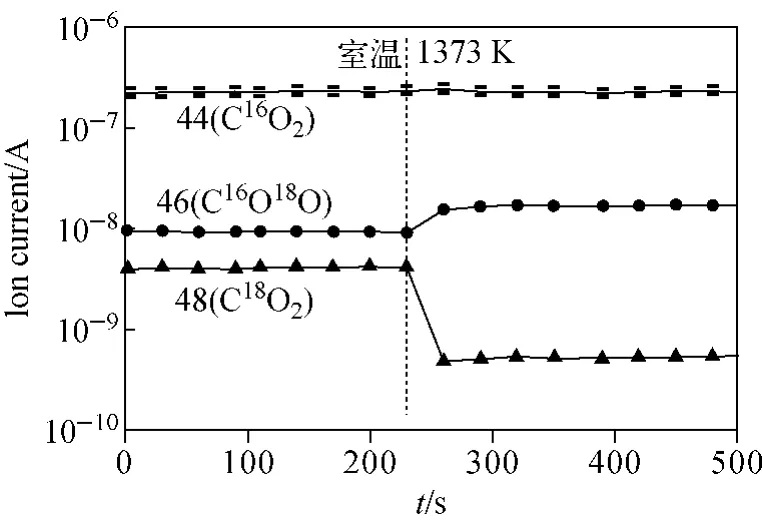
图3 在室温和1 373 K下,含同位素气体离子强度的变化Fig.3 The variation of ion current of isotope gases at room temperature and 1 373 K
2.3 气体流量的确定
质谱响应时间为气体从某一流量下达到平衡至切换为另一流量下开始平衡的时间差,响应时间的长短关系到实验的精确性。不同混合气体流量对质谱响应时间的影响示于图4。测试气体由Ar和CO2组成,测试了混合气体流量Q在200~600mL/min之间,CO2流量由10mL/min切换至20mL/min的质谱响应时间。
从图4b可看出,质谱响应时间随气体流量的增加而变短。在混合气体流量达到300mL/min后,质谱响应时间基本保持在50s左右。因此,考虑同位素气体的成本,确定本实验的气体总流量为300mL/min。
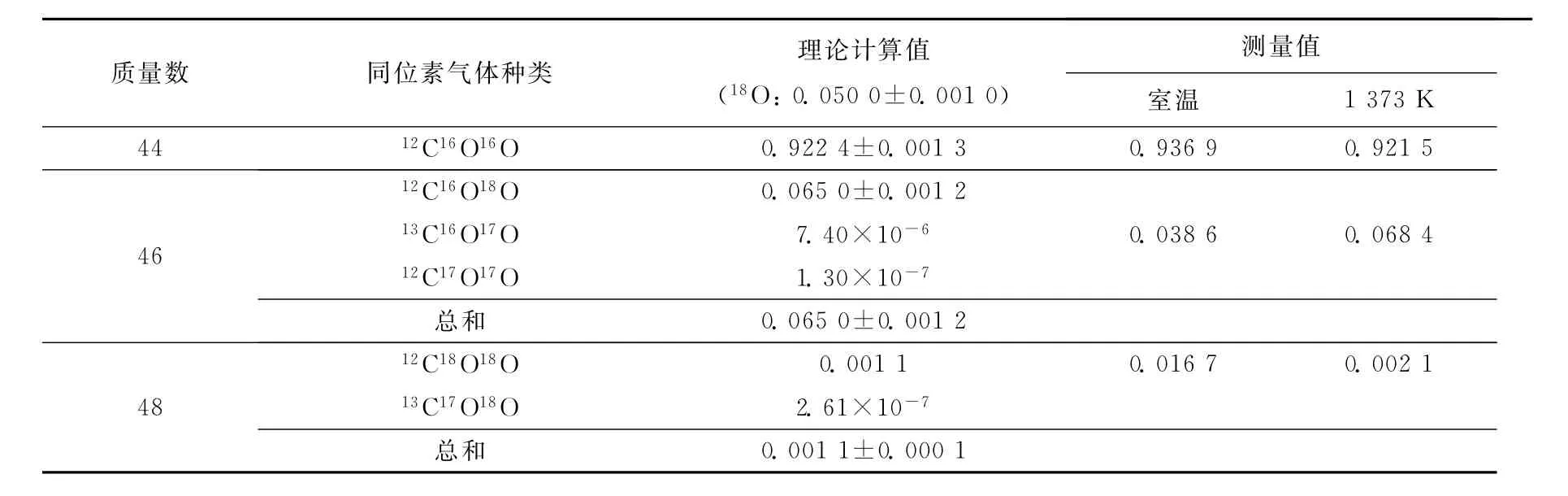
表2 含18O的CO2同位素气体计算值与测量值的比较Table 2 The calculated and measured values of CO2gas enriched18O

图4 气体流量对质谱响应时间的影响Fig.4 The influence of gas flow on mass spectrometry response time
2.4 铁片厚度的影响
实验使用的原始铁片厚度约为0.05mm,经过表面处理后,样品厚度略小于0.05mm,并存在样品厚度不一致的情况。因此,比较分析了样品厚度对氧同位素交换反应的影响。在CO2与CO的分压比为1、温度为1 373K条件下,不同厚度样品的氧同位素交换反应速率随时间的变化关系示于图5。可见,所得速率曲线变化规律基本一致:在反应前期约100s内,氧交换速率快速下降,之后缓慢下降,这符合前期为界面化学反应控速、后期为扩散控速的动力学特征。在扩散控速环节,反应速率在5× 10-8~8×10-8mol/s范围内,说明样品厚度对氧同位素交换反应速率无明显影响。
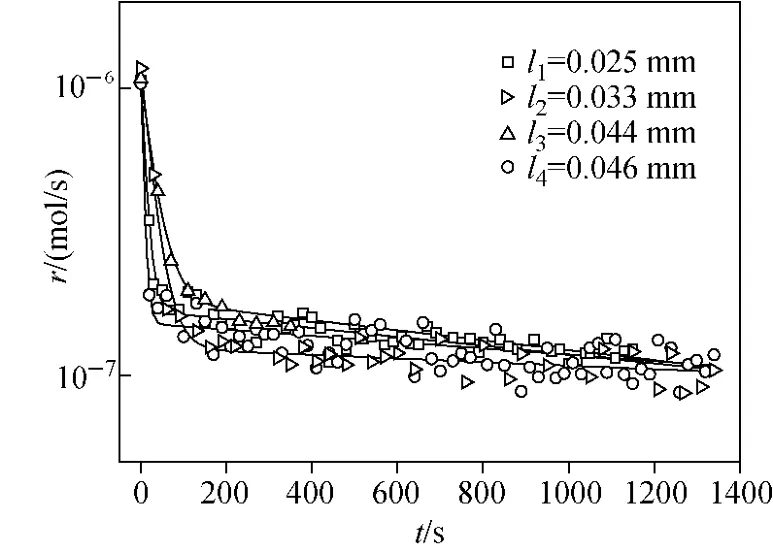
图5 在CO2/CO=1,T=1 373 K条件下,铁片厚度对反应速率的影响Fig.5 The influence of iron thickness on reaction rate at 1 373 K with CO2/CO=1
2.5 CO2/CO比值的影响
温度为1 373K时,不同CO2/CO比值下氧同位素交换反应速率随时间变化的关系示于图6。从图6中可以看出,CO2/CO比值越大,氧同位素交换速率越大,说明气相中氧分压的升高有利于氧同位素交换反应的进行。这是由于氧分压越大,氧在铁氧化物界面处与相内的浓度梯度越大,氧向相内扩散的驱动力越大。图6中的反应速率在10-7mol/s左右,比Hu等[16-17]研究得到的10-6mol/s小1~2个数量级,说明固相中的氧传递比熔渣中的氧传递困难。Hu等是在1 773K时,研究了CO2-CO气体与铁氧化物熔渣的氧同位素交换反应,而本实验中CO2-CO气体与固体铁氧化物的反应不仅反应温度更低,且固体铁氧化物表面致密、存在复杂的晶体结构,这些都会增加氧迁移的难度。

图6 T=1 373 K,不同CO2/CO值下氧同位素交换速率Fig.6 The oxygen exchange rate at 1 373 K in different CO2/CO ratio
3 结论
采用氧同位素交换技术研究了CO2-CO气
体与固态铁氧化物体系的氧同位素交换反应,利用质谱仪在线监测氧同位素交换反应的瞬态变化,考虑氧迁移过程中界面化学反应和相内扩散的同时存在,考察了铁片厚度、气体中氧分压(CO2/CO比值)对氧同位素交换反应的影响。结果表明:氧同位素交换反应由开始的最大反应速率快速下降,约在100s后缓慢下降,这符合反应前期为界面化学反应、后期为氧在铁氧化物相内扩散的动力学特征。气相中氧分压的升高,增加了氧迁移的驱动力,促进氧同位素交换反应的进行。
目前的工作获得了不同气体氧分压下氧在气-固体系反应速率的变化规律及确定了限制环节。在以后的工作中,将进一步研究以获得反应速率常数、传质系数,为气基直接还原炼铁新技术的发展提供更为完备的理论依据和数据支持。
[1] SUN S,BELTON G.The effect of surfactants on the interfacial rates of reaction of CO2and CO with liquid iron oxide[J].Metallurgical and Materials Transactions B,1998,29(1):137-145.
[2] GRABKE H J.Surface and interface reactions and diffusion during the high-temperature corrosion of metals and alloys[C].Defect and Diffusion Forum,2001,194:1 649.
[3] WORRAL E,COLEY K.Kinetics of the reaction of CO2/CO gas mixtures with iron oxide[J].Metallurgical and Materials Transactions B,2010,41(4):813-823.
[4] WAGNER C.Kinetics in metallurgy[M].Cambridge:Massachusetts Institute of Technology Press,1955.
[5] FRUEHAN R.The rate of reduction of iron oxides by carbon[J].Metallurgical Transactions B,1977,8(1):279-286.
[6] KANG H W,CHUNG W S,MURAYAMA T.Effect of iron ore size on kinetics of gaseous reduction[J].ISIJ International,1998,38(2):109-115.
[7] 丁涛,肖兴国.FeO高温气-固还原动力学研究[J].东北大学学报:自然科学版,1995,16(2):115-119.Ding Tao,Xiao Xingguo.Dynamics of reduction study between FeO and gas-solid at high temperature[J].Journal of Northeastern University(Natural Science),1995,16(2):115-119(in Chinese).
[8] HU X J,MATSUURA H,TSUKIHASHI F.Kinetics analysis on non-equilibrium process of oxygen transfer at interface[J].ACTA Metallurgica Sinica,2007,43(8):829-833.
[9] GRABKE H J.Kinetics of the oxygen transfer from carbon dioxide to the surface of iron[J].Proceedings of the third International Congress on Catalysis,1964,2(3):928-938.
[10]CRAMB A W,BELTON G R.Studies of the interfacial kinetics of the reaction of CO2with liquid iron by the14CO2-CO isotope exchange reaction[J].Metallurgical and Materials Transactions B,1981,12(4):699-704.
[11]SASAKI Y,HARA S,GASKELL D,et al.Isotope exchange studies of the rate of dissociation of CO2-CO on liquid iron oxides and CaO-saturated calcium ferrites[J].Metallurgical and Materials Transactions B,1984,3(15):563-571.
[12]FRUEHAN R J,ANTOLIN S.A study of the reaction of CO on liquid iron alloys[J].Metallurgical and Materials Transactions B,1987,18(2):415-420.
[13]ROYER S,DUPREZ D.Catalytic oxidation of carbon monoxide over transition metal oxides[J].Chem Cat Chem,2011,3(1):24-65.
[14]DESCORME C,DUPREZ D.Oxygen surface mobility and isotopic exchange on oxides:Role of the nature and the structure of metal particles[J].Applied Catalysis A,2000,202(2):231-241.
[15]DONG F,SUDA A,TANABE T,et al.Characterization of the dynamic oxygen migration over Pt/CeO2-ZrO2catalysts by18O/16O isotopic exchange reaction[J].Catalysis Today,2004,90(3):223-229.
[16]HU X J,MATSUURA H,TSUKIHASHI F.Oxygen exchange reaction between CO2-CO gas and molten oxide containing iron oxide[J].ISIJ International,2006,46(7):974-980.
[17]MATSUURA H,HU X J,TSUKIHASHI F.Measurement of oxygen exchange reaction rate between gas and molten iron oxide by mass spectrometry of CO-CO2gas containing18O[J].Journal of the Mass Spectrometry Society of Japan,2005,53(5):257-264.
18O Exchange between Solid Iron Oxide and CO2-CO Gas Using Mass Spectrometry
YAN Hong-yan,HU Xiao-jun,ZHOU Guo-zhi
(State Key Laboratory of Advanced Metallurgy,University of Science and Technology Beijing,Beijing100083,China)
In order to cliarify the kinetics of oxygen transfer in metallurgical gas-solid reactions,the oxygen isotope exchange technique was used to study the oxygen exchange reaction between CO2-CO gas containing18O and iron oxide at 1 373K.The influence of oxygen partial pressure on oxygen exchange reaction was investigated.The results show that the rates sharply decrease approximately 100s,and then gradually decrease with the reaction time proceeded.The rate-limiting step changes from interfacial chemical reaction in the initial stage to mass transfer in the following stage.Higher oxygen potential in mixture gas accelerates the oxygen exchange reaction.
oxygen isotope exchange method;iron oxide;CO2dissociation;oxygen exchange rate
O 643.14
A
1004-2997(2015)01-0085-06
10.7538/zpxb.youxian.2014.0064
2014-04-10;
2014-06-06
国家自然科学基金项目(50874128,51334001)资助
严红燕(1986—),女(汉族),江西赣州人,博士研究生,冶金物理化学专业。E-mail:xiaoniji@126.com
胡晓军(1971—),男(汉族),河南禹州人,教授,从事冶金技术研究。E-mail:huxiaojun@ustb.edu.cn
时间:2014-12-02;
http:∥www.cnki.net/kcms/doi/10.7538/zpxb.youxian.2014.0064.html

