正交试验法优选葛根配方颗粒的提取工艺
杜远东
陕西省汉中市食品药品检验检测中心,陕西 汉中 723000
葛根为豆科植物野葛Pueraria lobata (Wild.)Ohwi 或甘葛藤P.thomsonii Benth 的干燥根,其主要活性成分为异黄酮类化合物,如葛根素、大豆素、大豆苷等。葛根配方颗粒是葛根饮片经水提、浓缩、干燥、制粒等工序制成的单味中药颗粒剂[1]。将葛根饮片制备为颗粒剂,可以有效地去除植物纤维等无活性成分,增加稳定性,易储存,服用方便。
1 材料与仪器
1.1 材料 葛根(西安盛兴饮片厂);葛根素对照品(批号:0766-200611,中国药品生物制品检定所);甲醇(色谱级);超纯水(实验室自制)。
1.2 仪器 Waters 高效液相色谱仪(Waters2695 Separations Module,Waters2996 PAD 检测器),含在线真空脱气机、四元梯度泵、自动进样器、柱温箱;梅特勒GB204 电子天平;SB3200DT 超声波清洗机(宁波新茎生物科技股份有限公司);101 型电热鼓风干燥箱(北京科伟永鑫实验仪器设备厂);艾柯-Advanced-06 型超纯水机(成都唐氏康宁科技发展有限公司)。
2 方法与结果
2.1 提取方法
2.1.1 采用传统工艺提取 称取100g 药材,加入水量没过药材面1~2cm 即可,浸泡0.5h,用武火煎煮至沸腾,然后改用文火煎煮,30min/次,提取2 次,合并药液,浓缩,定容至250ml,备用。
2.1.2 水沸后提取 称取100g 药材,加入沸水中,水量以没过药材面1~2cm 即可,武火煮沸后,改用文火,30min/次,提取2 次,合并药液,浓缩,定容至250ml,备用。
2.1.3 水提 称取药材100g,分别加入10、8 倍量的水提取,第一次提取1h,第二次提取30min,滤出药液,合并药液,浓缩,定容至250ml,备用。
2.1.4 60%乙醇提取[2]称取100g 药材,加入5 倍量的60%乙醇回流提取,第一次提取1.5h,第二次提取1 h,滤取药液,合并药液,减压回收乙醇,定容至250ml,备用。
2.1.5 95% 乙醇提取 称取100g 药材,加入5 倍量的95%乙醇回流提取,第一次提取1.5h,第二次提取1 h,滤取药液,合并药液,减压回收乙醇,定容至250ml,备用。
2.2 高效液相色谱测定含量
2.2.1 色谱条件[3]以十八烷基硅烷键合硅胶为填充剂;流动相:甲醇-水(25∶75);检测波长:250nm。
2.2.2 对照品溶液的制备 精密称取葛根素标准品10.4mg,加30%的乙醇定容至50ml,稀释5 倍,制成2mg/50ml 的对照品溶液,用微孔滤膜过滤,备用。
2.2.3 供试品溶液 吸取各样品溶液2ml,用30%的乙醇定容至100ml,用微孔滤膜过滤,备用。
2.2.4 结果 由表1 可知,60%乙醇提取所得的葛根素含量最高,因此溶剂选择60%乙醇。

表1 不同提取方法葛根素含量结果
2.3 正交设计试验优选葛根提取工艺 选取浸泡时间(A)、加醇量(B)、提取时间(C)、提取次数(D)四个水平,以葛根素含量与干膏收率为指标的进行正交试验,优化葛根提取工艺。按“2.2”的方法测定葛根素含量,因素水平、正交试验、正交试验结果、直观分析、方差分析的结果见表2、3、4、5、6。
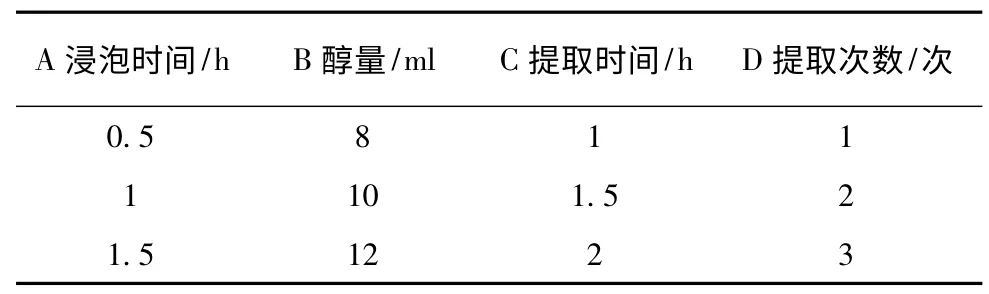
表2 正交因素水平表

表3 正交试验设计
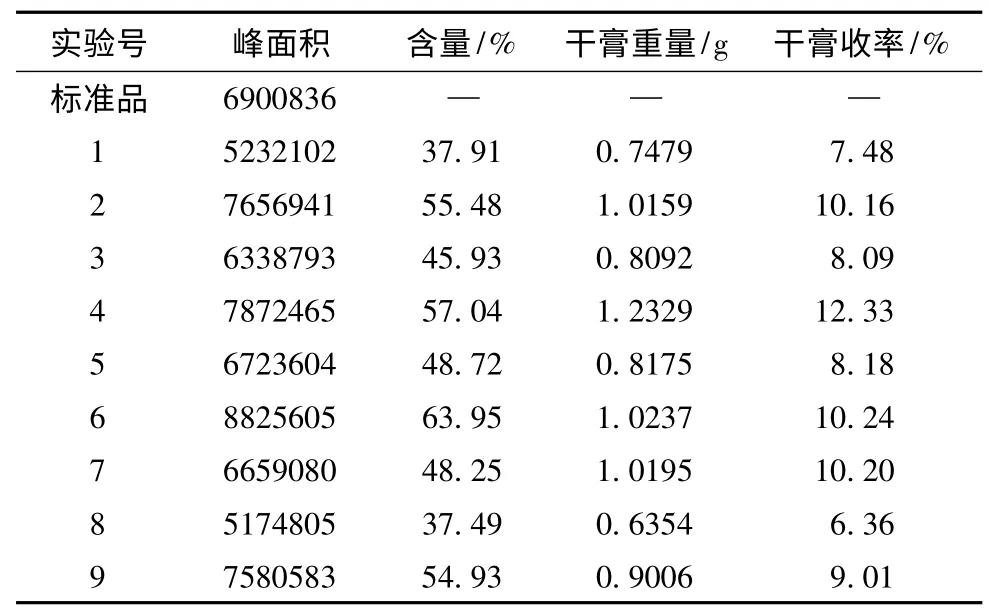
表4 正交试验结果
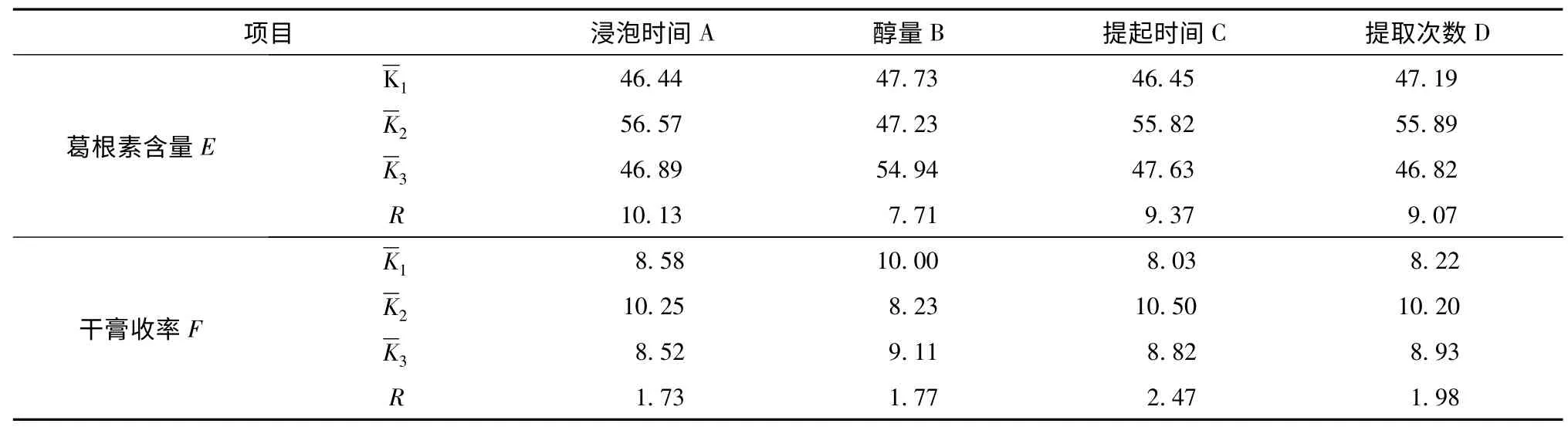
表5 直观分析
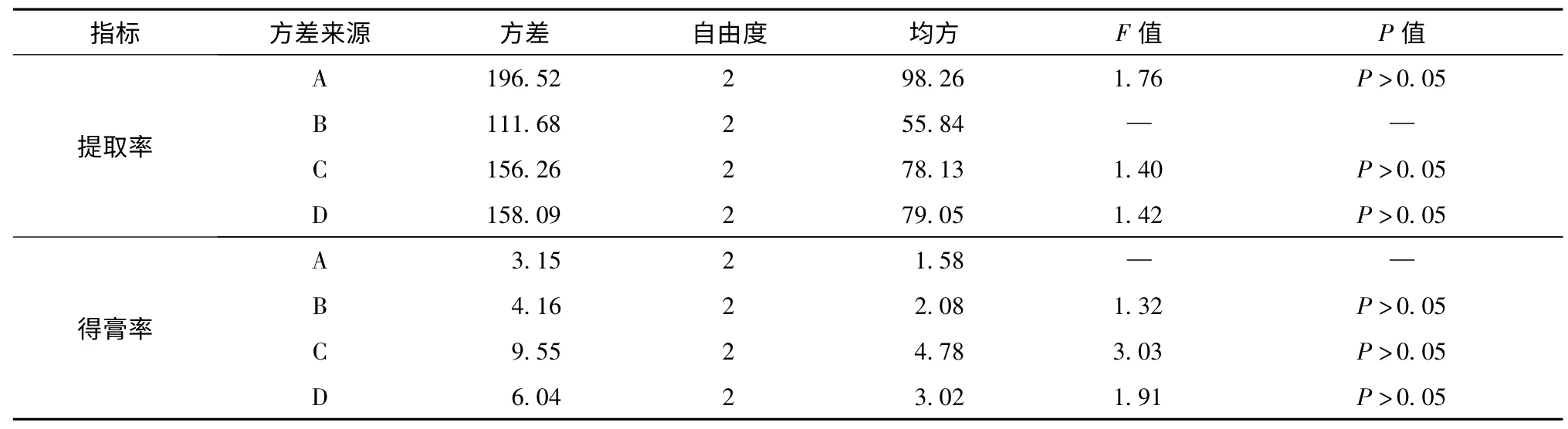
表6 方差分析
以干膏收率与葛根素含量的综合评分为考察指标,直观分析表(表5)中极差R 值最小的为误差项。对各因素进行直观分析,A 因素:K2>K3>K1;C 因素:K2>K3>K1。D 因素:K2>K3>K1;B 因素干膏收率为K1>K3>K2;含量测定为K2>K3>K1,综合考虑,B 因素选K3。根据以上结果分析得出工艺为A2B3C2D2,即为用60%乙醇,12倍的量,浸泡1h,提取2 次,每次1.5 h。

表7 验证试验结果
2.4 验证试验 分别称取20g 葛根药材,按优选最佳工艺条件进行3 次验证试验,结果见表7。
3 结论
正交试验结果表明,该优选工艺合理、稳定、重现性好,为葛根配方颗粒的生产工艺奠定了基础。
[1]顾志平,陈碧珠,冯瑞之.中药葛根及其同属植物资源的利用和评价[J].药学学报,1996,31 (5):3.
[2]匡海学.中药化学[M].1 版.北京:中国中医药出版社,2003:178.
[3]国家药典委员会.中华人民共和国药典(第一部)[S].北京:中国医药科技出版社,2010:313.

