骨髓间充质干细胞治疗大鼠脊髓损伤移植途径的实验
赵学正唐开
(1.杭州市西溪医院骨科,杭州310023;2.大连医科大学附属第一医院骨科,辽宁大连116011)
骨髓间充质干细胞治疗大鼠脊髓损伤移植途径的实验
赵学正1唐开2*
(1.杭州市西溪医院骨科,杭州310023;2.大连医科大学附属第一医院骨科,辽宁大连116011)
背景:骨髓间充质干细胞(BMSCs)移植治疗脊髓损伤(SCI)成为国内外研究的热点,采用何种移植途径更有利于BMSCs在脊髓损伤处存活、分化,促进神经功能恢复,更适合于临床应用,是当前亟待解决的主要问题。
目的:BMSCs通过直接注射、股静脉注射和腰椎穿刺三种途径移植到脊髓损伤大鼠模型内,观察、比较并筛选适于临床应用的移植途径。
方法:采用全骨髓法分离培养BMSCs。采用改良A llen's法建立T10脊髓损伤大鼠模型,建模后3 d随机分为模型对照组(A组)、直接注射组(B组)、股静脉注射组(C组)、腰椎穿刺组(D组)。BMSCs移植后3、7、14、21 d采用BBB评分方法对各组大鼠评分。免疫组化检测各组5-溴-2-脱氧尿嘧啶核苷(Brdu)单染的Brdu+细胞、Brdu+胶质纤维酸性蛋白(GFAP)和Brdu+神经微丝蛋白200(NF-200)双阳性细胞,并计算各组GFAP、NF-200表达的平均光密度值(MOD)。
结果:BMSCs迁移至脊髓损伤部位并存活,还可表达GFAP和NF-200。移植后各组GFAP和NF-200的MOD均增加,B、C、D组大鼠功能恢复明显。
结论:综合评判和比较三种移植途径,腰椎穿刺是一种侵袭性较小、较为理想的细胞植入方式,相对优于直接注射和股静脉注射,更适于临床应用。
间质干细胞移植;脊髓损伤
Background:ound:The transp lantation of bonemarrow stromal cells(BMSCs)for the treatmentof spinal cord injury(SCI)hasbecome a focus athome and abroad.It is essential to choose a suitable grafting pathway by whichmore simple operation and higher survival rate can beachieved.
Objective:tive:To transplantBMSCs in SCI ratsby direct injection,lumbar puncture,femoralvenousdelivery and selecta proper pathway for clinicalapplication.
Methods:hods:BMSCs were isolated by w holemarrow method.SCI ratmodels w ere established by modified A llen's Weight Drop.Aftermodeling,the ratswere random ly assigned into 4 groups:control group,direct injection group,femoral venous delivery group,and lumbar puncture group.Locomotor function was assessed by BBB score 3 d,7 d,14 d,and 21 d after BMSC transplantation.Simple-staining 5-bromo-2-deoxyuridine(Brdu),double-staining Brdu+glial fibrillary acidic protein(GFAP)and Brdu+neuro filaments-200(NF-200)were identified by immunohistochemistry.Mean optical density (MOD)of NF-200 and GFAPwere calculated.
Results:ults:BMSCswere successfully transplanted in the injured spinal cord.GFAPand NF-200 protein were expressed in implanted BMSCs.MOD of GFAPand NF-200 increased in all rats after transplantation.Locomotor function of direct injection group,femoralvenousdelivery group,and lumbar puncturegroup improved significantly.
Conclusions:ions:Lumbar puncture is less invasiveand superior to direct injection and femoralvenous delivery in BMSCs transplantation pathways for treatmentof SCI.
脊髓损伤(spinal cord injury,SCI)常导致患者损伤平面以下感觉缺失和运动功能障碍,使患者的生活质量大大降低,但SCI的有效治疗仍是一个难以解决的问题。随着神经生物学和组织工程学的快速发展,各种创新技术不断应用于SCI的治疗。目前从研
究SCI修复机制的角度来看,骨髓间充质干细胞(bonemarrow stromal cells,BMSCs)[1]移植治疗SCI是一种更有前景的治疗方法[2,3]。BMSCs既可以分化为神经元样细胞,本身又能分泌或者刺激机体产生一些神经营养因子、细胞因子来参与脊髓功能和组织的修复[1]。
目前BMSCs治疗SCI较常用的方法是将细胞直接注射到损伤局部[4-6],这种方法毫无置疑能提高细胞在损伤区域的存活数量,然而当出现广泛区域损伤或多发病灶等问题时,临床实际操作比较困难;而且该方法属于有创操作,需要手术暴露损伤的脊髓组织,将对脊髓或周围组织造成二次损伤,使损伤局部的微环境更不利于移植细胞的存活,从而降低疗效。采用何种移植途径能更有效地增加BMSCs在脊髓损伤处的存活数目,更适合临床应用,是当前急需解决的问题。要让BMSCs移植治疗SCI广泛、高效地应用于临床,就需要有一种安全有效、易于操作、创伤小,且让患者在生理和心理上比较容易接受的方法。本实验通过腰椎穿刺的方法使BMSCs随脑脊液到达脊髓损伤区域,另以股静脉注射和损伤局部直接注射的方法作为对比,比较三种途径植入的BMSCs向脊髓损伤处迁移和存活的情况,以找到更适用于临床应用的细胞植入途径。
1 材料与方法
1.1 实验动物
选取6周龄健康级SD大鼠4只,雌雄不限,体质量120~140 g(用于提取BMSCs做原代培养);选取成年健康级SD大鼠48只,雌性,220~250 g(用于制作SCI模型),均购自大连医科大学动物实验SPF中心,实验动物质量合格证号:SCXK(辽)2008-0002,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》的有关规定[7]。
1.2 实验方法
1.2.1 BMSCs分离、培养和鉴定:引颈处死SD大鼠后75%乙醇浸泡约15m in,无菌条件下迅速取出双侧股骨和胫骨。然后剪断股骨和胫骨干骺端暴露骨髓腔,用7号注射针头吸取L-DMEM 5m l反复冲洗骨髓腔3~4次至骨质呈白色。收集冲洗液置入15m l离心管中,再轻轻吹打数次,室温下离心5 m in(1500 rpm)后弃去上清液,加入完全培养液,轻轻吹打重悬制成细胞悬液。置于37℃、体积分数为0.05的CO2饱和湿度的培养箱内孵育。72 h后观察细胞的贴壁情况,并更换培养液,以后每2~3 d换液1次,待贴壁细胞融合达到80%~90%时,用0.25%的胰蛋白酶(含0.02%EDTA)消化至细胞形态变为圆形,终止消化后按1:2比例传代继续培养,采用及时反复传代的方法对BMSCs进行扩增和纯化。
取第5代BMSCs经流式细胞仪检测表面标志物CD29、CD90和CD45、CD11b/c,上述操作由大连医科大学附属第一医院中心实验室完成。
1.2.2 SD大鼠SCI模型的建立:健康级SD大鼠48只,雌性。称重后给予10%水合氯醛0.3m l/100 g腹腔注射麻醉,将大鼠俯卧于手术台上。以T10棘突为中心常规备皮、消毒、铺巾,做长约2 cm的纵行切口,逐层剪开皮肤、筋膜、钝性分离椎旁软组织,暴露T9~T11棘突和椎板并游离T10椎板上下缘,咬去T9、T11的部分椎板和T10的全部椎板,充分暴露T10节段脊髓。用改良Allen's打击器,2 g重的不锈钢杆自三维立体定向仪上自由落下12.5 cm(打击势能为25 g·cm),造成T10脊髓挫裂伤,损伤面直径为2mm,以大鼠尾部痉挛性摆动和双后肢躯体回缩样扑动为打击成功标志。甲硝唑和生理盐水反复冲洗切口,无菌明胶海绵覆盖于暴露的硬脊膜,逐层缝合肌肉和皮肤,用0.02%碘伏消毒皮肤切口。SCI大鼠模型制作成功后前3 d,每日2次庆大霉素腹腔注射预防感染。防止发生尿潴留,每日3次对大鼠膀胱按摩排尿直到自主排尿功能恢复。
1.2.3 实验动物分组和BMSCs移植:SCI造模成功后3 d将大鼠随机分为4组,每组12只。A组为模型对照组;B组为直接注射组;C组为股静脉注射组;D组为腰椎穿刺组。分别于移植后3、7、14、21 d处死大鼠。在移植前48 h取第5代的BMSCs,在细胞融合至30%~40%时将5-溴-2-脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,Brdu)工作液(500μmol/L)加入BMSCs培养皿中,使Brdu终浓度为10μmol/L,在37℃、5%CO2孵育箱内继续孵育。48 h后消化收集,用0.01mol/L PBS洗涤两次,置于冰浴中1 h内进行移植。A组不进行细胞移植,B组在损伤区头尾两端共注射1.5×105个BMSCs,C组通过股静脉注射1m l细胞悬液约1×106个BMSCs,D组通过腰椎穿刺注射100μl细胞悬液约1×106个BMSCs。
1.2.4 神经功能障碍BBB评分[8]:根据BBB运动功能评分采用双人、双盲法独立观察大鼠双后肢的运动功能并记录,对大鼠进行行为学评估。分别于损伤
前、后,移植后3、7、14、21 d对大鼠进行评分。每次观察均在上午10点进行,在空阔地观察大鼠自由活动3m in后,分别对双后肢评分,测量两次取平均值后再同组取其均数并记录。
1.2.5 灌注取材和石蜡切片制作:在相应观察时间点对大鼠进行灌注固定,以损伤区为中心取长约1 cm脊髓段,4%多聚甲醛固定24 h,常规石蜡包埋、切片,片厚4μm,每只标本每隔10张连续切片取1张,共取5张切片。
1.2.6 Brdu单染免疫组化:切片常规脱蜡、水化后热抗原修复,柠檬酸盐缓冲液(pH=6.0)中微波加热至沸腾,当温度降至92℃时将切片置入,微波炉解冻档修复20m in,放置室温自然冷却,0.01mol/L PBS冲洗5m in×3次;0.1%Triton-X100破膜,常温下静置10m in,0.01mol/L PBS冲洗5m in×3次;3%H2O2孵育10m in以消除内源性过氧化酶,0.01mol/LPBS冲洗5m in× 3次;2mol/L HCl使细胞变性,DNA双链解开显露抗原,37℃30 m in,0.01 mol/L PBS冲洗5 m in×3次;0.1mol/L硼酸盐缓冲液,rT 10m in,0.01mol/L PBS冲洗5m in×3次;正常山羊血清封闭,rT 20m in,减少非特异性染色的影响,倾去,勿洗;滴加用抗体稀释液按1∶100稀释的一抗(抗Brdu单抗),另一张盖玻片滴加50μl 0.01 mol/L PBS代替一抗作为阴性对照;4℃过夜,PBS洗涤5m in×3次;滴加生物素化二抗,37℃30m in,0.01mol/L PBS洗涤5m in×3次;滴加用链霉卵白素过氧化氢酶复合物37℃20 m in,0.01mol/L PBS洗涤5m in×3次;滴加DAB显色,镜下观察显色结果,用水冲洗以终止显色反应。脱水,透明,中性树胶封片。
1.2.7 Brdu+GFAP和Brdu+NF-200免疫双染步骤
切片脱蜡、水化、抗原修复、破膜、过氧化氢去除内源性过氧化酶、正常山羊血清封闭同Brdu单染步骤。滴加用抗体稀释液稀释的一抗(GFAP 1:50或NF-200 1:200),另一张盖玻片滴加50μl 0.01mol/L PBS代替一抗作为阴性对照,4℃过夜,PBS洗涤5m in× 3次;滴加用0.01mol/LPBS1:500稀释的碱性磷酸酶标记的山羊抗兔,37℃30m in,0.01mol/L PBS洗涤5m in×3次;滴加用Bufer1:100稀释的碱性磷酸酶色素-底物BCIP/NBT显色混合液,镜下观察显色结果,用水冲洗以终止反应,0.01mol/L PBS洗涤5m in×3次;2 N HCL使细胞变性,DNA双链解开显露抗原,37℃30m in,0.01mol/LPBS冲洗5m in×3次;0.1mol/L硼酸盐缓冲液,rT 10m in,0.01mol/LPBS冲洗5m in× 3次;正常山羊血清封闭,rT 20m in,减少非特异性背景,倾去,勿洗;滴加用抗体稀释液按1:100稀释的一抗(抗Brdu单抗),另一张盖玻片滴加50μl0.01mol/L PBS代替一抗作为阴性对照,4℃过夜,0.01 mol/L PBS洗涤5m in×3次;滴加生物素化二抗,37℃30m in,0.01mol/L PBS洗涤5m in×3次;滴加用链霉卵白素过氧化氢酶复合物37℃20m in,0.01mol/L PBS洗涤;5m in×3次;滴加DAB显色,镜下观察显色结果,用水冲洗以终止显色反应。脱水,透明,中性树胶封片。图像分析:采用Image-pro plus 5.1(Media Cybernetics,美国)专业图像分析软件,用免疫组化照相显微镜摄片后输入计算机,每张切片随机选取5个互不重叠的视野,调整图像分析软件在相同条件下计算出积分光密度(integralopticaldensity,IOD)和组织面积(area),采用公式1计算得到平均光密度(mean optical density,MOD),测量两次取平均值后再同组取其均数并记录。
MOD=IOD/area (公式1)
1.3 统计学处理
采用SPSS16.0软件进行统计学分析,各时间点计量资料以均数±标准差表示,采用单因素方差分析,P<0.05为有统计学意义。
2 结果
2.1 BMSCs BMSCs的形态学观察和鉴定
镜下观察刚分离接种的细胞呈圆形,大小不一,绝大多数为各系造血干细胞(图1A)。培养24 h后细胞开始出现少量贴壁;48 h后贴壁细胞数量增多,呈簇分布,贴壁的细胞多呈圆形,少量伸出伪足呈短棒形;72 h后贴壁数量明显增多,呈梭形、多角形,伸出较长伪足,集落分布(图1B)。随着换液和传代次数的增加,细胞得到纯化,未贴壁细胞和贴壁杂细胞逐渐减少,细胞形态呈梭形、单一均匀,融合后呈典型的漩涡状生长(图1C、D)。
BMSCs没有特异性表型鉴定,所以我们通常采用多个表面标记物联合鉴定的方法。将第5代的BMSCs经流式细胞仪检测,结果显示CD90阳性率为98.17%、CD29阳性率为97.95%、CD45阳性率为0.06%、CD11b/c阳性率为0.84%[9,10],说明该细胞群大部分处于未分化干细胞状态,用贴壁法分离培养的第5代BMSCs的纯度在95%以上[11,12](图2)。
2.2 运动神经功能BBB BBB评分
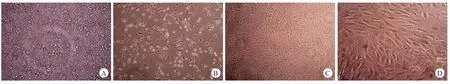
图1 BMSCs的形态学观察
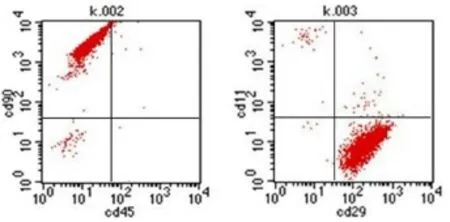
图2 BMSCs流式细胞仪检测鉴定结果
BMSCs移植后3、7、14、21 d分别对各组大鼠进行评分。BMSCs移植后3 d各治疗组较移植前运动功能有所恢复,但与对照组比较无明显差别。BMSCs移植后7 d开始,各组运动功能逐渐恢复,B、C、D组运动神经功能评分较A组有明显改善,各治疗组之间的评分也出现显著性差异,并持续到细胞移植后21 d(表1)。
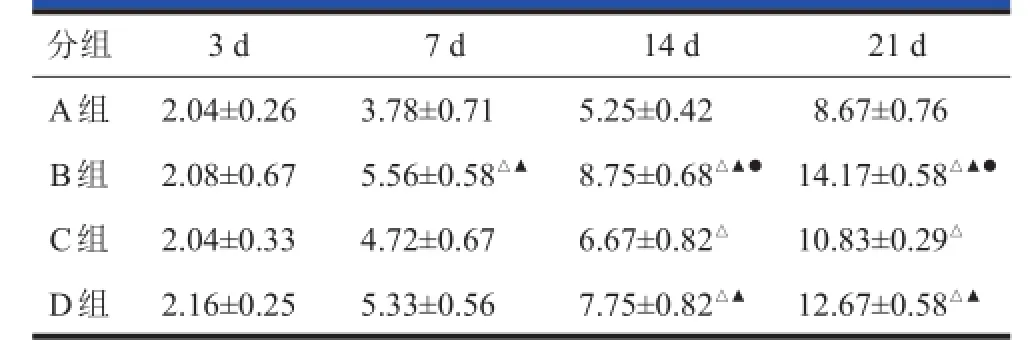
表1 BMSCs BMSCs移植后各组大鼠后肢神经功能BBB BBB评分(x x±s s,,n n==1212)
2.3 Brdu Brdu++免疫组化结果
A组未见阳性细胞,B、C、D组的损伤脊髓组织均见阳性细胞,核呈棕黄色或棕色(图3),在各时间点上,B组阳性细胞数均多于C、D组,具有显著性差异(P<0.01),且D组阳性细胞数亦优于C组。但B、C、D组阳性细胞数随移植天数的增加而逐渐减少(表2)。
2.4 Brdu Brdu++GFAP GFAP免疫组化结果
各实验组和对照组在观察时间段内星形胶质细胞的变化较为明显,BMSCs移植后3 d,星形胶质细胞反应性增生、肥大,出现在损伤区域周边,但未见到双染阳性细胞。移植后7~21 d,星形胶质细胞的增生反应一直持续升高,B、C、D组GFAP的阳性表达
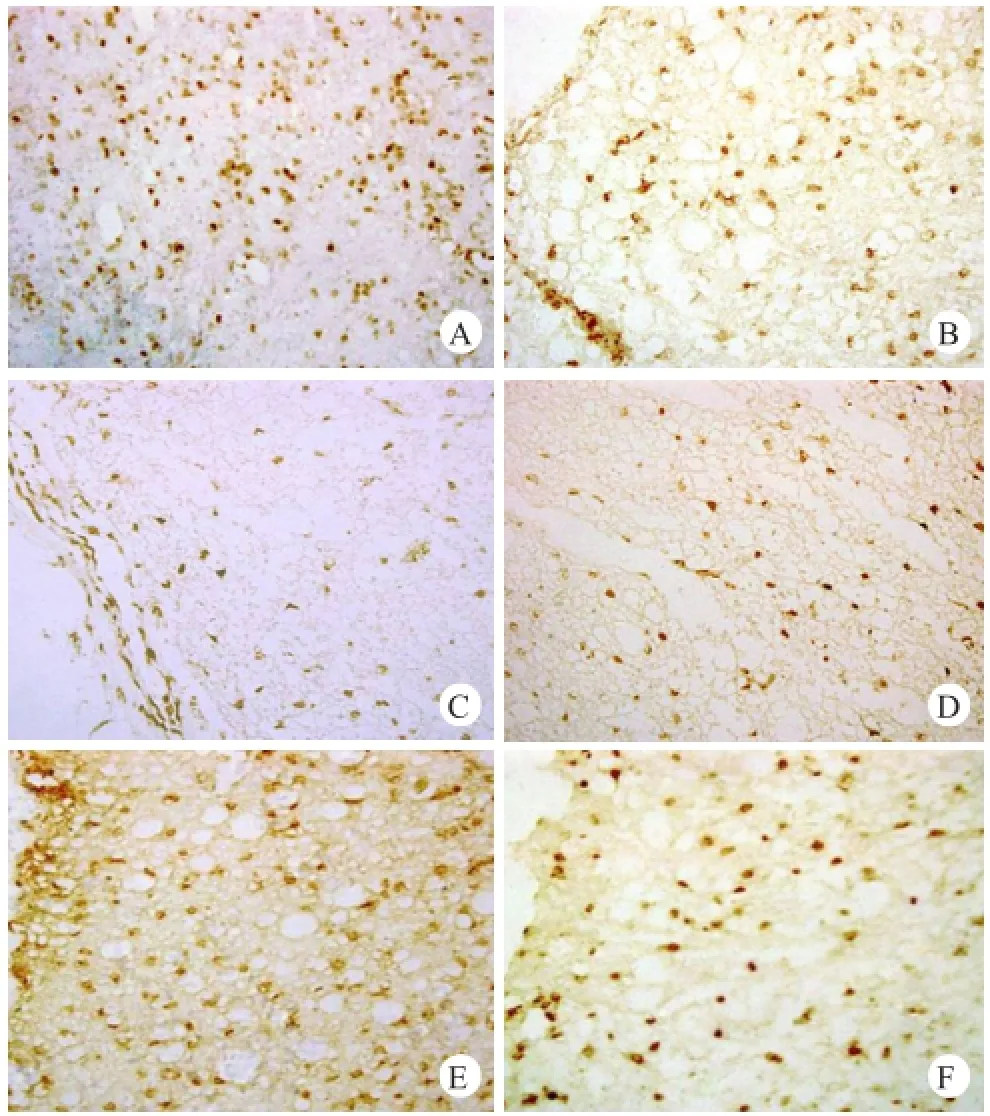
图3 Brdu+免疫组化结果
B组植入BMSCs后3 d(A)和21 d(B)的Brdu+细胞(200×);C组植入BMSCs后3 d(C)和21 d(D)的Brdu+细胞(200×);D组植入BMSCs后3 d(E)和21 d(F)的Brdu+细胞(200×)多于A组(表3),并可见到双染阳性细胞,但数量较少(图4)。
2.5 Brdu Brdu++NF-NF-200200免疫组化结果
A、B、C、D组在BMSCs移植后3~7 d NF-200表达增高并不明显,而且未见到双染阳性细胞。BMSCs移植后14 d开始,B、C、D组的MOD值较A组明显升高(表4)。经BMSCs移植的各实验组的轴突排列及再生情况要优于A组,而且染色要深。BMSCs移植后21 d可以观察到双染阳性细胞,但数量极少(图5)。
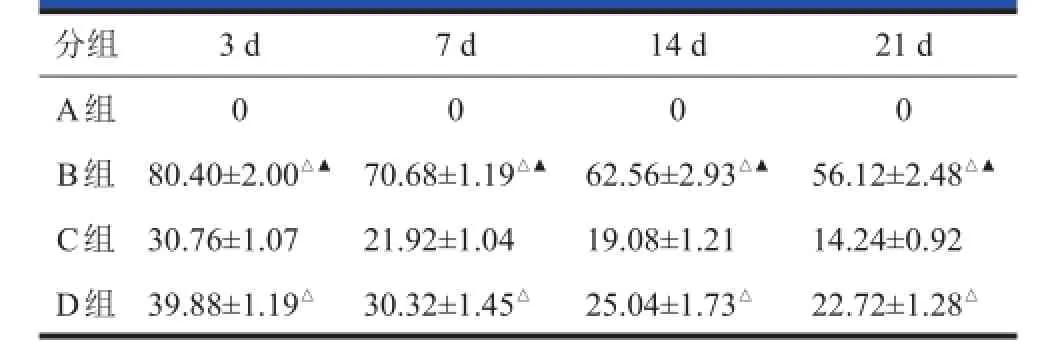
表2 各组大鼠BMSCs BMSCs移植后的细胞存活数比较(x x±s s,,n n==55)
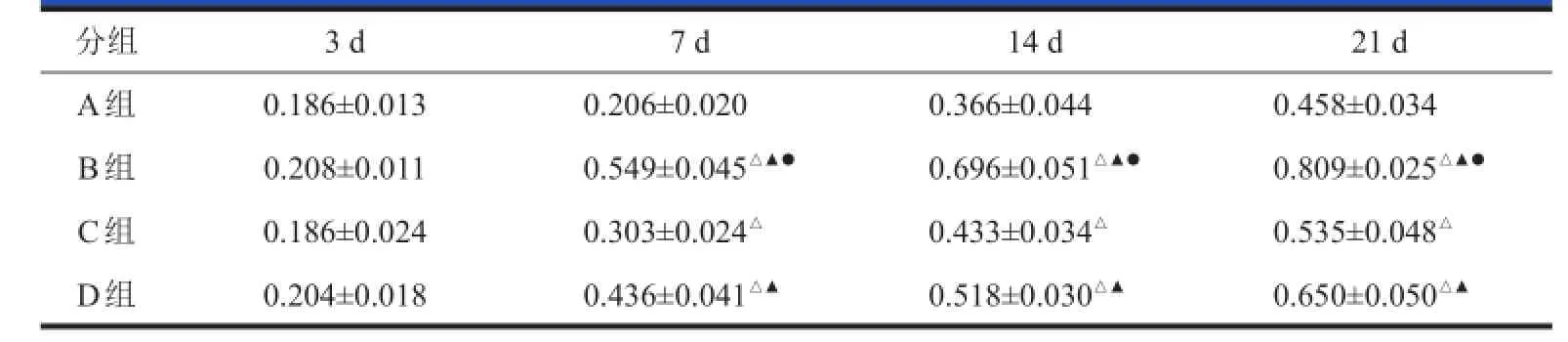
表3 BMSCs BMSCs移植后各组GFAP GFAP免疫组化MOD MOD值(x x±s s,,n n==55)

图4 Brdu+GFAP免疫组化结果
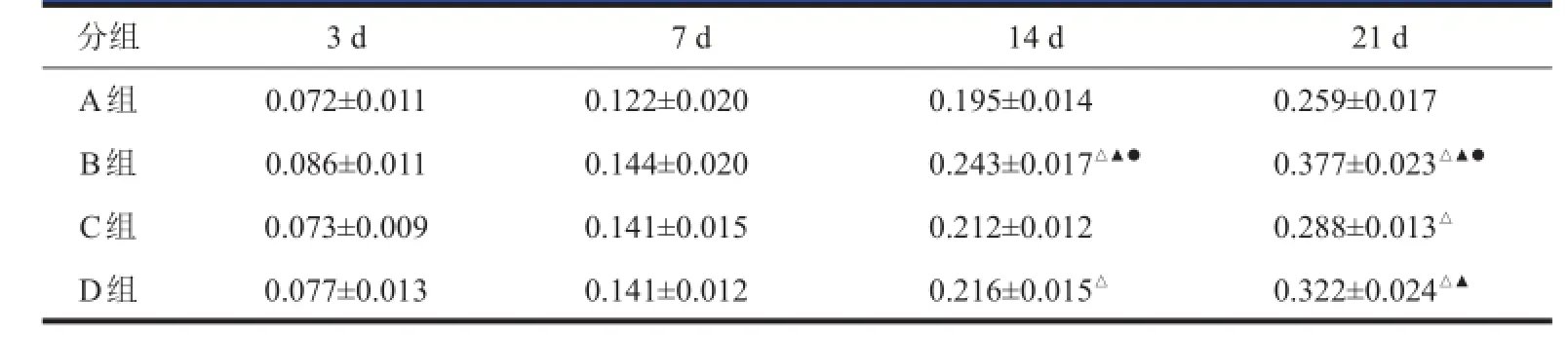
表4 BMSCs BMSCs移植后各组NF-NF-200200免疫组化MOD MOD值(x x±s s,,n n==55)
图5 Brdu+NF-200免疫组化结果
3 讨论
本实验通过全骨髓法分离、提取的BMSCs镜下呈梭形或纺锤形,漩涡状排列。第5代BMSCs经过流式细胞仪鉴定,结果显示CD90阳性率为98.17%,CD29阳性率为97.95%,CD45阳性率为0.06%,CD11b/c阳性率为0.84%,说明分离培养的细胞不是骨髓中的造血干细胞,而是BMSCs。
BMSCs移植后3 d,各实验组脊髓损伤大鼠的神经功能与对照组均有不同程度的恢复,但BBB评分无显著性差异,可能是移植时间比较短;BMSCs移植后7、14、21 d,各实验组较对照组恢复明显,表明BMSCs在脊髓损伤早期自然恢复基础上有效促进神经功能改善,且直接注射组效果最佳,而腰椎穿刺组又优于股静脉注射组,可能与脊髓损伤区的BMSCs数量有关。
BMSCs移植为脊髓损伤患者的治疗开辟了更为广阔的前景[13]。之前研究证实,BMSCs可以作为种子细胞进行移植,它既可以分泌神经营养因子也可以促进轴突的生长和再生[4,14]。BMSCs不仅可以向星形胶质细胞和神经元样细胞分化,而且还有助于脊髓损伤部位GFAP和NF-200的表达。各实验组GFAP和NF-200的MOD值在BMSCs移植后要优于对照组,且直接注射组效果最佳,而腰椎穿刺组又优于股静脉注射组。GFAP主要存在于星形胶质细胞中,它的增高表明星形胶质细胞增生、活化,可以分泌多种神经营养因子从而促进神经再生。但星形胶质细胞数目的过度增多又会产生胶质瘢痕,阻碍轴突穿过损伤区域。NF-200是神经元胞体和神经轴突
骨架的主要成分,它的表达增高提示神经元和轴突的再生、生长,有利于大鼠神经功能的恢复。脊髓空洞周边组织主要是由星形胶质细胞、少突胶质细胞还有一些神经轴突组成。上述说明BMSCs可以产生一些神经营养因子,有助于神经胶质细胞的修复、增殖和轴突的再生、生长。
实验中多采用脊髓损伤部位直接注射的方法进行BMSCs移植[15,16],这种方法能保证将BMSCs尽可能多地输送到脊髓损伤区域,但临床应用却受到限制。本实验中直接注射组的大鼠经细胞移植后出现双后肢瘫和尿潴留症状加重的现象,人工按摩膀胱排尿的时间比其他3组都有所延长,双后肢功能恢复情况在3 d后才基本与其他组相近。如果发生多节段脊髓损伤则需要多点注射,产生各种并发症的危险会更高,患者较难接受这种方法进行有效治疗。
在临床上迫切需要一种能被患者所接受的BMSCs移植途径,腰椎穿刺和血管内移植或许是不错的方法选择。血管内移植包括静脉移植[17]和动脉移植[18]两种途径,动脉注入BMSCs治疗SCI被脊髓的多节段动脉供血所限制,运用这一技术需要在动脉导管介入下才可能完成,有极高的选择性和技术上的挑战性。静脉移植的操作则更安全和简单,但它要经过机体血液循环和透过血脑屏障[19]才能到达中枢神经系统,首关效应会使肺、肝等脏器捕获大量细胞,致使到达损伤区的细胞数量有限。本实验采用同种异体细胞移植,模仿自体移植尽可能减少宿主免疫反应的发生,但一部分外源性BMSCs在宿主血液循环系统中不可避免会受到免疫细胞的攻击,引起机体免疫反应,一部分细胞被宿主的免疫系统所消除。经静脉移植BMSCs治疗大鼠SCI,提示BMSCs可迁移到脊髓损伤处,且可表达神经元和胶质细胞特异标志物——神经元特异核蛋白、胶质纤维酸性蛋白;同时也发现细胞迁移率不高,21 d时约占移植细胞的4.4%[20]。
本实验表明,股静脉注射途径在三种移植途径中到达脊髓损伤区的数量最少,腰椎穿刺途径的移植效率高于前者。部分BMSCs存活在受损脊髓组织的周边,还有一部分细胞分布在脊髓组织表面。BMSCs通过脑脊液进入受损脊髓节段,可能是受损脊髓组织释放某些趋化因子使细胞迁移到损伤部位,也可能是由于软脊膜的破坏细胞直接进入损伤部位。细胞进入到损伤部位的机制并不十分确切,需要进一步明确以提高细胞移植效率。本实验所得数据显示腰椎穿刺途径更为理想,但实验设计还需要进一步完善,因为实验动物数量有限,且BMSCs多向性分化及归巢机制不明确,所以结果不可避免地出现一些偶然因素。
综上,腰椎穿刺途径既可以消除局部直接注射带来的各种危险因素,也能避免股静脉注射的缺点,可作为细胞移植的最佳途径。
[1]Chopp M,LiY.Treatmentof neural injuryw ithmarrow stromal cells.LancetNeurol,2002,1(2):92-100.
[2]Jen-Tsung Yang,Yung-Chih Kuo,Keng-Hsien Chiu,et al. Peptide-modified inverted colloidal crystal scaffolds with bonemarrow stromal cells in the treatment for spinal cord injury.Colloids Surf B Biointerfaces,2011,84(1):198-205.
[3]Ide C,Nakai Y,Nakano N,et al.Bonemarrow stromal cell transplantation for treatmentof sub-acute spinal cord injury in the rat.Brain Res,2010,1332:32-47.
[4]Himes BT,Neuhuber B,Coleman C,etal.Recovery of function following grafting of human bonemarrow-derived stromal cells into the injured spinal cord.Neurorehabil Neural Repair,2006,20(2):278-296.
[5]Karimi-Abdolrezaee S,Eftekharpour E,Wang J,et al.Delayed transplantation of adult neural precursor cells promotes rem yelination and functionalneurological recovery afterspinalcord injury.JNeurosci,2006,26(13):3377-3389.
[6]Parr AM,Kulbatski I,Tator CH.Transplantation of adult rat spinal cord stem/progenitor cells for spinal cord injury.J Neurotrauma,2007,24(5):835-845.
[7]中华人民共和国科学技术部.关于善待实验动物的指导性意见.2006-09-30.
[8]Basso DM,Beattie MS,Bresnahan JC,etal.MASCIS evaluation of open field locomotor scores:effects of experience and teamwork on reliability.Multicenter Animal Spinal Cord Injury Study.JNeurotrauma,1996,13(7):343-359.
[9]Shahdadfar A,FronsdaIK,Haug T,etal.In vitro expansion of humanmesenchymalstem cells:choice of serum is a determ inant of cell proliferation,differentiation,gene expression,and transcriptome stability.Stem Cells,2005,23(9): 1357-1366.
[10]艾国平,梁永平,闫国和,等.骨髓间充质干细胞的分离和培养.第三军医大学学报,2001,23(5):553-555.
[11]Romanov YA,Darevskaya AN,Merzlikina NV,etal.Mesenchymal stem cells from human bonemarrow and adipose tissue:islation,characterization,and differentiation potentiaIities.Bull Exp BiolMed,2005,140(1):138-143.
[12]Woodbury D,Schwarz EJ,Prockop DJ,etal.Adult ratand human bone marrow stromal cells differentiate into neurons.JNeurosciRes,2000,61(4):364-370.
[13]Murray M.Cellular transplants:steps toward restoration of function in spinal injured animals.Prog Brain Res,2004, 143:133-146.
[14]Chiba Y,Kuroda S,Maruichi K,etal.Beneficial Effects of Bone Marrow Stromal Cell Transplantation on Axonal Regeneration in Injured Spinal Cord.Mol Imag Integrated Med Ther Drug Dev,2010,2:152-157.
[15]Ide C,Nakai Y,Nakano N,etal.Bonemarrow stromal cell transplantation for treatment of sub-acute spinal cord injury in the rat.Brain Res,2010,1332:32-47.
[16]Hofstetter CP,Schwarz EJ,Hess D,et al.Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery.Proc Natl Acad Sci U SA,2002,99(4): 2199-2204.
[17]Gensel JC,Donnelly DJ,Popovich PG.Spinal cord injury therapies in humans:an overview of current clinical trials and their potential effects on intrinsic CNS macrophages. ExpertOpin Ther Targets,2011,15(4):505-518.
[18]SykováE,JendelováP,UrdzíkováL,et al.Bonemarrow stem cells and polymer hydrogels--two strategies for spinal cord injury repair.CellMolNeurobiol,2006,26(7-8):1113-1129.
[19]Schoch HJ,Fischer S,Martih H.Hypoxis-induced vascular endothelial grow th factor expression causes vascular leakage in thebrain.Brain,2002,125(11):2549-2557.
[20]冯大雄,钟德君,宋跃明.静脉移植骨髓间充质干细胞在大鼠损伤脊髓中的存活与分化.中国脊柱脊髓杂志, 2006,16(7):527-531.
Grafting pathwaysof bonemarrow stromalcell transplantation for treatment of spinal cord injury in rats
ZHAO Xuezheng1,TANG Kai2*
(1.Departmentof Orthopedics,XixiHospitalof Hangzhou,Hangzhou 310023;
2.Departmentof Orthopedics,FirstHospitalof Dalian MedicalUniversity,Dalian 116011,Liaoning,China)
ords:Mesenchymal Stem CellTransplantation;SpinalCord Injury
2095-9958(2015)06-0 246-07
10.3969/j.issn.2095-9958.2015.03-012
*通信作者:唐开,E-mail:dltangkai@126.com

