146例不同分子亚型年轻乳腺癌的临床病理特征分析
段海明,陈 晶,王 娜,王闽全,欧江华
(1.新疆医科大学第二附属医院肿瘤外科,新疆乌鲁木齐 830063;2.新疆医科大学第一附属医院针灸推拿科,新疆乌鲁木齐 830054;3.新疆医科大学附属肿瘤医院乳腺外科,新疆乌鲁木齐 830011)
乳腺癌是威胁女性健康最常见的恶性肿瘤,其中年轻乳腺癌患者由于其发病年龄早,侵袭性强[1]等特点越来越受到临床上的广泛关注。本研究参考国际癌症研究署(IARC)乳腺癌流行病学调查的年龄界值,选择≤40岁以下患者为年轻乳腺癌研究对象,并以2011年St.Gallen国际乳腺癌会议上的专家共识为依据[2],按照免疫组织化学方法,将收集到的146例经术后病理诊断明确的浸润性年轻乳腺癌患者按其免疫组化结果分为Luminal A型,Luminal B型,HER-2过表达型及Basal-like型,旨在探讨不同分子亚型年轻乳腺癌的临床及病理特点。
1 资料和方法
1.1 一般资料 收集新疆医科大学附属肿瘤医院及新疆医科大学第二附属医院2012年1月—2014年4月间收治的40岁以下年轻乳腺癌患者共146例,均经过术后病理证实为浸润性乳腺癌,患者均为女性,年龄23~40岁,中位年龄36岁,占同期乳腺癌患者的13.6%(146/1 074)。
1.2 方法 患者乳腺癌组织ER(雌激素受体),PR(孕激素受体),HER-2(人表皮生长因子受体2),Ki-67(肿瘤细胞增殖相关核抗原)的免疫组化检测资料完整,ER,PR阳性病例判断标准为:细胞核内出现棕黄色颗粒为有效阳性细胞,且阳性细胞≥10%即为阳性病例;HER-2则依据肿瘤细胞膜的着色情况以及着色肿瘤细胞的百分比分为0,+,++,+++,其中(+++)≥30%记为阳性病例,其余均为阴性;Ki-67以肿瘤细胞核着色阳性细胞≥14%记为阳性[3-4];根据ER,PR,HER-2,Ki-67的免疫组化结果并参照2011年St.Gallen乳腺癌专家共识进行分子分型:Luminal A:[ER和(或)PR(+),HER-2(-),Ki67 <14%];Luminal B:[ER 和(或)PR(+),HER-2(-),Ki67≥14%]或[ER和(或)PR(+),HER-2(+)];HER-2 过表达型:[ER(-),PR(-),HER-2(+)];Basal-like 型:[ER(-),PR(-),HER-2(-)]。
1.3 观察指标 四种不同分子亚型年轻乳腺癌的分布比例,肿瘤最大径,病理类型,组织学分级,AJCC分期及淋巴结转移情况。
1.4 统计学方法 所有数据均采用SPSS17.0统计软件进行分析处理,观测资料主要为计数资料,根据数据性质选择卡方检验(普通资料)或秩和检验(等级资料);显著性水准α =0.05。
2 结果
表1为不同分子亚型年轻乳腺癌的临床病理特征的整体比较。统计结果显示:146例40岁以下浸润性乳腺癌患者中,Luminal A型24例;Luminal B型77例;HER2过表达型17例;Basal-like型28例。年轻乳腺癌各分子亚型在肿块大小(P<0.05)及组织学分级(P<0.01)方面有显著统计学差异,而在病理类型、淋巴结转移及AJCC(美国肿瘤联合会)分期方面的分布无统计学差异(P>0.05)。
对有显著意义的两项指标(肿块大小及组织学分级),再行进一步的组间比较。发现,HER2过表达型及Basal-like型的肿块均大于Luminal A型(P<0.05)和Luminal B型(P<0.05);而Luminal B型、HER2过表达型及Basal-like型的组织学分级均高于Luminal A型(P均<0.05),另外Basallike型的组织学分级高于Luminal B型(P<0.05,表2)。
3 讨论
乳腺癌是威胁女性健康最常见的恶性肿瘤,其发病率呈逐年上升趋势,且发病趋向年轻化。目前结合肿瘤分子分型的概念对于从本质上认识该疾病具有重要意义。根据2011年St.Gallen国际乳腺癌会议专家共识将其分为四种分子亚型:Luminal A型、Luminal B型、HER2过表达型及Basal-like型。
据国外文献报道年轻乳腺癌占全部乳腺癌的15%~25%[5],本研究中年轻乳腺癌占同期患者的13.6%(146/1074),其中Luminal A型24例,占16.4%;Luminal B型77例,占52.7%;HER2过表达型 17例,占 11.6%;Basal-like型28例,占19.2%。这与芦海亮等[6]报道Luminal A型发病率为60.8%,Luminal B型、HER2过表达型,Basal-like型分别为9.8%、3.5%、25.9%的结果有显著差异;而与李云芬[7]等报道的Luminal A型、Luminal B型、HER2过表达型及 Basal-like 型发病率分别为 8.2%、64.7%、16.7%、10.4%的结果相近。这种研究结论的差异主要是由于目前乳腺癌分子分型的标准尚不统一,以往大多数有关分子分型的文献报道中并未将Ki-67纳入分类标准,而2011年St.Gallen国际乳腺癌会议的专家共识在分类标准中制定了明确的Ki-67水准;另外由于新疆为多民族地区,本组资料中的研究对象分别来自汉族,维族,哈萨克族,回族等;不同民族,地域等因素也会对分子分型有一定影响[8]。
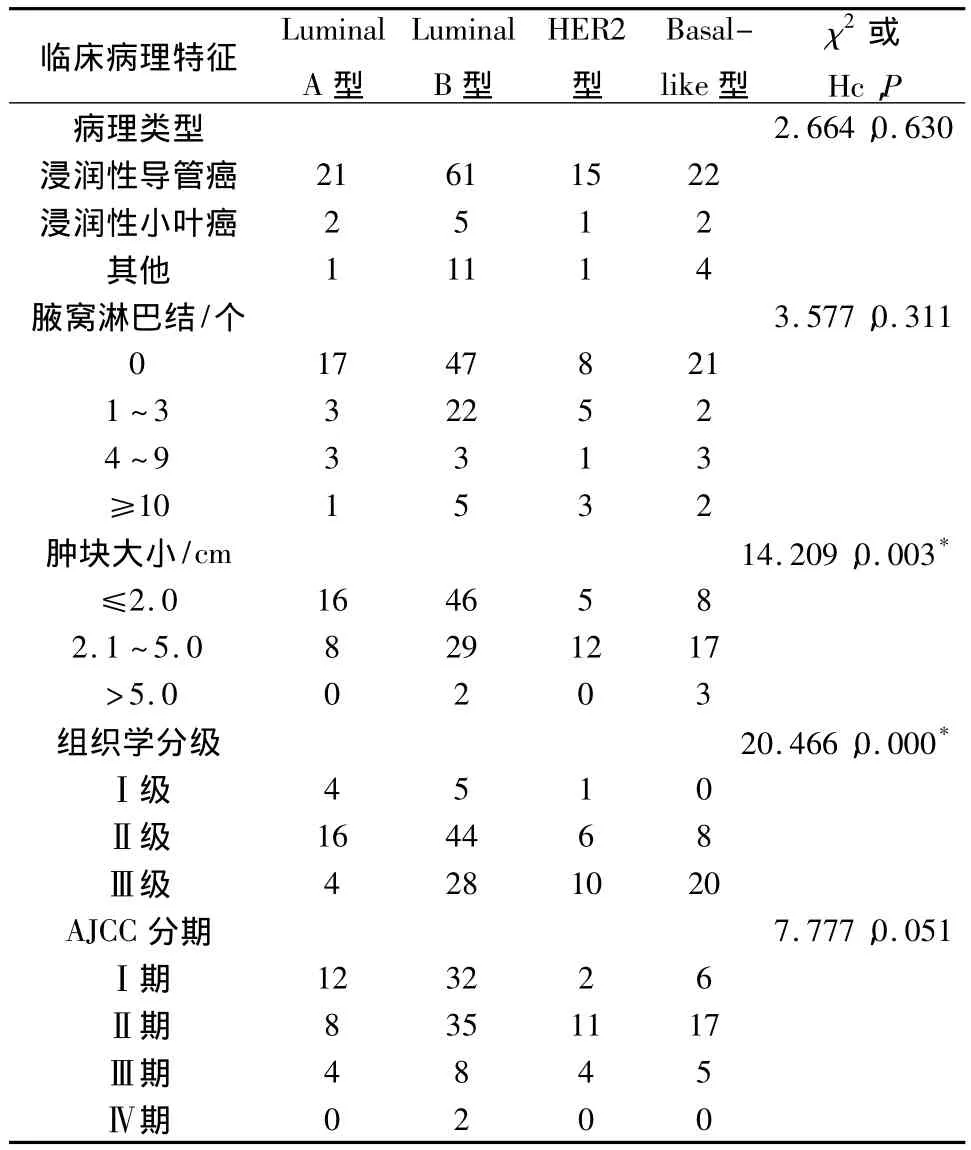
表1 不同分子亚型年轻乳腺癌的临床病理特征整体比较/例

表2 不同分子亚型年轻乳腺癌在肿块大小及组织学分级方面的组间比较(χ2,P)
本组资料显示年轻乳腺癌各分子亚型在临床病理特征方面的差别主要存在于肿块大小和组织学分级,这与魏志敏等[9]的研究报道相符。肿块大小方面:HER2过表达型的肿块大于 Lumina A型(P=0.02)和 Luminal B型(P=0.035),Basal-like型的肿块也大于 Lumina A 型(P=0.004)和Luminal B型(P=0.003),差异有统计学意义;组织学分级方面:Luminal B型(P=0.035)、HER2过表达型(P=0.008)、Basal-like型(P=0.000)的组织学分级均高于 Lumina A型,差异有统计学意义;另外Basal-like型的组织学分级高于Luminal B型(P=0.001)。
另外本组研究发现,在年轻乳腺癌患者中主要以Luminal B型和Basal-like型为主,分别占52.7%和19.2%。据国外文献报道Luminal B型乳腺癌[10]的早期复发风险远大于其他三种亚型,且被指定为是具有低孕激素受体,高扩散,激素治疗较差的Lumina A型[11],而且本研究显示Luminal B型的组织学分级高于Lumina A型(P=0.035),以Ⅱ级为主,占57.1%;而Basal-like型即基底细胞样型乳腺癌,特点是肿瘤细胞不表达ER、PR及HER2,本组资料显示在组织学分级方面Basal-like型以Ⅲ级为主,占71.4%,组间比较高于 Lumina A型(P=0.000)和 Luminal B型(P=0.001),差异有统计学意义。Luminal B型和Basal-like型的以上特点均与年轻乳腺癌肿瘤细胞异型性较大,侵袭性强,预后较差等特点相符。
相关研究显示HER2过表达型在原发性乳腺癌中约占20% ~30%[12],并且HER2基因突变导致其他信号因子及传导通路异常,致使乳腺癌危险增加。本组年轻乳腺癌患者中HER2过表达型17例,占11.6%,且肿块直径大于Luminal A型(P=0.02)和 Luminal B 型(P=0.035),差异有统计学意义;组织学分级以Ⅲ级为主,占58.8%,并且组织学分级高于Luminal A型(P=0.008)。这均与相关研究显示的其拥有最差的5年无病生存和总生存率的特点相符[13]。虽然此型患者所占比例较少,但却引起了各方的广泛关注,研究提示口服哺乳动物雷帕霉素靶蛋白抑制剂(依维莫司)可以增加HER2过表达型癌细胞对曲妥珠单抗的敏感性[13],这也将为HER2过表达型乳腺癌的治疗提供一种新的选择。
本研究未发现年轻乳腺癌各分子亚型在病理类型,淋巴结转移及临床分期方面有统计学差异。各亚型均以浸润性导管癌为主;淋巴结转移方面均以阴性或1~3个淋巴结转移为主,各组间比较无差异;临床分期方面Luminal B型、HER2过表达型、Basal-like型均以Ⅱ期为主,分别占45.4%、64.7%、60.7%;Luminal A 型以I期为主,占50%,但组间比较无统计学差异。目前通过综合的分子分型技术可使肿瘤的分类基础由形态学转向以分子特征为基础的新的肿瘤分类系统,这对于从本质上认识乳腺癌具有重要意义,但是对于侵袭性强,预后较差的年轻乳腺癌患者由于目前分子分型各项指标的检测方法和分类标准尚不统一,且本组资料样本量有限,故有关年轻乳腺癌不同分子亚型的临床病理特点及个体化治疗仍有待进一步临床研究。
[1]韦锦涛,黄文河,张国君.年轻乳腺癌的临床病理学特征与治疗策略[J/CD].中华乳腺病杂志(电子版),2013,7(4):41-46.
[2]Goldhirsch A,Wood WC,Coates AS,et al.Strategies for subtypesdealing with the diversity of breast cancer;highlight of the St.GallenInternational Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J].Ann Oncol,2011,22(8):1736-1747.
[3]谷重山,英 旻,何英剑,等.乳腺癌组织ER、PR、HER2免疫组织化学检测结果的可靠性探讨[J].中华医学杂志,2013,93(32):2571-2573.
[4]汪 勤,唐 曼,刘婷珽.免疫组织化学检测在乳腺病理诊断中的作用[J].安徽医药,2014,18(5):957-960.
[5]EI-Zaemey S,Nagi N,Fritschi L,et al.Breast cancer among Yemeni women using the National Oncology Centre Registry 2004-2010[J].Cancer Epidemiol,2012,36(3):249-253.
[6]芦海亮,王跃花,王丽霞,等.乳腺癌分子分型与临床病理特征的相关性研究[J].中国药物与临床,2013,13(4):498-499.
[7]李云芬,刘 倩,杨晓娟,等.云南省乳腺癌分子分型与临床病理特点分析[J].现代肿瘤医学,2014,22(3):561-563.
[8]秦鑫添,郝少欢,塔来古丽·西仁白克.新疆喀什维吾尔族与汉族乳腺癌患者分子分型的研究[J].中国肿瘤临床,2014,41(11):707-710.
[9]魏志敏,谷海燕,赵 洁,等.乳腺癌的分子分型与临床病理特征的关系[J].癌症进展,2010,8(6):622-625.
[10]Cancello G,Maisonneuve P,Rotmensz N,et al.Progesterone receptor loss identifies Luminal B breast cancer subgroups at higher risk of relapse[J].Ann of Oncol,2013,24(3):661-668.
[11]Creighton CJ.The molecular profile of luminal B breast cancer[J].Biologics,2012,6:289-297.
[12]Xue C,Wang X,Peng R,et al.Distribution,clinicopathologic features and survival of breast cancer subtypes in southern China[J].Cancer Sci,2012,103(9):1679-1687.
[13]MayerI.Role of mTOR inhibition in preventing resistance and restoring sensitivity to hormone-targeted and HER2-targeted therapies in breast cancer[J].Clin Adv Hematol Oncol,2013,11(4):217-224.

