早期应用艾司洛尔对LPS诱导脓毒症大鼠心功能的影响
王胤中,史克洁,穆心苇
(南京医科大学附属南京医院重症医学科,江苏南京 210006)
脓毒症是由感染所导致的全身性炎症反应,它在危重病人中有较高的发病率。事实上,脓毒症是全世界非冠心病重症监护病房主要的死亡原因[1]。在脓毒症过程中,机体的肾上腺素能使神经系统处于高度激活状态,加之纠正休克时使用的大量血管活性药物,使得内源性与外源性的儿茶酚胺产生叠加效应,首先,增快心率,增强心肌收缩力,但也增加了心肌氧耗;其二,激活的交感神经使IL-6和TNF-α的释放增加1 000倍[2],最终引起心肌损害,心功能受抑制。此前国内外已有大量的研究证实,脓毒症的患者往往伴有心功能受损。
此前β受体阻滞剂主要应用在心肌梗死、心力衰竭等心血管领域。近年来,有学者发现在围手术期、多发伤、烧伤等患者中应用β受体阻滞剂,可降低病死率,改善预后。
本实验旨在研究早期应用β1受体阻滞剂艾司洛尔的脓毒症大鼠模型,观察其心肌损伤标志物、心肌细胞β1、β2、β3受体亚型含量、心肌线粒体超微结构以及心肌病理形态学改变,以了解艾司洛尔对损伤心肌的保护作用,为临床脓毒症患者早期干预提供理论依据。
1 材料与方法
1.1 实验动物 清洁级健康雄性SD大鼠60只,体重(280±20)g,由南京医科大学附属南京医院动物实验中心提供并饲养,大鼠饲料及饮水均由该中心提供。
1.2 动物分组 按随机数字表法将大鼠分成:脓毒症组(LPS组)10只,LPS建立大鼠模型。
艾司洛尔组(ESM组)40只,LPS建立大鼠模型,按艾司洛尔给予时机及不同剂量分4个亚组,A1组:即刻给予低剂量艾司洛尔;A2:即刻给予高剂量艾司洛尔;B1组:6 h后给予低剂量艾司洛尔;B2:6 h后给予高剂量艾司洛尔。空白组(X组)10只,生理盐水注射。
1.3 主要试剂及药品 艾司洛尔(齐鲁制药有限公司 20130614),LPS(美国 sigma L2880),Tn-I试剂盒(美国 TSZ DL7757),CA试剂盒(美国 TSZ NH4898),NT-proBNP试剂盒(美国 TSZ MH4968),β1-AR试剂盒(美国 TSZ HU8366),β2-AR试剂盒(美国 TSZ HU7954),β3-AR试剂盒(美国 TSZ HU9613),全蛋白提取试剂盒(中国 凯基KGP2100),BCA蛋白含量检测试剂盒(中国 凯基KGPBCA)。
1.4 脓毒症动物模型的建立 购买的大鼠在实验中心饲养1周,建立LPS模型前放置右侧颈内静脉导管并保留用以输液。置管后单笼饲养,每日肝素盐水冲管。观察3 d后,大鼠进食正常,无死亡,确定静脉通路放置成功后再建立模型。LPS组及ESM组均给予LPS 10 mg·kg-1腹腔注射[3]。本实验中动物按照动物伦理学标准处置。
1.5 给药方案 所有大鼠均在开始实验时就给予生理盐水10 mL·kg-1·h-1持续泵入,共计12 h。A1组在给予LPS处理后立即经颈内静脉持续微量泵泵入艾司洛尔,剂量为10 mg·kg-1·h-1,使用6 h后停用;A2组艾司洛尔,剂量为20 mg·kg-1·h-1[4],使用6 h后停用。B1组在给予LPS处理6 h后经颈内静脉持续微量泵泵入艾司洛尔,剂量为10 mg·kg-1·h-1,使用6 h后停用;B2组艾司洛尔,剂量为20 mg·kg-1·h-1,使用6 h后停用。
1.6 样本采集及观察指标
1.6.1 心功能指标 采取和Guo等一样的方法进行心功能测定[5],本实验采用 VisualSonics,Vevo 2100超声仪,频率为21 MHz探头对大鼠行超声心动图检查。所有药物使用完毕1 h后,经气体异氟烷全麻后通过超声心动图测得心脏射血分数(EF%)及左室短轴缩短率(FS%)。
1.6.2 大鼠血清制备与贮存 自右侧颈内静脉脉取血4 mL,离心制备血清,置于-70℃低温冰箱保存,待行肌钙蛋白(TN-I)、儿茶酚胺(CA)、N 端脑钠肽前体(NT-proBNP)检测。均用 ELISA法检测,按试剂说明书操作。
1.6.3 大鼠心肌组织收集与贮存 取血后迅速打开胸腔,取出心脏,用预冷生理盐水冲洗干净后,滤纸吸干,无菌留取左室近心尖心肌组织迅速放入液氮冻存4 h,后取出保存于-70℃低温冰箱,用以制备组织匀浆,提取心肌全蛋白,并运用ELISA法检测心肌组织β受体亚型含量。
1.6.4 大鼠心肌组织的病理学检查 在LPS组、A1、B1、X组随机选取1只大鼠,另外再取近心尖心肌组织1块,4%多聚甲醛固定。标本石蜡包埋,切片,免疫组化,观察。
1.6.5 大鼠心肌线粒体的超微结构检查 在LPS组、A1、X组随机选取1只大鼠,另外再取近心尖心肌组织1块,2.5%戊二醛固定。锇酸固定,脱水,树脂包埋,超薄切片,电子染色,观察。
1.7 统计学方法 采用SPSS 20.0统计软件包,计量资料以均数±标准差(±s)表示,均通过正态性检验。多组间比较采用方差齐性检验和单因素方差分析。组间两两比较采用Student-Newman-Keuls检验。P<0.05表示差异有显著性。
2 结果
2.1 心功能指标 ESM各组较LPS组在EF%及FS%上均有好转,有统计学差异(P<0.001),但A1组与A2组之间、B1组与B2组之间EF%及FS%无统计学差异(P>0.05)(见表1)。由于艾司洛尔是超短效β1受体阻滞剂,半衰期只有9 min,本实验设计是停用药物1 h后测量心功能,此时艾司洛尔对于机体的直接作用已经消失,这时测量的心功能反映的是LPS及艾司洛尔共同作用后的结果。见图1~3。
表1 超声心动图测心功能(%,±s)
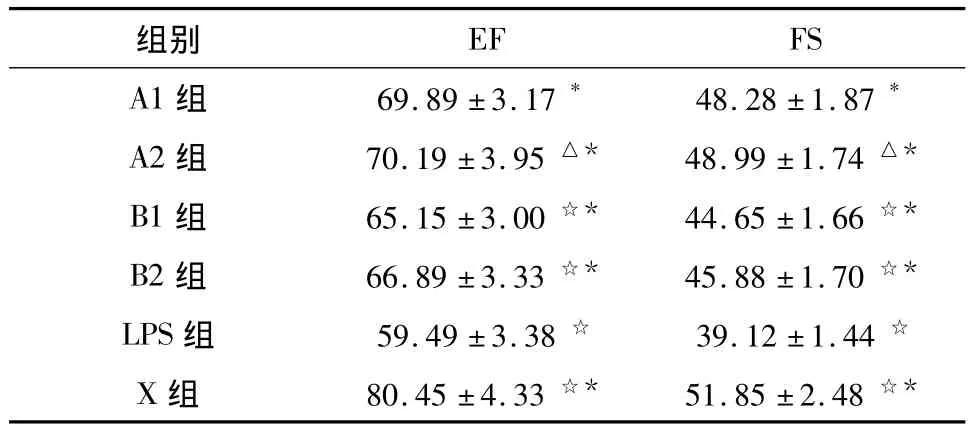
表1 超声心动图测心功能(%,±s)
注:A1组与其他组☆P<0.01,A1与其他组△P >0.05,LPS与其他组*P <0.001。
组别EF FS A1 组 69.89 ±3.17* 48.28 ±1.87*A2组 70.19±3.95 △* 48.99±1.74 △*B1组 65.15±3.00 ☆* 44.65±1.66 ☆*B2组 66.89±3.33 ☆* 45.88±1.70 ☆*LPS组 59.49±3.38 ☆ 39.12±1.44 ☆X 组 80.45±4.33 ☆* 51.85±2.48☆*
2.2 不同组别血清标志物的比较 与LPS组及ESM组与 X组大鼠在儿茶酚胺、TN-I、NT-proBNP浓度均有显著的统计学差异(P<0.001)。说明经过LPS的处理,大鼠儿茶酚胺浓度明显增加并出现了心肌损伤、心衰的现象。LPS组与ESM组在儿茶酚胺浓度上无统计学差异(P>0.05)。A组较B组在TN-I和 NT-proBNP浓度方面均有降低 (P<0.001),同时也发现在A2组较A1组两项指标有进一步降低的现象,这提示在本试验中高剂量的ESM可能对于减轻心脏损伤带来更好的作用。见表2。
表2 不同组别血清标志物浓度(μg·L-1,±s)
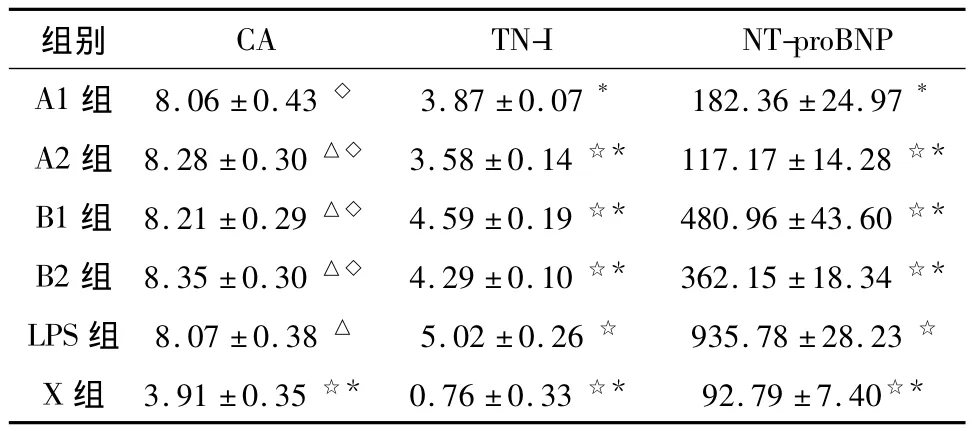
表2 不同组别血清标志物浓度(μg·L-1,±s)
注:A1组与其他组☆P<0.01,A1与其他组△P>0.05,LPS与其他组*P <0.001,LPS与其他组◇P >0.05。
组别CA TN-I NT-proBNP A1 组 8.06±0.43 ◇ 3.87±0.07* 182.36 ±24.97*A2组 8.28±0.30 △◇ 3.58±0.14 ☆* 117.17±14.28 ☆*B1组 8.21±0.29 △◇ 4.59±0.19 ☆* 480.96±43.60 ☆*B2组 8.35±0.30 △◇ 4.29±0.10 ☆* 362.15±18.34 ☆*LPS组 8.07±0.38 △ 5.02±0.26 ☆ 935.78±28.23 ☆X 组 3.91±0.35 ☆* 0.76±0.33 ☆* 92.79±7.40☆*
2.3 不同组别心脏β受体亚型的比较
2.3.1 β1受体含量 B组、LPS及X组β1均无统计学差异(P>0.05),而A组β1高于B组,有统计学差异(P<0.01),说明艾司洛尔使β1受体表达上调达到具有统计学意义需要6 h以上。同时也发现更高剂量的艾司洛尔可以带来更明显的β1受体上调。见表3。
2.3.2 β2受体含量 各组之间均没有统计学差异(P>0.05)。这也符合艾司洛尔是高选择性β1受体阻滞剂的药理特性。见表3。
2.3.3 β3受体含量 LPS组较X组β3有明显增加(P<0.01),ESM四亚组组间β3没有统计学差异(P>0.05),但ESM四亚组较LPS组β3均有减少,有统计学差异(P<0.01)。见表3。
表3 心脏β受体亚型含量 (ng·g-1**,±s)

表3 心脏β受体亚型含量 (ng·g-1**,±s)
注:**每1 mg全心肌蛋白提取物中β受体的含量;A1组与其他组☆P <0.01,A1组与其他组△P >0.05,LPS与其他组*P <0.01,LPS与其他组◇P >0.05。
组别 β1 β2 β3 A1组 1.77±0.11* 0.80 ±0.03 ◇ 0.62±0.07*A2组 1.88±0.11 ☆* 0.89±0.10 △◇ 0.64±0.07 △*B1组 1.51±0.06 ☆◇ 0.84±0.14 △◇ 0.64±0.08 △*B2组 1.48±0.06 ☆◇ 0.83±0.10 △◇ 0.58±0.06 △*LPS组 1.47±0.03 ☆ 0.88±0.15 △ 0.74±0.11 ☆X 组 1.45±0.05 ☆◇ 0.82±0.05 △◇ 0.46±0.04☆*
2.4 大鼠心肌免疫组化 β受体为细胞膜受体,β1的表达在A1组表达最为强烈,X组与LPS组没有明显差别。β2的表达在各组表达均没有明显差别。β3的表达在LPS组表达最为强烈,A1组其次,X组表达明显减少。从大鼠的免疫组化可以看出,与心肌组织ELSIA法测得β受体亚型的含量结果相一致。见图4~6。
2.5 大鼠心肌线粒体的超微结构 X组:线粒体呈圆形或卵圆形,基质电子密度正常,脊的数量正常,排列也正常。LPS组:线粒体肿胀,基质内有多个局灶性空泡,基质物质丢失。即刻低剂量ESM组:线粒体基质电子密度降低,脊移向周围,并变短及数量减少,线粒体体积增大。见图7~9。
3 讨论
近年来,脓毒症相关性心肌损伤受到越来越多的关注,不单单因为心脏是脓毒症的主要靶器官,而且心功能的变化与全身各脏器功能的变化紧密联系。一旦发生严重的心肌损伤,便导致心排减少,造成全身多脏器的低灌注,进一步引发多器官功能障碍(MODS)。因此降低脓毒症相关性心肌损伤关系到脓毒症治疗的成败。心力衰竭、感染性疾病、多器官损伤、重度中毒患者等危重病时均可以有TN-I低水平升高,往往提示并有心肌损伤。NT-proBNP是心室分泌的生物活性肽的前体,其生理作用是排钠排水,对于维持血容量的稳定有着至关重要的作用,对心衰发展起着重要的作用。心肌损伤的起始阶段,机体己经激活神经内分泌系统,NT-proBNP已经作为容量调节的重要一环参与机体的自身调节。故其可作为心力衰竭早期预警标志物。本研究中发现:X组大鼠与LPS组的TN-I和NT-proBNP浓度均有统计学差异(P<0.001)。说明经过LPS的处理,大鼠出现了心肌损伤。A组较B组TN-I和 NT-proBNP 浓度降低(P <0.001),同时也发现A2组较A1组TN-I和NT-proBNP浓度有进一步降低的现象,这提示在本试验中更高剂量的ESM可能对于减轻心脏损伤带来更好的作用。
以往的研究发现,严重的心肌梗死、心力衰竭、创伤,都会出现儿茶酚胺风暴,并对机体造成严重损害,而应用β受体阻滞剂可以降低交感神经兴奋性,可能带来更积极的结果。在脓毒症早期,已有广泛的交感神经系统被激活[6],在大多数死亡的感染性休克患者中可以观察到心肌损伤的病理学改变[7],但是国内没有应用β阻滞剂阻断脓毒症时的交感神经激活,从而改善脓毒症心功能相关报道。脓毒症时心肌细胞暴露于高水平的儿茶酚胺环境,机体会反射性的发生β受体的下调[8],表现为心肌细胞膜上β受体数量相对和绝对的减少,其受体下调的程度与疾病的严重程度呈正相关。随着20世纪对β受体阻滞剂在治疗心衰中的地位被显著提高,使得心衰的治疗发生了革命性改变,其作用机制既可以对抗高儿茶酚胺对心肌的毒性作用外,同时还可以上调β受体密度,抑制炎症因子的释放[9],减少心肌细胞凋亡。Schmittinger 等[10]首次提出应用肾上腺素能受体拮抗剂治疗脓毒症合并心肌抑制者,引起了业内的极大兴趣。
选择性β1受体阻滞药艾司洛尔,半衰期只有9 min,在治疗剂量时没有内在拟交感活性,具有很好的安全性。Suzuki等[4]研究发现,10 mg·kg-1·h-1和20 mg·kg-1·h-1两种剂量的艾司洛尔对脓毒症大鼠心脏均有保护作用。本实验:X组与B1组、B2组及LPS组β1受体均无统计学差异(P>0.05)。而与A1组及A2组β1受体有统计学差异(P<0.01)。说明艾司洛尔使β1受体表达上调达到具有统计学意义需要6 h以上。同时也发现更高剂量的艾司洛尔可以带来更明显的β1受体上调。由于艾司洛尔是高选择性β1受体阻滞剂。故对于β2受体,各组均无统计学差异。以往在心力衰竭时发现,随着儿茶酚胺浓度升高,β3受体被激活,β3受体表达较β1受体和β2受体明显,Balligand[11]发现,在人类的几种心肌病,β3受体表达是增加的,并引起心肌重塑。本实验我们也发现:A1组、A2组、B1组、B2组四个亚组间β3受体比较,无统计学差异(P>0.05),但四组与X组及LPS组β3两两之间均有统计学差异(P<0.01)。LPS组较X组β3受体有明显增加,但给予艾司洛尔后,β3受体含量均有下降。β3受体的下调可能是由于β1受体上调带来的竞争效应。由于在心血管系统中,β3受体可介导心肌负性变力效应及血管平滑肌舒张作用。故β3受体的下调,可能对于减轻心肌损伤带来有益的作用。另外Ackland等[12]发现,β阻滞剂的负性频率作用,使心率减慢,延长了舒张期,改善了氧平衡;β阻滞剂抑制交感神经活性,抑制炎症因子释放。改善血流动力学,提高了心功能。
综上所述,脓毒症时应用β1受体阻滞剂艾司洛尔,上调β1受体表达,下调β3受体含表达,改变了脓毒症时心肌β受体亚型的比例,这一点通过心肌的免疫组化也得到证实;减轻了心肌线粒体的损伤,改善心肌的能量代谢,从而增强了心功能[13]。本实验为动物实验,其临床效果有待进一步确定。
[1]Romero PC,Hernández PG.Initial resuscitation bundle and monitoring tissue perfusion in severe sepsis[J].Rev Med Chil,2013,141(9):1173-1181.
[2]De Vries F,Leuschner J,Jilma B,et al.Establishment of a low dose canine endotoxemia model to test anti-inflammatory drugs:effects of prednisolone[J].Int JImmunopathol Pharmacol,2013,26(4):861-869.
[3]Bian Y,Zhao X,Li M,et al.Various roles of astrocytes during recovery from repeated exposure to different doses of lipopolysaccharide[J].Behav Brain Res,2013,253:253-261.
[4]Suzuki T,Morisaki H,Serita R,et al.Infusion of the beta-adrenergic blocker esmolol attenuates myocardial dysfunction in septic rats[J].Crit Care Med,2005,33(10):2294-2301.
[5]Guo J,Wang SB,Yuan TY,et al.Coptisine protects rat heart against myocardial ischemia/reperfusion injury by suppressing myocardial apoptosis and inflammation[J].Atherosclerosis,2013,231(2):384-391.
[6]Booth LC,Ramchandra R,Calzavacca P,et al.Role of prostaglandins in determining the increased cardiac sympathetic nerve activity in ovinesepsis[J].Am J Physiol RegulIntegr Comp Physiol,2014,307(1):75-81.
[7]Schmittinger CA,Dünser MW,Torgersen C,et al.Histologic pathologies of the myocardium in septic shock:a prospective observational study[J].Shock,2013,39(4):329-335.
[8]Rudiger A.Beta-block the septic heart[J].Crit Care Med,2010,38(10):608-612.
[9]Ibrahim-ZadaI,Rhee P,Gomez CT,et al.Inhibition of sepsis-induced inflammatory response by β1-adrenergic antagonists[J].J Trauma Acute Care Surg,2014,76(2):320-327.
[10]Schmittinger CA,Dünser MW,Haller M,et al.Combined milrinone and enteral metoprolol therapy in patients with septic myocardial depression[J].Crit Care,2008,12(10):99-108.
[11]Balligand JL.Beta3-adrenoreceptors in cardiovasular diseases:new roles for an“old”receptor[J].Curr Drug Deliv,2013,10(1):64-66.
[12]Ackland GL,Yao ST,Rudiger A,et al.Cardioprotection,attenuated systemic inflammation,and survival benefit of beta-1-adrenoceptor blockade in severesepsis in rats[J].Crit Care Med,2010,38(2):388-394.
[13]Hagiwara S,Iwasaka H,Maeda H,et al.Landiolol,an ultrashortacting beta1-adrenoceptor antagonist,has protective effects in an LPS-induced systemic inflammation model[J].Shock,2009,31(5):515-520.

