皮肤屏障与皮肤病
张 媛 刘 永 颜 敏 孙 莉李 娟
·基层园地·
皮肤屏障与皮肤病
张 媛 刘 永 颜 敏 孙 莉∗李 娟
皮肤屏障功能可分为物理屏障、化学/生物化学抗菌屏障及免疫屏障,其在某些皮肤病的发病中起重要的作用,本文主要就皮肤屏障结构功能及与某些皮肤病的关系进行总结介绍。
皮肤屏障; 皮肤病
皮肤位于人体体表最外层,具有屏障、吸收、分泌、排泄、代谢、免疫、体温调节及感觉等功能。其中皮肤的屏障功能至关重要,一方面具有对外界机械性、物理性、化学性、微生物等刺激的防护作用,保护体内组织器官,另一方面可防止体内营养物质、水分等的丢失。1皮肤屏障功能又可分为物理屏障、化学/生物化学抗菌屏障及免疫屏障。其中物理屏障的基础为角质细胞层;化学/生物化学抗菌屏障包括固有免疫屏障、脂质、局部酸碱状态、溶解菌素、抗菌肽等;免疫屏障包括体液免疫及细胞免疫。2表皮通透屏障及角质层含水量是反映表皮屏障功能的重要指标,经皮水分丧失量(TEWL)越高,角质层含水量降低越显著,表面皮肤屏障功能受损越严重。
1 皮肤屏障的主要结构和功能
1.1 皮脂膜 为覆盖于皮肤表面的一层透明薄膜,又称水脂膜。主要由皮脂腺分泌的皮脂、角质层细胞崩解产生的脂质与汗腺分泌的汗液乳化形成,呈弱酸性,其主要成分为神经酰胺、角鲨烯、亚油酸、亚麻酸及脂质成分。皮脂膜对角质形成细胞具有营养作用,也是高效的水分屏障,其弱酸性环境可抑制化脓菌及皮肤癣菌的定植,具有一定抗炎作用。3
1.2 抗菌肽及微生态 抗菌肽(AMPs)构成的化学屏障和微生态构成的生物屏障是维持人体健康状态的重要保障。抗菌肽是具有抗菌活性的小分子阳离子多肽,具有高效的杀菌能力、广谱的抗菌活性及抗氧化作用,还具有多种免疫调节活性,在宿主抵抗病原侵入中起着非常重要的作用。人类的抗菌肽主要包括抗菌素及防御素两大家族。迄今为止,人类发现1800多种不同来源的抗菌肽,其中在皮肤中表达有20余种。4抗菌肽具有高度保守性。LL-37是迄今为止在人体内发现的唯一的抗菌素家族抗菌肽。由角质形成细胞表达、释放和分泌其前体肽-人阳离子抗菌肽-18(human cationic antimicrobial peptide-18,hCAP-18),经蛋白酶酶解后具有生物活性。LL-37具有快速、广谱和有效地抗菌活性。防御素可分为3类,分别为α、β、θ防御素,其中人类β防御素(human β-defensins,HBD)中的4种由上皮细胞产生,分别为HBD1~4。抗菌肽与许多皮肤病的关系越来越受重视。目前认为抗菌肽的表达可分为结构性表达和诱导性表达,并且其表达的功能受多种因素影响。在正常皮肤角质形成细胞中抗菌肽呈低表达,在感染或皮肤屏障破坏的情况下被大量诱导表达。研究发现,IL-1α和IL-6可诱导角质形成细胞表达LL-37,IL-1β可诱导角质形成细胞表达HBD-2。5
皮肤微生态系皮肤正常微生物群与宿主、环境之间的生态体系。研究表明,皮肤常驻菌具有占位保护作用,层次有序地定植在皮肤上,犹如一层生物屏障,使致病菌及外来菌无法立足于皮表。多达20%的常驻菌可产生抑制病原菌的化合物,如革兰阳性共生菌,包括乳酸杆菌、链球菌、葡萄球菌,可产生杀菌素,表皮葡萄球菌可产生一种抗菌肽酚可溶性调控蛋白,对金黄色葡萄球菌、A组链球菌具有选择性杀灭作用。6同时常驻菌可将皮脂甘油三酯分解为脂肪酸,形成乳化皮脂膜。正常皮肤微生态不仅存在皮肤表面,在真皮和脂肪组织中也能检测到细菌,这些皮肤的正常共生菌与基底膜下方的宿主细胞之间进行相互接触、信息交流。有研究表明,7在人生早期阶段及时建立正常皮肤微生物群,对于阻止外来感染性微生物的入侵具有重要作用,有助于建立皮肤的稳态和调节炎
症反应,并可显著影响皮肤免疫功能的发育。尽管正常皮肤微生物群在不同个体或同一个体的不同部位存在差异,但在局部皮肤处于相对平衡状态。正常微生物群失衡与多种皮肤病的发生有密切的关系。
1.3 角质层 角质层由5~15层细胞核和细胞器消失的扁平角质细胞和薄层脂质层组成,有学者形象地将角质层比喻为“砖墙结构”,角质形成细胞为砖块,而灰浆则指角质细胞间隙中的基质。维持和保证角质形成细胞和基质两个组分及其功能的正常,才能确保皮肤的完整性、正常的水合作用和老化角质形成细胞的脱落。
1.4 角质形成细胞 角质形成细胞在从基底层向上移行到角质层过程中,细胞器和细胞核消失,细胞膜间发生广泛的交联,形成不溶性的坚韧外膜--角质细胞角化套膜(CE)。CE由蛋白包膜和脂质包膜两部分构成,其间还有一些酶。角质细胞的有序排列是表皮抵御外界机械刺激的重要因素。蛋白包膜中与保湿最相关的是中间丝聚合蛋白(FLG),由颗粒层释放至细胞间隙,其逐渐降解形成的各种氨基酸及其它降解产物是天然保湿因子(natural moisturizing factor,NMF)的重要组成部分。NMF维持皮肤正常弹性和渗透性,调节角质层的水合功能,是参与减少皮肤经皮水分丢失的重要生物分子。皮肤干燥时其物理性状会发生改变,这种变化被神经末梢感受器感受产生瘙痒症状。8在角质形成细胞中最重要的酶是转谷氨酰胺酶1(transglutaminase1,TGase1),其活性与水有关。干燥缺水的皮肤使酶的活性减弱或失活,TGase1功能受影响,包膜蛋白前体交联障碍、CE形成不坚固,影响皮肤抗外界机械性的能力,降解角质细胞桥粒的水解酶受影响,角质形成细胞在皮肤表面堆积形成干性皮肤。9酶的失活进一步影响γ-谷氨酰胺、神经酰胺和脂肪酸的脂化,使得原先柔软的角质形成细胞脂质膜僵硬、易脆,角质形成细胞间的黏附力下降,皮肤变得粗糙、脱屑。8,10
1.5 脂质 脂质的异常可降低皮肤的储水保湿功能,也直接影响角质形成细胞的生长与分化调节,影响健康角质层的形成。角质层厚度约为13 nm,由3层组成,呈“三明治”样,第一层及第三层由晶状体网格结构组成,中间为液相,由类脂构成,主要包括等量的神经酰胺、不饱和脂肪酸及胆固醇。“三明治”结构在角质层的保湿、保护方面起重要作用。11
1.6 棘层、颗粒层和透明层 表皮层中有核细胞构成的部分对屏障功能同样重要,用胶带粘去表皮的角质层后,经皮水分丧失量(TEWL)约为低到中度,只有整个表皮全部丧失,才会导致严重的屏障功能障碍。其中研究最多的是角化桥粒、板层小体在皮肤屏障中的作用。12在基因突变、皮肤pH值变化、尘螨分泌的外源性蛋白酶等作用下,角化桥粒降解,导致皮肤脱屑,皮肤屏障功能受损。13另外透明层和颗粒层中酸性磷酸酶、疏水性磷脂和溶酶体等构成一个水屏障,使水分既不易从体外渗入,也阻止了角质层下水分的外渗。
1.7 基底层 仅为一层柱状或立方状的基底细胞构成,与基底膜带垂直排列成栅栏状。基底层的角质形成细胞表达水通道蛋白(AQP3),它是一个完整的跨膜蛋白通道,分子量为28 kDa。体内循环中的水分和甘油可以通过AQP3到达表皮,促进角质层的水合作用,与皮肤保湿功能有关。14正是由于AQPS的存在,细胞才可以快速调节自身体积和内部渗透压,转运水、尿素和甘油等物质进入皮肤,成为维持皮肤水合作用的一个关键因素。
2 皮肤屏障与某些皮肤病
皮肤疾病的形成通常被视为炎症的结果,但屏障功能受损在湿疹、特异性皮炎、痤疮等多种疾病发病机制中起关键作用。
在皮肤屏障的完整性遭到破坏或受到感染、炎症刺激时,就会诱导AMPS的表达,AMPS通过直接作用或激活免疫系统等反应防止感染的发生。另外,AMPS在发挥抗菌作用的同时也启动或扩大炎症反应而加重疾病。皮肤微生态在维持皮肤微生物平衡、自净,构成微生物屏障及参与皮肤诸多生理功能等方面起重要作用。当生态失衡时,它们又成为条件致病菌,导致炎症性病理过程的发展。皮肤抗菌肽与微生态之间是相互调节的动态平衡关系。
正常微生物群失衡与多种皮肤病的发生有密切关系。如研究发现痤疮患者和健康人鼻部痤疮杆菌的相对丰度差异无统计学意义,但其核糖体型菌株类型上存在差异,在痤疮患者中4型核糖体(RT4)和5型核糖体(RT5)痤疮丙酸杆菌菌株占优势,而6型核糖体(RT6)痤疮丙酸杆菌则主要见于正常人群中。这种现象在菌株水平证实了共生菌痤疮丙酸杆菌的不同菌株在痤疮发病中的作用,提示痤疮的治疗有必要强调针对微生态的调整,而非采用抗生素以杀灭所有痤疮丙酸杆菌。15
表皮炎症反应和免疫应答在皮肤疾病的发生机制中也有很大影响。如银屑病皮损处角质形成细胞能分泌一系列趋化中性粒细胞和Th1的细胞因子,而IL-1α,IL-6和IFN-γ等可以调节白细胞和淋巴细胞中LL-37的转录与分泌,16所以银屑病患者表皮浅层LL-37与HDB-2表达明显升高,且LL-37的抗金黄色葡萄球菌活性与HBD-2有协同作用。这能一定程度上解释银屑病患者存在着表皮损伤而较少发生皮肤感染的原因。同时抗菌肽是一把双刃剑,它们在防御感染的同时扩大了炎症反应,导致疾病加重。在银
屑病患者中,LL-37可进入树突状细胞,引发TLR9介导的IFN-α表达,激活自身反应细胞Th1和Th17,导致银屑病进一步加重。17
表皮的中间丝相关蛋白经蛋白水解酶作用发生降解,释放游离氨基酸吡咯烷羧酸和尿甘酸,前者可以维持角质层,后者在吸收UVB中发挥作用。表皮屏障功能的变化会直接影响对紫外线的吸收,导致皮肤病变。另有研究表明,紫外线可导致AQP3表达下调,从而损伤皮肤的屏障功能,诱发皮肤病变。18
湿疹是一种炎症性皮肤疾病,临床上表现为多形性皮疹,剧烈瘙痒,易复发,是由多种内外因素共同引起的一种迟发型超敏反应,而皮肤屏障功能的缺陷在湿疹发病中起重要的作用。1
首先,外源性刺激物可直接破坏皮脂膜,严重时损伤角质层细胞,导致角质层细胞间水肿,使得细胞间隙增大,皮肤“砖墙”结构不稳定,破坏了原有皮肤屏障,经皮失水增多;刺激物还可引起局部炎症反应,炎性细胞浸润,影响皮肤正常代谢,使得脂质、天然保湿因子及抗炎因子减少,皮肤变得干燥、脱屑,更易敏感。但这与刺激物的强度、接触时间及接触量有关。随后这些刺激物渗透入表皮层,损坏角质细胞质膜,板层(Odland)小体形成受阻碍,皮肤屏障功能减退。这些改变均为各种微生物及抗原进入体内提供了入口途径。一些化学性洗涤剂、金属银、汞等也可以去除角质细胞层的脂质,干扰脂质的结构。所以通常刺激性皮炎的发生要先于变应性接触性皮炎。Elias等提出的湿疹发病机制新理论“由外而内,再由内而外”,即基于这种规律。19由于皮肤屏障受损,皮肤抵抗外界刺激能力下降,还容易继发感染。研究发现,湿疹患者与其工作环境及所接触物有明确的关系。另外,由于遗传或年龄等因素,湿疹患者皮肤FLG蛋白表达减少,天然保湿因子含量降低,屏障功能减退。同时皮肤干燥会增加局部皮肤对炎症的反应,因此洗浴刺激也是湿疹发病的风险因素之一。20频繁洗浴可减少皮肤表面的脂质,而适当的外用皮肤保湿剂可显著降低湿疹患者的瘙痒症状。
湿疹患者皮肤表面的抗菌肽及微生态也有显著变化。在过敏原刺激引起的湿疹中,免疫反应主要为Th2型细胞因子模式,表现为高IgE水平和嗜酸粒细胞增多,IL-4、IL-10和IL-13的过度表达,高IL-4和IL-13对HBD-2和HBD-3有抑制作用,此外,IL-4和IL-13通过激活信号传导蛋白和转录激活物-6直接作用于角质形成细胞,降低HBD和LL-37的表达。21,22而抗菌肽在促进皮肤损伤愈合、预防皮肤感染等起重要作用。不过,AMPS在湿疹发病中的机制仍有待进一步研究。
微生物可通过变态反应或非变态反应引起湿疹。如金黄色葡萄球菌产生的a毒素,可直接引发或加重湿疹。而其本身的蛋白、多糖、毒素或代谢产物可作为变应原致敏机体,也可通过毒素或酶造成表皮损伤或激活表皮细胞而引发炎症反应。特异性皮炎患者发作时金黄色葡萄球菌比基线时或治疗后明显增多,并与疾病严重密切相关。治疗后,链球菌属、丙酸菌属、棒状菌属均增加。23提示特应性皮炎的发病可能与皮肤正常微生物群结构改变和失衡有关。而湿疹的临床表现与特异性皮炎极为相似。局部感染可以因为湿疹样皮炎,这些均提示微生态在湿疹发病中的作用,但其作用机制还待进一步研究。
此外湿疹治疗时多选用糖皮质激素类外用药物治疗,糖皮质激素不但可以破坏正常皮肤微生态,过量外用糖皮质激素可抑制表皮脂类的合成,抑制板层体的形成和分泌,导致复层板层结构形成障碍,延缓皮肤屏障功能的恢复,使皮肤经表皮水分流失增加。因此糖皮质激素对皮肤屏障功能的影响是负面的。
由此可见,湿疹患者的皮肤屏障与正常人皮肤屏障功能有很大差异,在治疗时也可造成皮肤屏障的损伤,导致湿疹的加重或反复。所以在湿疹治疗中,保护和重建皮肤屏障显得格外重要。
1赵辨.中国临床皮肤病学.南京:江苏科学技术出版社,2009. 725-731.
2 Proksch E,Folster-Holst R,Jensen JM,et al.Skin barrier function,epidermal proliferation and differentiation in eczema.J Dermatol Sci,2006,43(3):159-169.
3何黎.重建皮肤屏障在湿疹治疗中的重要性.皮肤病与性病,2009,31(3):12-13
4 Lai Y,Gallo RL.AMPed up immunity:how antimicrobial peptides havemultiple roles in immune defense.JTrends Immunol,2009,30(3):131-141.
5 Erdag G,Morgan JR.Interleukin-1alpha and interleukin-6 enhance the antibacterial properties of cultured composite keratinocyte grafts.Ann Surg,2002,235(1):113-124.
6 Cogen AL,Yamasaki K,Sanchez KM,et al.Selective antimicrobial action is provided by phenol-soluble modulins derived from Staphylococcus epidermidis,a normal resident of the skin. J Invest Dermatol,2010,130(1):192-200.
7Capone KA,Dowd SE,Stamatas GN,etal.Diversity of the human skinmicrobiome early in life.J Invest Dermatol,2011,131 (10):2026-2032.
8 Elias PM.Stratum corneum defensive functions:an integrated view.J Invest Dermatol,2005,125(2):183-200.
9 Yang JM,Ahn KS,Cho MO,et al.Novel mutations of the transglutam inase 1 gene in lamellar ichthyosis.J Invest Dermatol,2001,117(2):214-218.
10何黎.皮肤屏障与保湿.实用医院临床杂志,2009,3(6):25-27.
11 Bouwstra J,Pilgram G,Gooris G,et al.New aspects of the skin barrier organization.Skin Pharmacol Appl Skin Physiol,2001,14(Suppl 1):52-62.
12林宗贤,项蕾红.皮肤屏障功能研究进展.国际皮肤性病学杂志,2008,34(6):371-373.
13 Ishida-Yamamoto A,Kishibe M.Involvement of corneodesmosome degradation and lamellar granule transportation in the desquamation process.Med MolMorphol,2011,44(1):1-6.
14 Hara-Chikuma M,Verkman AS.Physiological roles of glycerol-transporting aquaporins:the aquaglyceroporins.Cell Mol Life Sci,2006,63(12):1386-1392.
15 Fitz-Gibbon S,Tomida S,Chiu BH,et al.Propionibacterium acnes strain populations in the human skinm icrobiome associated with acne.J Invest Dermatol,2013,133(9):2152-2160.
16 Heilborn JD,Nilsson MF,Kratz G,et al.The cathelicidin anti-microbial peptide LL-37 is involved in re-epithelialization of human skin wounds and is lacking in chronic ulcer epithelium. J Invest Dermatol,2003,120(3):379-389.
17 Ma HL,Liang S,Li J,et al.IL-22 is required for Th17 cellmediated pathology in amousemodel of psoriasis-like skin inflammation.JClin Invest,2008,118(2):597-607.
18Cao C,Wan S,Jiang Q,et al.All-trans retinoic acid attenuates ultraviolet radiation-induced down-regulation of aquaporin-3 and water permeability in human keratinocytes.JCell Physiol,2008,215(2):506-516.
19 Elias PM,Hatano Y,Williams ML.Basis for the barrier abnormality in atopic dermatitis:outside-inside-outside pathogenic mechanisms.J Allergy Clin Immunol,2008,121(6):1337-1343.
20兰宇贞,李邻峰.洗浴刺激在泛发性湿疹发病中的作用.中国麻风皮肤病杂志,2008,24(5):346-348.
(收稿:2014-04-01 修回:2014-05-03)
·病例报告·
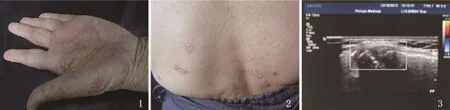
图1 左手掌红斑伴有干涸性脓疱、脱屑 图2 腰部散在红斑、鳞屑 图3 超声:(右侧胸锁关节)可见关节囊扩张,囊内可见不匀质低回声,关节骨皮质回声毛糙,可见侵蚀迹象。CDFI显示血流信号丰富
讨论 SAPHO综合征即滑膜炎(synovitis)、痤疮 (acne)、脓疱病(pustulosis)、骨肥厚(hyperostosis)、骨髓炎综合征(osteomyelitis)。1诊断标准2:①多病性骨髓炎,伴或不伴有皮肤表现;②急慢性无菌性关节炎,伴有脓疱型银屑病、掌跖脓疱病或痤疮;③无菌性骨炎伴有一种特征性的皮肤损害。符合以上三个条件之一即可诊断为SAPHO综合征。本病的特征性临床表现为皮肤损伤伴骨关节病变。皮肤表现:①脓疱病:掌跖脓疱病、脓疱型银屑病;②痤疮:聚合性痤疮、暴发性痤疮、毛囊闭锁三联征。骨损害:病变可为单发或多发,其主要特点为慢性骨膜反应和皮质增生引起的骨肥厚,3长期病程可导致锁骨和肋骨肥厚,甚至融合,还可压迫邻近神经、血管结构引起上肢疼痛和水肿,称“胸出口综合征”。成人病例最常累及前上胸壁(约占65%~90%),其次是脊柱、骨盆、长骨。儿童病例最易累及下肢长骨干骺端,4其次是前上胸壁、脊柱。由于皮肤损害与骨损害可不同时出现,是造成漏诊的主要原因。本病目前尚无特效疗法,临床多采用非甾体类抗炎药作为一线药物,如无效,可加用氨甲喋呤、柳氮磺胺吡啶、环孢素等治疗。生物制剂如英夫利昔单抗对部分治疗抵抗患者有效。5
参考文献
1赵辨.中国临床皮肤病学.南京:江苏科学技术出版社,2009. 1726.
2 Kahn MF,Khan MA.The SAPHO syndrome.Baillieres Clin Rheumatol,1994,8(2):333-362.
3 Earwaker JWS,Cotten A.SAPHO:syndrome or concept Imaging findings.Skeletal Radiol,2003,32:311-327.
4孙洋,孟悛非.SAPHO综合征的影像学表现.国外医学:临床放射学分册,2005,28(2):93-95.
5Skinner AR.A review of the use of infllximab tomanage tomanage cutaneous dermatoses.JCutan Med Surg,2004,8(2):77-89.
(收稿:2013-04-25)
Skin barrier and diseases
ZHANG Yuan,LIU Yong,YAN Min,et al.Department of Dermatology,Shengli Oilfield Central Hospital,Shandong Dongying,257000
Skin barrier includes physical barrier,chemical barrier and immunological barrier,which play important roles in some dermatosis.In this paper the skin barrier structure and function are introduced.
skin barrier;dermatosis
胜利油田中心医院,山东东营,257000∗通信作者

