Plackett-Burman试验设计及响应面法优化超声辅助提取明绿豆SOD工艺
李梅青,张 瑜,代蕾莉,孔祥淋,杜晓妹
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.合肥农产品加工研究院,安徽 合肥 23 0036)
Plackett-Burman试验设计及响应面法优化超声辅助提取明绿豆SOD工艺
李梅青1,2,张 瑜1,代蕾莉1,孔祥淋1,杜晓妹1
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.合肥农产品加工研究院,安徽 合肥 23 0036)
为了充分提取明绿豆中的超氧化物歧化酶(superoxide dismutase,SOD),选用Plackett-Burman试验设计对影响磷酸盐缓冲液提取明绿豆SOD比活力的7 个因素进行评价,筛选出具有显著效应的3 个因素液固比、磷酸盐缓冲液pH值和超声水浴温度。在此基础上,采用响应面分析法优化出主要影响因素的最佳参数水平。结果表明:采用液固比22∶1(mL/g)、磷酸盐缓冲液pH 7、超声功率140 W、超声时间 20 min、超声水浴温度44 ℃、水浴浸提时间1.5 h、水浴浸提温度60 ℃的组合,明绿豆SOD的实际比活力为856.95 U/mg。与传统SOD源相比,明绿豆SOD含量处于较高水平,可成为一种新的植物SOD源。
明绿豆;超氧化物歧化酶;超声辅助提取;Plackett-Burman试验设计;响应面设计
绿豆,为豆科草本植物绿豆(Phaseolus radiatus)的成熟种子。《本草纲目》云:“绿豆,消肿治痘之功虽同于赤豆,而压热解毒之力过之”;并可“解金石、砒霜、草木一切诸毒”。《本草求真》曰:“绿豆味甘性寒,能厚肠胃、润皮肤、和五脏及资脾胃”。现代药理研究表明绿豆具有抗菌抑菌[1]、抗肿瘤[2]、抗氧化[3]、提高免疫力[4]、降血脂[5]、解毒[6]等作用。
SOD能快速有效地清除体内的超氧阴离子自由基,在防止生物体免受超氧阴离子自由基损伤[7]、抗辐射、抗肿瘤、提高人体免疫力、抗压力和疲劳[8-9]、预防局部缺血再灌注损伤[10]、治疗动脉血管粥样硬化[11]、治疗脂溢性皮肤炎症[12]及延缓机体衰老等方面起到重要作用[13],在食品、农业及化妆品行业的应用也越来越广泛[14]。但是过去大多从血液中提取,不仅工艺复杂、制备成本高、不易常温保存,且存在艾滋病等血液病毒交叉感染的潜在危险。植物SOD则有较高的使用安全性,国际卫生组织已停止动物性SOD的使用[15]。所以,从植物源中获取SOD正成为热点。
明光绿豆以其色泽晶莹碧绿、粒大皮薄、汤清易烂、清香可口等特点,质量为全国之冠,被称为“明绿”,曾经被作为贡品。2008年,“明光绿豆”获得国家原产地保护标志,以下简称“明绿豆”。国内尚无从明绿豆中提取SOD的相关研究报道。本实验以明绿豆为材料,以磷酸盐缓冲液代替有机溶剂,在单因素试验的基础上采用Plackett-Burman试验设计[16]和响应面试验设计[17-18]对其SOD的提取工艺进行优化,旨在为开发利用明绿豆SOD酶源提供理论依据。
1 材料与方法
1.1 材料与试剂
明绿豆由安徽燕之坊食品有限公司提供。
邻苯三酚 上海生化试剂所;考马斯亮蓝G-250上海绿鸟科技发展有限公司;牛血清蛋白 美国Simga公司。
1.2 仪器与设备
LR16-A高速冷冻离心机 北京雷勃尔离心机有限公司;UV-5800PC扫描型紫外-可见分光光度计 上海元析仪器有限公司;KQ5200DE超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 酶活性及蛋白质的测定
SOD酶活力的测定采用修正的邻苯三酚自氧化法[19]:一定条件下,在1 mL反应液中每分钟抑制邻苯三酚自氧化速率达50%时的酶量为1 个酶活力单位(1U)。
蛋白质的测定:参照考马斯亮蓝G-250法[20],以牛血清蛋白做标准蛋白。
SOD比活力按下面公式计算:

1.3.2 明绿豆SOD提取工艺流程
明绿豆→低温粉碎并过40 目筛→超声辅助磷酸盐缓冲液(内含1 mmol/L的EDTA)提取→热水浴处理→离心(4 ℃、10 000 r/min、20 min)→SOD粗提取液(上清液)
1.3.3 单因素试验
以明绿豆SOD比活力为指标,考察7个影响明绿豆SOD比活力的因素,得出单因素对SOD比活力的变化规律,并确定7 个单因素的最佳值。单因素试验采用的固定参数分别为:液固比20∶1(mL/g)、磷酸盐缓冲液pH 7.6、超声功率100 W、超声水浴温度40 ℃、超声时间20 min、水浴浸提温度50 ℃、水浴浸提时间2 h。分别固定其中的6个因素,变化另1个因素进行优化,因素变化范围分别为:液固比5∶1~30∶1(mL/g)、磷酸盐缓冲液pH 6.4~8.0、超声功率80~200 W、超声水浴温度25~45 ℃、超声时间5~25 min、水浴浸提温度30~70 ℃、水浴浸提时间1~3 h。
1.3.4 Plackett-Burman试验设计
在单因素试验基础上,利用Plackett-Burman试验设计法,对上述影响因素进行筛选。每个因素分别取低(—1)和高(+1)两个水平,共12 个试验组合。每个处理重复3 次,取平均值为试验结果。
1.3.5 Box-Behnken试验设计方案
在Plackett-Burman试验基础上,利用响应面分析法对明绿豆SOD提取工艺参数进行优化。利用Design-Expert 8.0.5b软件,采用Box-Behnken建立三因素三水平数学模型。
2 结果与分析
2.1 单因素试验结果
2.1.1 液固比对SOD比活力的影响
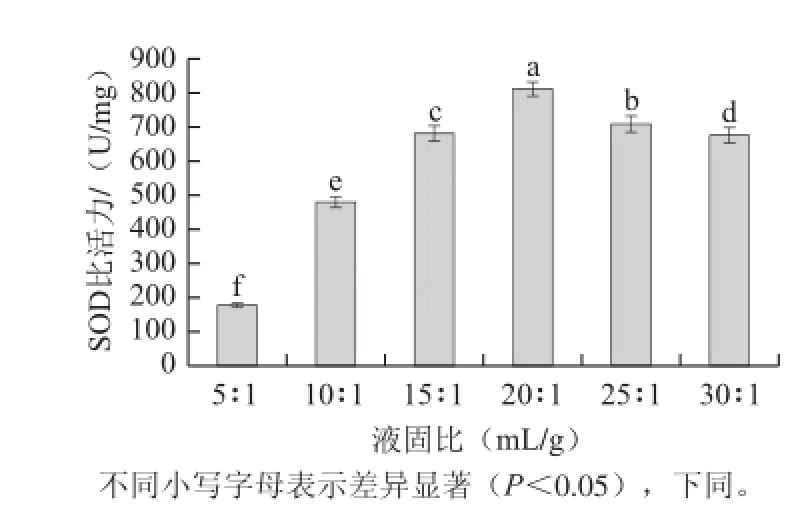
图 1 液固比对SOD比活力的影响Fig.1 Effect of liquid-to-solid ratio on the extraction rate of SOD
由图1可知,在液固比5∶1~20∶1(mL/g)范围内,明绿豆SOD比活力随着溶剂体积的增大而增大,这主要是由于溶剂中溶质的浓度差和溶剂能够溶解的物质的量在不断增大导致的。在液固比达到20∶1(mL/g)后,SOD比活力逐渐的下降。不同液固比条件下,所得SOD比活力有显著性差异(P<0.05)。考虑到SOD的提取率及提取难度问题,确定明绿豆SOD提取的液固比为20∶1(mL/g)。
2.1.2 磷酸盐缓冲液pH值对SOD比活力的影响
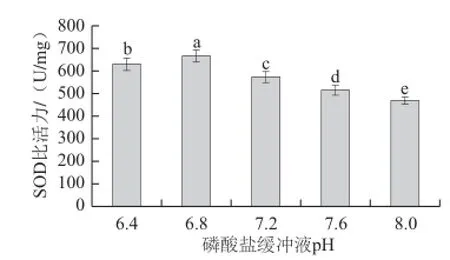
图 2 磷酸盐缓冲液pH值对SOD比活力的影响Fig.2 Effect of phosphate buffer pH on the extraction rate of SOD
由图2可以看出,磷酸盐缓冲液pH 6.8时SOD的比活力最高,随后磷酸盐缓冲液pH值继续增加则导致SOD比活力逐渐降低,pH值越偏离6.8,SOD比活力差异越显著(P<0.05)。因为SOD有一定的酸碱耐受性,pH值过低或过高都会影响酶活,所以pH 6.8磷酸盐缓冲液较适宜提取SOD。
2.1.3 超声功率对SOD比活力的影响

图 3 超声功率对SOD比活力的影响Fig.3 Effect of ultrasonic power on the extraction rate of SOD
由图3可知,明绿豆SOD比活力在80~140 W范围内随着超声功率的增大而增大,当超声功率达到140 W时,酶比活力最大。80~140 W范围内时SOD比活力之间的差异极显著,之后差异显著。这主要是因为随着功率的增加,溶质的扩散速度也增大,当功率达到一定程度后,溶质扩散速率的增加对酶的提取影响减小。考虑到能量的消耗和成本问题,选择超声功率为140 W较适宜。
2.1.4 超声时间对SOD比活力的影响

图 4 超声时间对SOD比活力的影响Fig.4 Effect of ultrasonic treatment time on the extraction rate of SOD
由图4可知,5~20min范围内,SOD比活力随超声时间的延长呈上升趋势且差异显著(P<0.05),当超声20 min时,SOD比活力达到最大值。20 min后,随着时间的延长,SOD比活力略有下降。由Fick扩散定律可知得率与提取时间呈正比,在一定条件下,超声时间越长得率越高[16];但是时间太长会使扩散次数降低,反而影响SOD的得率。所以,本试验选择超声时间为20 min。
2.1.5 超声水浴温度对SOD比活力的影响

图 5 超声水浴温度对SOD比活力的影响Fig.5 Effect of ultrasonic-waterbath temperature on the extraction rate of SOD
由图5可知,超声水浴温度对SOD比活力影响差异显著,在25~40 ℃范围内,温度升高能提高明绿豆SOD的得率。当温度超过40 ℃时,SOD比活力逐渐降低。这可能是因为高温引起细胞膜结构的变化[21],从而使SOD容易转移到溶液中。但是,过高的温度又会引起SOD结构发生变化,破坏SOD的活性。所以,选取40 ℃作为提取超声水浴温度。
2.1.6 水浴浸提时间对SOD比活力的影响

图 6 水浴浸提时间对SOD比活力的影响Fig.6 Effect of subsequent waterbath extraction duration on the extraction rate of SOD
由图6可知,水浴浸提时间过短,达不到分离提取效果,影响提取SOD的纯度,提取时间过长又使SOD比活力损失明显,试验表明浸提时间为1.5 h较适宜。
2.1.7 水浴浸提温度对SOD比活力的影响
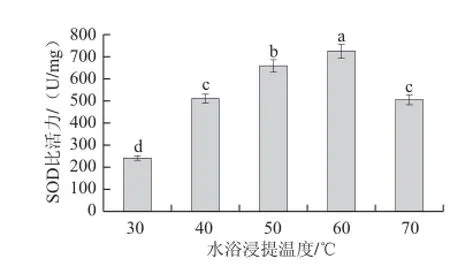
图 7 水浴浸提温度对SOD比活力的影响Fig.7 Effect of subsequent waterbath temperature on the extraction rate of SOD
图7表明,在30~60 ℃水浴中进行热处理时,SOD比活力先随着水浴温度的升高而升高且差异显著,然后逐渐降低。水浴浸提温度不仅由蛋白质溶解度特性决定,还与酶的最适温度有关。故本试验最合适水浴浸提温度选60 ℃。
2.2 Plackett-Burman试验设计对关键影响因素的确定
在单因素试验的基础上,Plackett-Burman试验设计及响应值见表1。利用Mintab1 5.0对试验结果进行方差分析,结果见表2。

表 1 Plackett-Burman试验设计及响应值Table 1 Plackett-Burman design and results

表 2 试验设计方差分析结果Table 2 ANOVA of Plackett-Burman design experiments
由表2可知,主效应P值为0.045,表明Plackett-Burman试验设计因素在所选取的水平范围内对明绿豆SOD比活力的影响显著,同时决定系数R2为0.900 8,说明回归有效,试验设计可靠。
由表2还可以看出,液固比、磷酸盐缓冲液pH值、超声水浴温度是影响明绿豆SOD比活力的主要因素,所以在下一步的响应面分析中,重点考察这3 个因素的最优水平范围。其他条件采用单因素试验的最佳条件:超声功率140 W、超声时间20 min、水浴浸提时间1.5 h、水浴浸提温度60 ℃。
2.3 响应面分析结果
2.3.1 Box-Behnken试验设计
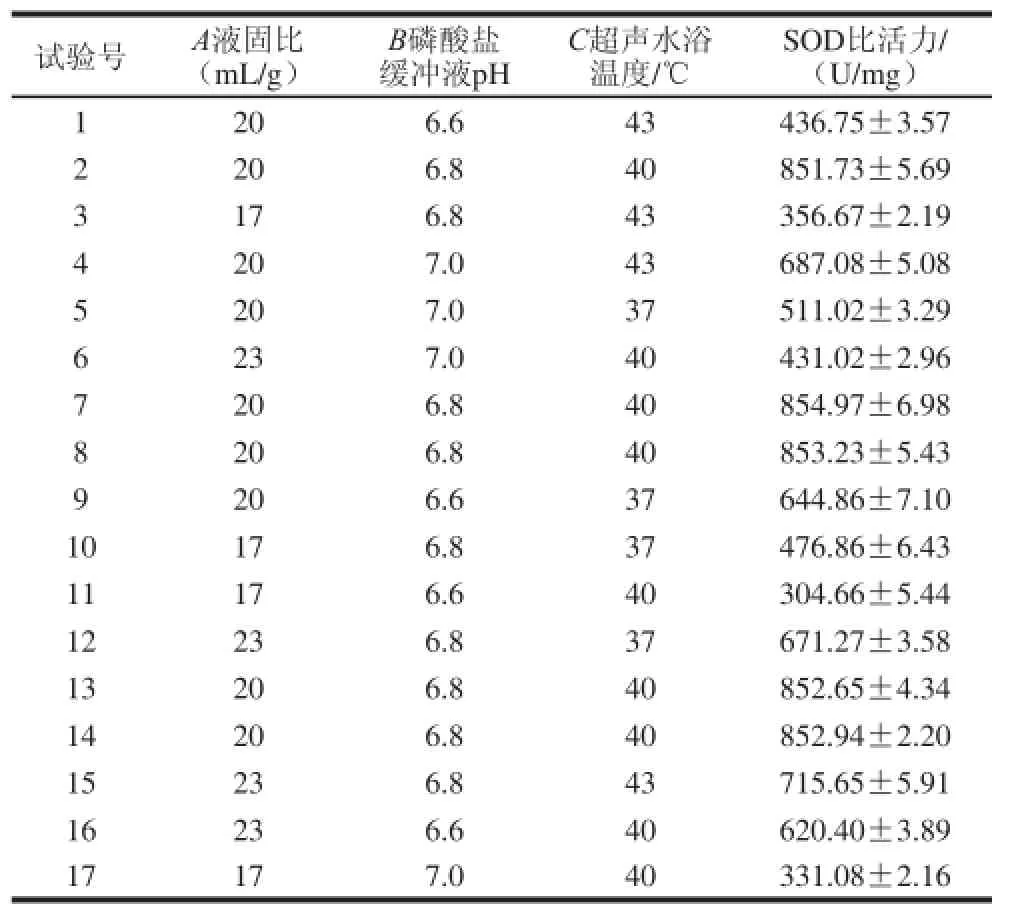
表 3 Box-Behnken试验设计及结果Table 3 Box-Behnken design and results

表 4 明绿豆SOD提取参数回归方差分析Table 4 ANOVA of quadratic polynomial model
经回归拟合后,得到以明绿豆SOD比活力(Y)为响应值的回归方程为:
Y=853.10+121.10A—5.81B—13.48C—53.95AB+ 41.14AC+96.04BC—223.06A2—208.25B2—74.93C2
由表4可知,模型的P值小于0.001,表明该模型二次方程极显著,失拟项不显著(P=0.468 7)。各因素对明绿豆SOD比活力影响大小顺序:液固比>超声水浴温度>磷酸盐缓冲液pH值。一次项A极显著,二次项A2、BC、B2、C2极显著,交互项AB显著。回归方程决定系数R2为0.980 7,说明该回归方程能很好地描述各因素与响应值之间的真实关系,可以用其确定最佳提取工艺条件。

图 8 液固比、磷酸盐缓冲液pH值和超声水浴温度交互影响明绿豆SOD比活力的响应面图Fig.8 Response surface plots for the interactive effects of solid-to-liquid ratio, ultrasonic-waterbath temperature and phosphate buffer pH on the specifi c activity of SOD
比较图8及方差分析结果可知,液固比表现为曲线较陡,说明对明绿豆SOD比活力的影响最为显著,液固比最佳值在22∶1(mL/g)左右,而超声水浴温度表现为曲线较为平滑,磷酸盐缓冲液pH值次之,它们的最佳值分别在44 ℃和7左右。
2.3.2 模型的验证
通过回归模型预测的明绿豆SOD最佳提取工艺参数为:液固比22.27∶1(mL/g)、磷酸盐缓冲液pH6.94、超声水浴温度44.47 ℃。在此条件下,明绿豆SOD比活力理论上可达到855.67 U/mg。考虑到实际操作的可行性,将明绿豆的提取条件在回归方程得到的理论值基础上修正为:液固比22∶1(mL/g)、磷酸盐缓冲液pH 7、超声水浴温度44 ℃。
在以上优化条件下进行验证实验,共进行4次实验。验证实验平均值为856.95 U/mg,理论值与实验值的相对偏差为0.15%。说明采用响应面优化法优化明绿豆SOD提取条件是可行的,所得SOD提取条件具有实际应用价值。
3 结 论
经过Plackett-Burman试验及响应面分析法优化,明绿豆SOD提取的最佳工艺参数为:液固比22∶1(mL/g)、磷酸盐缓冲液pH 7、超声功率140 W、超声时间20 min、超声水浴温度44 ℃、水浴浸提时间1.5 h、水浴浸提温度60 ℃。此时明绿豆SOD的实际比活力为856.95 U/mg。不同来源SOD的比活力有所不同,已有的研究发现马血、鸭血中SOD比活力为77.5[22]、 1 000.91 U/mg[23];番茄、沙棘、仙人掌中SOD活力分别为55.5[24]、64.94[25]、215 U/mL[26];红酵母、啤酒废酵母中SOD比活力达199.59[27]、31.75 U/mg[28]。与上述结果相比,除鸭血外,明绿豆中的SOD比活力均远高于其他来源的SOD比活力,说明利用明绿豆提取SOD是可行的,明绿豆可以成为一种新的植物SOD源。
[1] 赵守训, 黄泰康, 丁志尊, 等. 中药辞海[M]. 3卷. 北京: 中国医药科技出版社, 1997: 642-643.
[2] ABELL C W. The effects of PAL on leukemic lymphocytes in vitro[J]. Cancer Research, 1972, 32: 215-290.
[3] 程霜, 杜凌云, 王勇, 等. 绿豆皮中抗氧化剂的初步研究[J]. 中国粮油学报, 2000, 15(2): 40-43.
[4] del CAMPILO E, LELAND M, SHANNON L M. Molecular properties of the enzymic phytohemagglu-tininof mung bean[J]. Journal of Biological Inorganic Chemistry, 1981, 256: 7177-7180.
[5] 王沛, 宋启印, 周哲, 等. 绿豆对动物的降血脂作用[J]. 沈阳药学院学报, 1990, 7(1): 42-44; 62.
[6] 张俊荣, 陈庆全. 家用解毒药物[M]. 广州: 广东高等教育出版社, 1988: 77-78.
[7] BAFANA A, DUTT S, KUMAR A, et al. The basic and applid aspects of superoxide dismutase[J]. Journal of Molecular Catalysis A-Chemical B: Enzymatic, 2011, 68: 129-138.
[8] BRESCIANI G, CRUZ I B M, de PAZ J A, et al. The Mn-SOD Ala16Val SNP: relevance to human diseases and interaction with environmental factors[J]. Free Radical Research, 2013, 47(10): 781-792.
[9] MILESI M A, LACAN D, BROSSE H, et al. Effect of an oral supplementation with a proprietary melon juice concentrate (ExtrameⅠ) on stress and fatigue in healthly people: a pilot, double-blind, placebo-controlled elinicl trial[J]. Journal of Nutrition, 2009, 8: 40.
[10] KARALALIL B, KESIMEI E, EMERCE E, et al. The impact of OCCI, MTHI and Mn-SOD gene polymorphisms on 8-hydroxy-2′-deoxyguanosine and cellular superoxide dismutase activity in myocardial ischemia-reperfusion[J]. Molecular Biology Reports, 2011, 38(4): 2427-2435.
[11] KANG D H, KANG S W. Targeting cellular antioxidant enzymes for treating atherosclerotic vascular disease[J]. Biomolecules and Therapeutics(Seoul), 2013, 21(2): 89-96.
[12] OZTURK P, ARICAN O, BELGE K E, et al. Oxidative stress in patients with scalp seborrbeic dermatitis[J]. Acta Dermatovenero Croat, 2013, 21(2): 80-85.
[13] CICEK E, YILDIZ M, DELIBAS N, et al. The effects of 201TI myocardial perfusion scintigraphy studies on oxidative damage in patients[J]. West Indian Medical Journal, 2009, 58(1): 50-53.
[14] 陈彦斌, 詹现璞, 张宏盈, 等. SOD的保健作用及在乳制品中的应用[J].中国乳业, 2007(5): 40-44.
[15] 金绍黑. 植物超氧化物歧化酶的提取、修饰制备工艺及其应用研究[J]. 成都航空职业技术学院学报, 2005, 21(1): 44-47.
[16] 杨冀艳, 胡磊, 许杨. Plackett-Burman设计和响应面法优化荷叶总黄酮的提取工艺[J]. 食品科学, 2009, 30(6): 29-33.
[17] 文连奎, 贺阳. 越橘叶超氧化物歧化酶超声波提取工艺的响应面优化[J]. 食品科学, 2012, 33(2): 154-158.
[18] THANH-BLICHARZ J L, BIALAS W, LEWANDOWICZ G. Response surface optimization of manufacturing of dietary starch products[J]. Scientiarum Polonorum Acta Technologia Alimentaria, 2009, 8(4): 51-62.
[19] 庞战军, 周玫, 陈瑗. 自由基医学研究方法[M]. 北京: 人民卫生出版社, 2000: 110.
[20] 陈毓荃. 生物化学实验方法和技术[M]. 北京: 科学出版社, 2002: 95-96.
[21] 郭辉, 罗宇倩, 章伟华, 等. 响应面法优化超声波辅助提取荷叶黄铜工艺研究[J]. 中国食品学报, 2011, 11(1): 119-125.
[22] 热孜耶·喀日, 米丽班·霍家艾合买提, 热合满·艾拉, 等. 响应面法优化马血中SOD超声波提取工艺研究[J]. 食品工业科技, 2013, 34(2): 249-251.
[23] 周亚迪, 李诚, 康斌, 等. 鸭血中SOD的提取及稳定性研究[J]. 农产品加工: 学刊, 2011(10): 21-24.
[24] 李珺, 马力通, 高书良. 番茄中超氧化物歧化酶提取工艺的优化[J].安徽农业科学, 2012, 40(7): 3997-3998.
[25] 李扬, 丁喜顺, 魏建民, 等. 沙棘超氧化物岐化酶(SOD)的提取与化学修饰[J]. 内蒙古农业大学学报: 自然科学版, 2002, 23(3): 22-24.
[26] 王中凤, 张敏, 杨红, 等. 仙人掌超氧化物歧化酶提取与纯化工艺研究[J]. 中国林副特产, 2009(6): 13-16.
[27] 李宏, 单振秀, 王宜林, 等. 红酵母提取SOD的研究[J]. 食品科学, 2003, 24(12): 81-84.
[28] 吴思方, 方尚玲, 童振球. 啤酒废酵母提取SOD研究[J]. 食品科学, 2000, 21(3): 22-24.
Optimization of Ultrasonic-Assisted Extraction of SOD from “Ming” Mung Bean by Plackett-Burman Design and Response Surface Methodology
LI Meiqing1,2, ZHANG Yu1, DAI Leili1, KONG Xianglin1, DU Xiaomei1
(1. School of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China; 2. Institute of Hefei Agricultural Products Processing, Hefei 230036, China)
An optimized ultrasonic-assisted procedure was proposed for the exhaustive extraction of superoxide dismutase (SOD) from “Ming” mung bean, a famous cultivar in Mingguang, Anhui province. Seven operating parameters were screened for their effects on the specifi c activity of SOD using Plackett-Burman design, and solvent-to-solid ratio, phosphate buffer pH and ultrasonic-waterbath temperature were identifi ed as the most signifi cant variables. Subsequently, the levels of the three variables were optimized by response surface methodology. The optimal extraction conditions for SOD were determined as phosphate buffer at pH 7 as the extraction solvent with a solvent-to-solid ratio of 22:1 (mL/g), waterbath extraction at 44 ℃ with an ultrasonic power of 140 W for 20 min and subsequently at 60 ℃ for additional 1.5 h without ultrasonication. Under these conditions, the specifi c activity of SOD was 856.95 U/mg. “Ming” mung bean as a new source of SOD contained more abundant SOD when compared with the traditional sources.
“Ming” mung bean; SOD; ultrasonic-assisted extraction; Plackett-Burman design; response surface methodology
R284.2
A
1002-6630(2015)02-0069-06
10.7506/spkx1002-6630-201502013
2014-06-30
合肥农产品加工研究院资助院企合作项目(2012HAPP002)
李梅青(1965—),女,副教授,硕士,研究方向为农产品加工与贮藏。E-mail:lmq@ahau.edu.cn

