玉竹糖蛋白分离纯化及其体外抗氧化能力
王 艳,胡一鸿,陈秋志,尹洛毅,张雪娇,刘景顺,蒋秋情,金晨钟,陈 勇*
(湖南人文科技学院生命科学系,湖南 娄底 417000)
玉竹糖蛋白分离纯化及其体外抗氧化能力
王 艳,胡一鸿,陈秋志,尹洛毅,张雪娇,刘景顺,蒋秋情,金晨钟,陈 勇*
(湖南人文科技学院生命科学系,湖南 娄底 417000)
采用磷酸缓冲液浸提法提取玉竹糖蛋白粗品(Polygonatum odoratum glycoprotein,PDG),经葡聚糖凝胶G-100和刀豆凝集素A分离纯化,得到糖蛋白组分PDG1和PDG3,经高效液相色谱测定其分子质量,并检测PDG、PDG1和PDG3的体外抗氧化活性。结果表明,PDG1和PDG3的分子质量分别为186 kD和28.3 kD;玉竹糖蛋白具有一定的还原能力,对羟自由基和1,1-二苯基-2-三硝基苯肼自由基具有较强的清除作用,对脂质过氧化具有抑制作用,且在一定质量浓度范围内(1~10 mg/mL)存在剂量关系,其抗氧化能力随着玉竹糖蛋白质量浓度的增加而增强,PDG1和PDG3的抗氧化能力优于PDG。
玉竹;葡聚糖凝胶G-100;刀豆凝集素A;糖蛋白;抗氧化
玉竹(Polygonatum odoratum (Mill.) Druce)为百合科黄精属多年生草本植物,广泛分布在东北、华北、华东、西南和华南等省区,是我国传统的药食类植物,其中湖南湘玉竹和四川玉竹栽培面积较大[1],其根茎常用于保健和食疗,具有滋阴养肺、消炎抑菌、育发乌发和生津止渴等功效。玉竹富含多糖、黄酮、生物碱、甾醇和强心苷等生物活性物质和多种人体需要的矿质元素[2]。有研究表明,玉竹具有多种药理作用,能够显著提高高糖小鼠的糖耐量,降低血糖含量[3-4];提高酪氨酸酶的活性,促进黑色素的合成[5];有较强的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl hydrazy,DPPH)自由基的能力[6]。在已发现的玉竹生物活性物质中,研究最为透彻的是玉竹多糖,具有抗氧化[7]、提高保护酶和碱性磷酸酶活性[8]、抗动脉粥样硬化[9]及抗肿瘤[10]作用。
糖蛋白是蛋白质和多糖链的共价结合物,其种类多、分布广,动植物、微生物及病毒中均有发现,是组成酶、激素、免疫球蛋白、载体蛋白、结构蛋白和细胞膜等的结构成分[11],是一类重要生物活性物质,具有增强免疫调节、抑制肿瘤、降低血糖、血脂、抗氧化、防衰老等功能[12-13]。抗氧化能力是衡量营养健康食品或植物生物活性成分的重要指标,目前人工合成的抗氧化剂有二丁 基羟基甲苯、没食子酸丙脂等,其抗氧化能力很强,但是人工合成抗氧化剂有禁忌和副作用,长期使用有致癌风险。因此,人们更倾向于寻找天然的植物抗氧化剂。目前植物糖蛋白的研究主要以甘薯为材料,对糖蛋白的分离、纯化、提取和保健功能进行探讨,如糖蛋白活性产生机理、糖蛋白调节免疫能力和降血脂的作用等[14]。由于糖蛋白具有结构稳定和潜在保健作用与药效,植物糖蛋白成为继多糖之后的研究热点。玉竹是我国广泛栽培的中药材,虽然前人对其多种活性成分进行了详尽的研究,但目前对玉竹糖蛋白的研究报道仍很少,对其分离纯化往往采用胶过滤和离子交换,难以高效获取均一产品。因此,本实验以湘玉竹为研究对象,对糖蛋白采用亲和层析进行分离纯化,并对其部分性质进行测定,以期为玉竹保健产品的深度开发提供理论依据。
1 材料与方法
1.1 材料与试剂
玉竹根茎 湖南新化县药材市场;DPPH、标准分子质量蛋白质 美国Sigma公司;TSKgel G5000PWXL-CP色谱柱 日本Tosoh公司;葡聚糖凝胶G-100(Sephadex G-100)、刀豆凝集素A(concanavalin A) 瑞典Amersham Biosciences公司。其他化学试剂均为国产分析纯。
1.2 仪器与设备
SP-754型分光光度计 上海光谱仪器公司;Biological LP低压色谱系统 美国Bio-Rad公司;LC-10Avp plus高效液湘色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司。
1.3 方法
1.3.1 玉竹糖蛋白粗提取
切成片的玉竹于80 ℃烘干,粉碎过80 目筛,用2 倍体积的石油醚混匀,室温放置过夜脱脂后过滤,置于45 ℃条件下烘干,然后用磷酸缓冲液按一定料液比于0~4 ℃低温条件下浸提,10 000 r/min离心10 min,收集上清液置于真空冷冻干燥干燥24 h,得到玉竹糖蛋白(Polygonatum odoratum glycoprotein,PDG)粗制品。
1.3.2 提取工艺条件优化
分别设定不同浸提时间和料液比(g/mL)对PDG预提,考马斯亮兰法测定蛋白质含量,用蛋白质粗略估计PDG,每个处理重复3次。
1.3.3 葡聚糖凝胶G-100过滤
参照Hu Yihong等[15]的方法。采用5 cm×70 cm层析柱,每次上样10 mL PDG (1 mg/mL),洗脱液采用25 mmol/L Tris-HCl(pH 7.2)缓冲液,洗脱流速1 mL/min,分别收集各蛋白洗脱峰组分。
1.3.4 刀豆凝集素A亲和层析纯化
参照吴娟等[16]的方法纯化PDG。采用0.5cm×10 cm的刀豆凝集素A层析柱,用200 mL 20 mmol/L pH 7.4的Tris-HCl缓冲液(含1 mmol/L MnCl2、1 mmol/L CaCl2和0.5 mmol/L NaCl)以1 mL/min流速平衡柱子,再以0.5 mL/min流速上样,然后用100 mL 20 mmol/L pH 7.4的Tris-HCl缓冲液(含1 mmol/L MnCl2、1 mmol/L CaCl2和 0.5 mmol/L NaCl)洗涤层析柱中未结合的蛋白质,再用150 mmol/L甘露糖洗脱液(含150 mmol/L的葡萄糖)以0.5 mL/min流速洗脱,收集洗脱液,透析除糖并用固体聚乙二醛反透析至原体积,分别测定每管280 nm波长处吸光度,并按照孙兴力等[17]的方法测定490 nm波长处的吸光度。
1.3.5 HPLC测定PDG分子质量
参照陈海相等[18]的方法测定。采用色谱纯牛肝过氧化氢酶(250 kD)、β-半乳糖苷酶(118 kD)、牛血清蛋白(66.43 kD)、辣根过氧化物酶(40 kD)和α-胰凝乳酶(25 kD)为标样,所有样品均用0.1 mol/L pH 7.8的磷酸盐缓冲液配成25 mg/mL质量浓度,经0.22 μm滤膜过滤后进样。其中,经刀豆凝集素A亲和层析纯化的PDG先用固体聚乙二醇反透析浓缩到原体积的1/10。色谱条件:采用30 cm×7.8 mm的TSKgel G5000PWXL-CP蛋白质专用色谱柱,流动相为0.1 mol/L pH 7.8的磷酸盐缓冲液,洗脱流速0.3 mL/min。
1.3.6 体外抗氧化活性的测定
总还原能力和羟自由基清除率测定按照胡一鸿等[19]的方法,体外清除DPPH自由基能力按照Chung等[20]的方法,Fe2+诱发的脂质过氧化反应的抑制作用按照张尔贤等[21]的方法。以上测定均用1/10 PDG质量浓度的VC作对照。并分别按如下公式计算:

式中:A样品为含PDG和H2O2吸光度;A损伤为只含H2O2吸光度;A未损为不含H2O2吸光度。
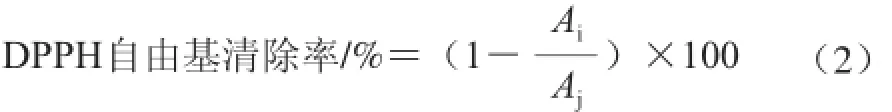
式中:Aj为对照品吸光度;Ai为样品吸光度。

式中:A0为空白对照管吸光度;A为样品管吸光度。
2 结果与分析
2.1 料液比、浸提时间对玉竹蛋白得率的影响

表 1 浸提时间、料液比对玉竹蛋白得率的影响Table 1 Effects of extraction time and material/liquid ratio on the extraction rate of P. odoratum glycoproteins
如表1所示,按浸提时间(12、24、32 h)和料液比(1∶10、1∶20、1∶30)进行实验,当料液比1∶20、提取时间24 h时蛋白质的得率达到13.1%,进一步提高溶剂用量和延长浸提时间蛋白质的得率上升很少。蛋白质提取在考虑得率的前提下尽量缩短浸提时间和采用低的溶剂用量,以减少蛋白质变性和节省成本。因此,本实验采用浸提时间24 h、料液比1∶20。
2.2 PDG粗制品的纯化

图 1 葡聚糖凝胶G-100分离PDG的柱层析图谱Fig.1 Elution of PDG on Sephadex G-100

图 2 刀豆凝集素A分离PDG1(a)和PDG3(b)的柱层析图谱Fig.2 Elution of PDG1(a) and PDG3(b) on concanavalin A
如图1所示,PDG粗制品经葡聚糖凝胶G-100层析,分离出峰1(48 mL)、峰2(60 mL)和峰3(54 mL)3 个组分,分别将峰1、峰2和峰3经刀豆凝集素A亲和层析纯化,发现峰1和峰3能检出糖与蛋白质(图2),得到PDG1和PDG3两种糖蛋白,组分峰2未检出糖,说明峰2不是糖蛋白。
2.3 HPLC测定糖蛋白分子质量
通过对标准蛋白质进行HPLC分析,测定标准蛋白质牛肝过氧化氢酶、β-半乳糖苷酶、牛血清蛋白、辣根过氧化物酶和α-胰凝乳酶的保留时间分别为19.35、 21.01、24.15、25.58、29.71 min(图3),得到分子质量标准曲线,其分子质量的回归方程为:lgM=—0.093 8t+ 7.105 8。对经刀豆凝集素A纯化后组分进行HPLC分析,测得PDG1和PDG3的保留时间分别为19.58 min和28.29 min(图4、5),求得PDG1和PDG3的分子质量分别为186 kD和28.3 kD。

图 3 标准蛋白质的HPLCFig.3 HPLC of protein marker
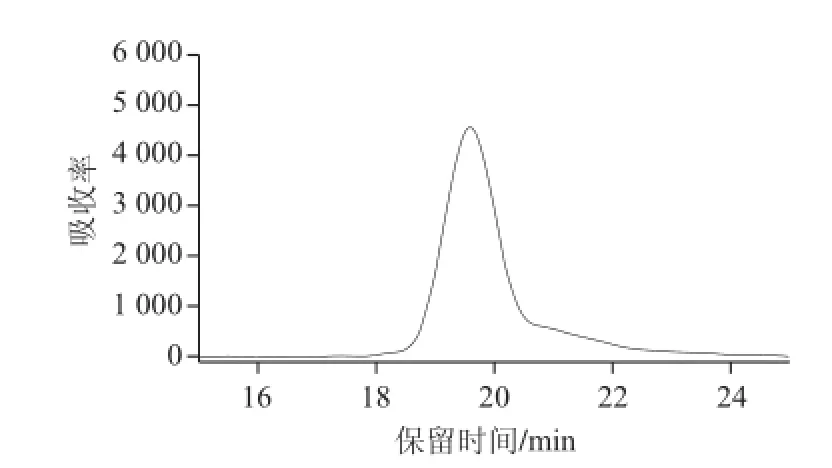
图 4PDG1HPLC洗脱曲线Fig.4 HPLC chromatogram of PDG1
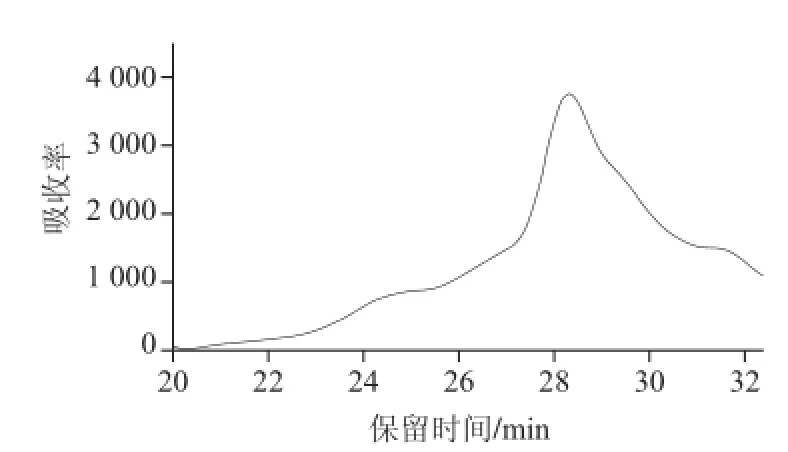
图 5 PDG3HPLC洗脱曲线Fig.5 HPLC chromatograpm of PDG3
2.4 玉竹糖蛋白的体外抗氧化活性
2.4.1 总还原力的测定
总还原力用来衡量生物活性物质失去电子的能力,其强弱与失去电子的能力呈线性关系。还原物质能够将Fe3+还原为Fe2+,生成物在700 nm波长处有最大吸光度,因而700 nm波长处吸光度的大小反映了总还原力的强弱[19]。由图6可知,1~10 mg/mL PDG、PDG1和PDG3的总还原力随着质量浓度的增加而呈上升趋势,且PDG低于PDG1和PDG3,但PDG、PDG1和PDG3的总还原能力明显低于VC。1 mg/mL的VC、PDG、PDG1和PDG3的总还原力分别为2.09、0.04、0.07和0.06,说明玉竹糖蛋白具有较弱的还原力。

图 6 玉竹糖蛋白的总还原力Fig.6 Reducing power of PDG1and PDG3
2.4.2 体外清除DPPH自由基能力

图 7 玉竹糖蛋白对DPPH自由基的清除作用Fig.7 DPPH radical-scavenging capacity of PDG1and PDG3
DPPH自由基是一种带有单电子的自由基,醇溶液呈紫色并在525 nm波长处有强吸收。自由基能与单电子配对而使其吸光度逐渐消失,其褪色程度也与其接受的电子数量成定量关系,因此可用525 nm波长处的吸光度来表示DPPH自由基的清除能力[22]。如图7所示,1~10 mg/mL的PDG、PDG1和PDG3随着质量浓度的增加,清除DPPH自由基的能力也逐渐增加,最高清除率分别达18.67%、31.71%和 25.88%,说明玉竹糖蛋白具有较强的DPPH自由基清除能力。
2.4.3 对羟自由基的清除作用
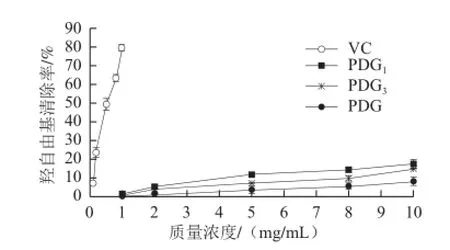
图 8 玉竹糖蛋白对羟自由基的清除作用Fig.8 Hydroxyl radical-scavenging capacity of PDG1and PDG3
羟自由基是对生物体危害最大的一种自由基,能使糖类、蛋白质、核酸等物质发化生氧化和损伤,导致细胞坏死或突变,与衰老、肿瘤和细胞吞噬等作用有密切的联系[23]。采用邻二氮菲-金属铁离子-H2O2体系,通过Fenton反应生成羟自由基,促使邻二氮菲-Fe2+被氧化为邻二氮菲-Fe3+,降低其水溶液在波长510 nm处最大吸收值测算对羟自由基的清除率。如图8所示,1~10 mg/mL的PDG、PDG1和PDG3对羟自由基清除率随着其质量浓度的增加而增加,但PDG对羟自由基的清除率低于PDG1和PDG3,在10 mg/mL时,分别达8.1%、17.93%和14.85%。且他们的清除作用均远低于强抗氧化剂VC,在1 mg/mL时VC清除率高达79.37%。
2.4.4 对Fe2+诱发脂质过氧化反应的抑制作用

图 9 玉竹糖蛋白对脂质过氧化反应的抑制作用Fig.9 Inhibitory effects of PDG1and PDG3on lipid peroxidation
不饱和脂肪酸是维持细胞运输系统和酶活性的重要物质。由于不饱和脂肪酸容易被氧化,因而用保护不饱和脂肪酸不受氧化的能力来衡量生物活性物质的抗氧化能力[24]。从图9可知,1~10 mg/mL PDG、PDG1和PDG3对脂质过氧化反应的抑制作用有剂量依赖关系,其PDG1和PDG3的抑制作用强于PDG,但明显低于VC,1 mg/mL的VC、PDG、 PDG1和PDG3的抑制率分别达57.95%、0.37%、5.6%和0.87%。
3 讨 论
植物糖蛋白是具有重要生理功能天然活性产物,在食品、药品制造和抗氧化剂方面具有应用潜力。目前人们已从甘薯中分离出分子质量26.9~508 kD的多种甘薯糖蛋白[14,25],邹柯婷等[26]也采用DEAE-52阴离子交换、葡聚糖凝胶G-100过滤得到两种分子质量约为100 kD的玉竹糖蛋白。本实验通过磷酸缓冲液浸提、葡聚糖凝胶G-100过滤和刀豆凝集素A亲和层析3个步骤得到分子质量为186 kD和28.3 kD的两种玉竹糖蛋白PDG1和PDG3,分离出的糖蛋白分子质量与前人的结果差异较大,说明分离出的糖蛋白是两种新的糖蛋白。大部分植物糖蛋白具有一定的抗氧化能力,如80~320 μg/mL的紫甘薯糖蛋白的还原力随着其质量浓度的增加而呈上升趋势[27],28 mg/mL的山药糖蛋白CYG-1、CYG-2还原力达83.35%和 88.14%[28],糖蛋白的这种抗氧化性可能与蛋白质所含琉基含量或类似于酶的活性有关[29-30],本实验中玉竹糖蛋白PDG、PDG1和PDG3有较弱的还原能力,1~10 mg/mL PDG、PDG1和PDG3的还原力随着其质量浓度的增加而增加。PDG、PDG1和PDG3清除羟自由基的能力也随着其质量浓度的增加而增加,在10 mg/mL时,其清除率达分别达8.1%、17.93%和14.85%,清除能力与建宁莲子糖蛋白GLP-Ⅰ相似,但低于建宁莲子糖蛋白GLP-Ⅱ和蒲公英糖蛋白的清除能力[31-32]。段玉峰等[33]报道丹参糖蛋白清除对DPPH自由基有一定的清除作用,但剂量效应关系不是很明显,本实验中玉竹糖蛋白PDG、PDG1和PDG3随质量浓度的增加清除DPPH自由基的能力也逐渐增加,剂量效应关系较明显,但弱于DBD糖蛋白的清除作用[34]。植物多糖对Fe2+诱导的脂质过氧化反应有较强的抑制作用[19],本实验发现PDG、PDG1和PDG3也对Fe2+诱导的脂质过氧化反应也有一定抑制作用,但抑制效果较弱。实验结果表明玉竹糖蛋白具有一定的抗氧化功能,且玉竹糖蛋白粗品PDG的抗氧化能力弱于其纯品PDG1和PDG3。蛋白质与多糖链结合形成糖蛋白后,其稳定性、耐热性、溶解性均有所提高,多糖的活性基团丰富了蛋白质的功能。因此,对玉竹糖蛋白的进一步研究,对于玉竹产品的深度开发和丰富糖蛋白生物学有着十分重要的意义。
[1] 全国中草药汇编编写组. 全国中草药汇编[M]. 北京: 人民卫生出版社, 1978: 84.
[2] LAN Gaoshuang, CHEN Haixia, WANG Zhaoshuai, et al. Extraction of Polygonatum odoratum polysaccharides using response surface methodology and preparation of a compound beverage[J]. Carbohydrate Polymers, 2011, 86: 1175-1180.
[3] SHU Xiaoshun, LÜ Jinhai, TAO Jun, et al. Antihyperglycemic effects of total fl avonoids from Polygo natum odoratumin STZ and alloxaninduced diabetic rats[J]. Journal of Ethnopharmacology, 2009, 124(3): 539-543.
[4] 郭常润, 戴平, 张欣, 等. 玉竹总皂苷降血糖作用实验研究[J]. 海峡药学, 2011, 23(4): 19-21.
[5] 罗少华, 李新荣. 玉竹对酪氨酸酶的激活作用[J]. 中国生化药物杂志, 1996, 17(1): 25-27.
[ 6] 张轩铭, 王冬梅, 王瑾, 等. 不同产地玉竹黄酮提取物体外抗氧化活性研究[J]. 西北植物 学报, 2011, 31(3): 628-631.
[7] 杨颖, 孙文武, 周晨. 响应曲面法优化玉竹水溶性多糖 提取及体外抗氧化研究[J]. 食品与生物技术学报, 2013, 32(3): 298-397.
[8] JIANG Qunguang, LÜ Yunxia, DAI W eidong, et al. Extraction and bioactivity of Polygonatum polysaccharides[J]. International Journal of Biological Macromolecules, 2013, 54: 131-135.
[9] 许金波, 陈正玉. 玉竹多糖抗肿瘤作用及其对免疫功能影响的实验研究[J]. 深圳中西医结合杂志, 1996, 6(1): 13-15.
[10] 刘燊, 胡彦君. 玉竹提取物玉竹多糖对1型糖尿病小鼠的作用研究[J].广州医药, 2009, 40(6): 49-53.
[11] 刘兴华, 赵浩如. 天然糖蛋白的提取、分离与纯化[J]. 药学进展, 2006, 30(12): 542-547.
[12] 柳娜, 殷志, 庄英帜, 等. 蛞蝓糖蛋白提出多糖对肺腺癌作用的实验研究[J]. 临床肿瘤学杂志, 2008, 13(9): 779-783.
[13] 吕克凡, 高世勇. 糖蛋白抗肿瘤研究进展[J]. 齐齐哈尔医学院学报, 2012, 33(12): 1642-1643.
[14] 连喜军, 罗庆丰, 鲁晓翔, 等. 国内甘薯糖蛋白研究进展[J]. 食品研究与开发, 2008, 29(2): 184-188.
[15] HU Yihong, GUO Zhenfei. Purifi cation and characterization of oxalate oxidase from wheat seedlings[J]. Acta Physiologiae Plantarum, 2009, 31: 229-235.
[16] 吴娟, 金晨钟, 刘姝梅, 等. 红薯过氧化物酶的纯化与性质测定[J].湖南农业科学, 2012(9): 41-43.
[17] 孙兴力, 陈德球, 王文渊. 不同生长期玉竹中多糖含量变化的比较研究[J]. 现代中药研究与实践, 2010, 24(4): 9-11.
[18] 陈海相, 顾靖, 崔怀珠, 等. 用高效液相色谱测定丝胶分子质量的研究[J]. 丝绸, 1997(4): 8-13.
[19] 胡一鸿, 叶龙, 朱术超, 等. 番荔枝种子粗多糖抗氧化能力研究[J].热带作物学报, 2011, 32(6): 1051-1054.
[20] CHUNG Y C, CHANG C T, CHAO W W, et al. Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2454-2458.
[21] 张尔贤, 俞丽君, 周意琳, 等. Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价[J]. 生物化学与生物物理学报, 1996, 28(2): 218- 222.
[22] 张先廷, 周俊丽, 王迎进. 地皮菜粗多糖的抗氧化性研究[J]. 长治学院学报, 2012, 29(5): 69-71.
[23] 刘国安, 韩潇, 侯国鹏, 等. 多种化合物对Fenton反应产生羟自由基的清除作用[J]. 兰州大学学报, 2012, 48(2): 86-89.
[24] DESSI M, NOCE A, BERTUCCI P, et al. Atherosclerosis, dyslipidemia, and infl ammation: the signifi cant role of polyunsaturated fatty acid[J/OL]. ISRN Inflammation, 2013. http://dx.doi. org/10.1155/2013/191823.
[25] 龚魁杰. 甘薯糖蛋白研究进展[J]. 食品科学, 2007, 28(6): 359-362.
[26] 邹柯婷, 李淼, 陈双, 等. 玉竹糖蛋白的分离纯化及理化性质的研究[J].食品工业科技, 2012, 33(8): 191-197.
[27] 罗秋水, 上官新晨, 蒋艳, 等. 紫红薯糖蛋白体外抗氧化活性研究[J].江西农业大学学报, 2012, 34(4): 809-813.
[28] 孙宇婧, 韩涛, 李丽萍, 等. 山药糖蛋白体外抗氧化活性研究[J]. 园艺学报, 2010, 37(6): 1009-1014.
[29] 郑裕国, 王远山, 薛亚平, 等. 抗氧化剂的生产及应用[M]. 北京: 化学工业出版社, 2004: 251-252.
[30] 翁新楚. 杭氧化剂及其杭氧化机制[J]. 郑州粮食学院学报, 1993(4): 20-29.
[31] 高居易, 陈彦. 建宁莲子糖蛋白的分离、纯化及清除自由基作用[J].武汉植物学研究, 2003, 21(2): 175-178.
[32] 钟洁, 段玉峰, 陈双. 蒲公英糖蛋白的体外抗氧化研究[J]. 食品工业科技, 2008, 29(9): 152-157.
[33] 段玉峰, 李淼, 王应强, 等. 丹参糖蛋白提取物抗氧化实验研究[J].食品工业科技, 2009, 30(1): 139-141.
[34] OH P, LIM K. Antioxidant activity of Dioscorea batatas decne glycoprotein[J]. European Food Research and Technology, 2008, 226: 507-515.
Purifi cation of Glycoprotein from Polygonatum odoratum and Its Antioxidant Activity in vitro
WANG Yan, HU Yihong, CHEN Qiuzhi, YIN Luoyi, ZHANG Xuejiao, LIU Jingshun, JIANG Qiuqing, JIN Chenzhong, CHEN Yong*
(Department of Life Sciences, Hunan University of Humanities, Science and Technology, Loudi 417000, China)
Crude glycoproteins (PDGs) were obtained from Polygonatum odoratum through phosphate buffer extraction. PDGs were further purified by Sephadex G-100 gel filtration and concanavalin A affini t y chromatography, and PDG1and PDG3were acquired. The molecular weights and antioxidant activity of these two fractions were determined. The results showed that PDG1and PDG3had a molecular weight of 186 and 28.3 kD, respectively, and PDG, PDG1and PDG3had reducing power, strong abilities to scavenge hydroxyl radical and 1,1-diphenyl-2-picrylhydrazy (DPPH) radical and inhibitory effects against lipid peroxidation, showing a dose-effect relationship in the range o f 1–10 mg/mL. Generally, PDG1and PDG3exhibited better antioxidant activity than PDGs.
Polygonatum odoratum; Sephadex G-100; concanavalin A; glycoprotein; antioxidant activity
Q599
A
1002-6630(2015)02-0052-05
10.7506/spkx1002-6630-201502010
2014-04-11
湖南省教育厅优秀青年项目(12B070);湖南人文科技学院优秀青年项目(2013QN01);2014年湖南省大学生研究性学习和创新性实验计划项目(504)
王艳(1985—),女,助教,硕士,主要从事天然产物的开发与利用及分子生物学研究。E-mail:wangyehaol@163.com
*通信作者:陈勇(1974—),男,高级农艺师,硕士,主要从事农产品加工研究。E-mail:henon@163.com

