中考化学物质推断题的常见类型与解法
许为春


推断题是每年各地中考的经典题型,它不仅能考查学生对元素及其化合物知识的掌握情况,更能考查学生的分析、推理、综合应用知识的能力,具有很强的区分度与选拔功能。它的特点是题面容量大,覆盖面广。常涉及物质的组成、性质、用途和制备等知识内容。拥有清晰的思路是解题的前题,选择合适的突破口是解题的关键,应用合理的方法是解题的保障。
一、把握重要的突破口
1.重要物质的颜色
(1)固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
(2)溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
(3)火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
(4)沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
2.常见物质的状态
常见固体单质有Fe、Cu、C、S;气体单质有H2、N2、O2;无色气体有H2、N2、O2、CO、CO2、CH4、SO2;常温下呈液态的物质有H2O。
3.重要的反应条件
点燃(有O2参加的反应);通电(电解H2O);催化剂(KClO3分解制O2);高温(CaCO3分解,C、CO还原CuO、Fe2O3);加热[KClO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3]。
4.关键的反应特征
(1)能使澄清石灰水变浑浊的无色无味气体是CO2。
(2)能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
(3)能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2。
(4)能使白色无水CuSO4粉末变蓝的气体是水蒸气。
(5)在O2中燃烧火星四射的物质是Fe。
(6)在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
(7)能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
5.特征元素和物质
(1)地壳中含量最多的元素是O,含量最多的金属元素是Al。
(2)人体中含量最多的元素是O。
(3)空气中含量最多的元素是N。
(4)形成化合物最多的元素是C。
(5)质子数最少的元素是H。
(6)相对分子质量最小、密度也最小的气体是H2。
(7)相对分子质量最小的氧化物是H2O。
(8)自然界中硬度最大的物质是金刚石。
二、常用思路方法
1.顺推法:通常以题首为突破口,按照物质的性质,以及物质间的相互反应为依托逐步深入下去,直至顺利解题。
2.逆推法:通常以题给的结论或实验现象为突破口,从题尾入手依次向前逆推,从而获得问题的答案。
3.分层法:将整个推断过程分层进行,先得出每层的结论,再统摄整理。
4.剥离法:根据已知条件把推断过程中存在的有明显特征的未知物质先剥离出来,再将其作为已知条件来逐个推断其他物质。
三、主要解题流程
1.阅读题目:要求通阅全题,统领大局。关键点要反复读,读得它“原形毕露,真相大白”。
2.寻找突破:要求在读题的过程中找出明显条件,挖掘隐含条件,寻找解题的突破口。
3.正确推断:要求从突破口入手将明显条件与隐含条件相结合,运用合理的方法正确推断。
4.验证答案:要求将推出的结果代入题中逐步检验。
四、经典习题例析
1.文字叙述型
例1有一包固体粉末,可能由碳酸钙、硫酸钾、硝酸钠、氯化铁、氯化钡中的一种或几种组成,做实验得到以下结论:
(1)将此固体粉末加到水中,得到白色沉淀,上层溶液为无色。
(2)该白色沉淀部分溶于稀硝酸,且有气体放出。
从实验可判断出,该粉末中一定含有,一定不含有。
解析该类题中往往会有明显的现象特征,解题时就以此为突破口。
(1)中“上层溶液为无色”可推得无“氯化铁”;“白色沉淀”有两种可能:碳酸钙或硫酸钾与氯化钡反应生成的硫酸钡。
(2)中“白色沉淀部分溶于稀硝酸”中的“部分溶于”可知既有“碳酸钙”,又有“硫酸钡”;而有硫酸钡时,则一定含有硫酸钾与氯化钡。但整个推断过程中,始终无法确定硝酸钠的存在与否。
所以,原固体粉末中一定含有碳酸钙、硫酸钾和氯化钡,一定不含有氯化铁,可能含有硝酸钠。
2.框图型
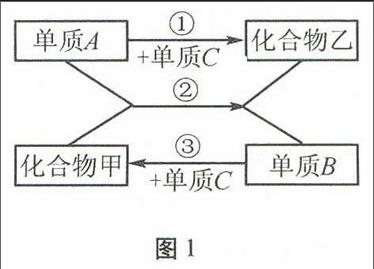
例2图1中的各物质均为初中化学常见物质。请根据图1所示关系回答:
图1
(1)甲物质中的元素共有种。
(2)反应②的基本反应类型为。
(3)若常温下乙为无色液体,则A为;反应②的化学方程式可能为。
解析(1)据“单质B+单质C→化合物甲”,可知甲物质中含有两种元素。
(2)反应②属于置换反应。
(3)据“常温下乙为无色液体”,推断乙为H2O,再结合所学过的有H2O生成的置换反应(即H2还原CuO或Fe2O3),可知A为H2,则C为O2。反应②的化学方程式可能为H2+CuOCu+H2O或3H2+Fe2O32Fe+3H2O。化合物甲可能是CuO或Fe2O3,单质B可能是Cu或Fe。
3.表格型推断题
例3有A、B、C、D、E五瓶失去标签的无色溶液,它们分别是NaOH、HCl、BaCl2、MgSO4、K2CO3中的一种。为了鉴别,各取少量溶液两两混合实验结果如表1所示。表中“↓”表示生成难溶或微溶的沉淀;“↑”表示有气体产生;“-”表示观察不到明显的现象变化(本实验条件下,生成的微溶物均以沉淀形式出现)。
表1
ABCDE
A↓——↓
B↓↑—↓
C—↑——
D———↓
E↓↓—↓
(1)根据实验现象,可以判断A-E的物质名称是:ABCDE;
(2)请从A-E这5种物质中选取适当物质,通过一种合理的途径制取氧化镁。按顺序写出各步反应的化学方程式。
解析将这五种物质两两混合,列表在相应位置标出有关的实验现象,如表2:
两表对照:题中表1的现象A有2个“↓”,B有2个“↓”一个“↑”,C有1个“↑”,D有1个“↓”,E有3个“↓”;表2对应的现象是BaCl2有2个“↓”,K2CO3有2“↓”一个“↑”,HCl有一个“↑”,NaOH有1个“↓”,MgSO4有3个“↓”,故A为氯化钡,B为碳酸钾,C为盐酸,D为氢氧化钠,E为硫酸镁。
表2
BaCl2K2CO3HClNaOHMgSO4
BaCl2↓——↓
K2CO3↓↑—↓
HCl—↑——
NaOH———↓
MgSO4↓↓—↓
4.关系式转化关系型
例4已知A、B、C、D、E、F6种物质的转化关系如下:
(1)A+B→C+H2O
(2)C+KOH→D↓(蓝色)+E
(3)B+D→C+H2O
(4)K2SO4+BaCl2→F↓(白色,不溶于稀硝酸)+KCl
根据上述变化关系,推断有关物质的化学式:
A;B;C;D;E;F。
解析其实该类题与前一类型一样,往往会出现明显的现象特征。本题的突破口在反应式(4),由复分解反应的知识可知:F中含Ba,又F为“白色且不溶于稀硝酸的物质”,故F为BaSO4。另一个突破口在反应式(2),因为D为“蓝色沉淀”,故可推得D为Cu(OH)2;可推得C为CuCl2。然后在(3)中可推得B为HCl,在(1)中可推得A为CuO。
5.流程图式
例5A是绿色粉末,G是蓝色溶液,X为常见的稀酸,B、C、D、E、F、H和Y是初中化学常见的物质。它们之间转化关系如图2所示,反应①、②、③、④和⑤是初中化学常见的反应。
图2
请回答下列问题。
(1)写出化学式:D,E,X。
(2)写出化学方程式:
反应②;
反应④。
解析该题应以两种物质的颜色为突破口,采用顺推与分层法相结合轻松解题。A为绿色粉末,分解成三种物质,说明它是Cu2(OH)2CO3,而Cu2(OH)2CO3分解可以生成CuO、H2O和CO2,题中提示G为蓝色溶液,所以D为CuO,G为CuSO4或CuCl2;B、C为CO2和H2O,学生对它们之间生成H2CO3比较熟悉,而题中是两种生成物,这就要求不可忽视CO2和H2O发生光和作用生成C6H12O6和O2。
通过图示提示E和H加热生成D,则说明E为O2、H为Cu,而Y为Zn、Fe等活泼金属。
答案:(1)CuO;O2;H2SO4(或HCl、HNO3)
(2)①6CO2+6H2O光叶绿素C6H12O6+6O2
②Fe+CuSO4Cu+FeSO4
(收稿日期:2015-08-03)

