乌梁素海浮游植物功能群季节演替规律及影响因子
李兴,李建茹,徐效清,白旭亮
1. 内蒙古师范大学 内蒙古节水农业工程研究中心,内蒙古 呼和浩特 010022;2. 内蒙古机电职业技术学院,内蒙古 呼和浩特 010017;3. 呼和浩特市市政工程管理局,内蒙古 呼和浩特 010017
乌梁素海浮游植物功能群季节演替规律及影响因子
李兴1,李建茹2,徐效清1,白旭亮3
1. 内蒙古师范大学 内蒙古节水农业工程研究中心,内蒙古 呼和浩特 010022;2. 内蒙古机电职业技术学院,内蒙古 呼和浩特 010017;3. 呼和浩特市市政工程管理局,内蒙古 呼和浩特 010017
浮游植物功能群在水生态系统中意义重大,能够生产氧气并为其他生物提供食物,维持其他生命的生存,进而保证水生态系统的平衡。目前,针对寒冷干旱地区浮游植物功能群与生境间关系的研究鲜见报道,本文以内蒙古典型的寒旱区湖泊乌梁素海为研究对象,为探究其浮游植物功能群特征及与环境因子的响应关系,于2011年6月─2013年8月间的不同季节对浮游植物进行了采样、测试,使用Excel和物种-环境因子关系双序图进行了分析。结果表明,乌梁素海共有23个常见功能群,每个功能群均具有代表种及其适应的生境环境特征。C、MP、W1、X2是湖区出现频率最高,生物量比重最大的优势功能群。C、MP全年均占优,且在温度较低的冬季、春季以及秋季比例较大。L0、J在春、夏季占优势。TC在夏季占优,X2在秋季、冬季占优,W1在冬季的比重较大。功能群组成具有明显的空间差异,功能群类型呈现湖区中部>湖区南部>湖区入口的规律。冗余直接梯度分析表明,功能群组与环境因子的相关性均在0.9以上,且功能群组与环境因子的累计方差为83.6%,湖区水深、温度、pH、总磷等环境因子是浮游植物功能群季节演替的主要驱动因子。结合乌梁素海实际环境特征,将功能群分为三大群落,分别为浅水区高盐度的功能群S1、MP、W1、C,高温深水低营养盐功能群P、L0、X1、F、J以及低温高营养盐功能群X2、TC、Y。
寒旱区;浮游植物,功能群;季节动态
传统的浮游植物群落研究方法是在对特定时段及环境内浮游植物物种按其形态特征进行分类的基础上,研究浮游植物种类组成、密度、生物量以及优势种的变化规律,从而反映和评价特定水域环境质量状况(李亚红等,2015;朱爱民等,2013;王丽等,2013)。而通常对浮游植物物种的分类,不仅需要扎实的分类学基础,而且物种分类的过程费时、费力,在很大程度上限制了该方法的广泛应用(Naselli,2000),同时优势种也并不能很好的反映其栖息环境的状况。2002年,Reynolds et al.(2002)正式提出了浮游植物功能群分组理论,它将传统Linnaeus植物学分类理论进行了拓展,并在很大程度上克服了传统分类方法的缺陷,着重将浮游植物的生理特征与特定生境变化机制相结合,实现了浮游植物群落演替与其特定栖息生境相匹配,揭示出特定栖息生境变化模式对浮游植物群落的生态选择机制,以及浮游植物群落对生境变化的响应过程。
目前,国内外众多学者关于浮游植物功能群方面的研究主要集中在温暖湿润地区的水库、河流和湖泊等(Teneva et al.,2010;Rychtecký et al.,2011)。而国内的研究仍处于初级阶段,积累的研究成果较少(张怡等,2012;刘足根等,2012),针对寒冷干旱地区湖泊浮游植物功能群演替规律的研究鲜见报道。因此,本文运用浮游植物功能群分组的方法,结合乌梁素海特定的气候、水文等生境状况,探讨浮游植物功能群的组成特点及演替规律,同时分析浮游植物功能群季节演替的主要驱动因子,为乌梁素海生态系统的研究及水华暴发积累丰富的基础数据,也为国内其它河流、湖泊等水域开展浮游植物功能群的研究提供一定的参考和借鉴。
1 材料与方法
1.1 研究区概况
乌梁素海位于我国北方内蒙古自治区巴彦淖
尔市乌拉特前旗境内,地理坐标介于 40°47′~41°03′N,108°43′~108°57′E。属于蒙新高原湖区典型的中温带季风气候,流域降雨少而蒸发量大,且经常出现多风天气,多年平均气温7.3 ℃,降水量为224 mm,蒸发量为1502 mm。全年无霜期为152 d,湖水于每年11月初结冰,直到翌年3月末到4月初开始融化,冰封期约为5个月。现有水域面积为285.38 km2,其中芦苇面积为118.97 km2,明水面积为111.13 km2,其中明水区内的85.7 km2为沉水植物密集区,湖水深度多数在0.5~2.5 m之间,蓄水量2.5~3.0亿m3,其补水来源的90%经总排干沟汇入乌梁素海后,从西山咀河口排入黄河。
1.2 样品采集与分析
采样点的布设参照水域生态系统观测规范(中国生态系统研究网络科学委员会,2007),同时根据乌梁素海的水动力特征、水生植物、入出湖口等分布特点以及水域较浅区域采样船无法到达的实际情况,在湖区共布设10个采样点(见图1)。取样使用GPS进行样点定位。取样时间为2011年6月─2013年8月,其中每年11月、12月、2月、3月、4月未采集样品(水体处于冻融过渡期,无法采集),其它时期每月一次。每个样点取两个平行样,同时将样品的采集时段控制在当天的 9:00─15:00。取样现场使用multi350i便携式水质分析仪进行水温(T)、水深(WD)、电导率(EC)、pH、溶解氧(DO)、透明度(SD)等水质参数的测定,同时采集水样带回实验室进行总氮(TN),总磷(TP)、总溶解性固体(TDS)等指标的测定,测定方法依据《水和废水监测分析方法(第四版)(增补版)》(国家环境保护总局,2002)。

图1 采样点位置图Fig. 1 Sampling sites
浮游植物定性样品用25号浮游生物网划“∞”形捞取,经 1%福尔马林溶液保存,用于种类鉴定和分析。浮游植物定量样品使用采水器采集1 L水样后加入鲁哥试剂固定,另加 1%的福尔马林液保存。将采集的浮游植物样品带回实验室后经静置、沉降浓缩至30 mL后,取0.1 mL浓缩样品置于显微镜下进行种类及密度鉴定。浮游植物种类鉴定参照《中国淡水藻类-系统、分类及生态》(胡鸿钧等,2006)和《淡水微型生物图谱》(周凤霞等,2005)等资料。
1.3 数据处理
采用CANOCO 4.5软件进行排序和制图。在进行对应分析之前,先将各月浮游植物功能群数据进行去趋势的间接梯度分析(Detrended correspondence analysis,DCA),结果发现每个排序轴的梯度长度值(Lengths of gradient)均小于3,因此采用线性模型的冗余直接梯度分析(Redundancy analysis,RDA)进行功能群与环境因子的排序更为合适。物种数据采用浮游植物功能群丰度数据,按照功能群在各月出现频率≥20%,且至少在一个月的相对丰度≥1%进行筛选。物种数据与环境因子数据(除pH)均进行lg(x+1)转换,以文件格式.env录入。在进行RDA分析时,还需要对所选的环境因子进行蒙特卡罗置换检验(Monte Carlo permutation test),以保证环境因子对浮游植物功能群有较好的解释。排序结果用物种-环境因子关系的双序图表示。
2 结果与分析
2.1 浮游植物物种组成与功能群划分
2011年6月─2013年8月,共发现浮游植物7门110属281种,绿藻为47属126种(45%),硅藻和蓝藻分别为25属64种(23%)和22属46种(16%),绿藻、硅藻以及蓝藻是乌梁素海的主要浮游植物种类(84%),其它裸藻、金藻、隐藻及甲藻类群出现的种属相对较少,分别为9属30种、4属8种、2属4种、1属3种。根据相关文献(Reynolds et al.,2002;Padisák et al.,2009),将研究期间所有浮游植物物种进行功能类群分组。共归纳出常见的23个功能类群(见图2),分别为A、C、D、P、F、G、X2、M、Y、X1、S1、T、TC、H1、SN、W1、W2、N、S2、X3、J、L0、MP。其中D(96.24%)、MP(88.73%)、F(87.79%)、C(87.32%)、J(84.97%)、X2(83.57%)、L0(76.53%)、W1(72.30%)、X1(69.95%)、S1(68.54%)、Y(59.15%)和P(58.22%)是出现频率较高的功能群。常见功能群、代表性种(属)及生境描述见表1。

图2 常见浮游植物功能组频率统计Fig. 2 Frequency distribution of functional groups
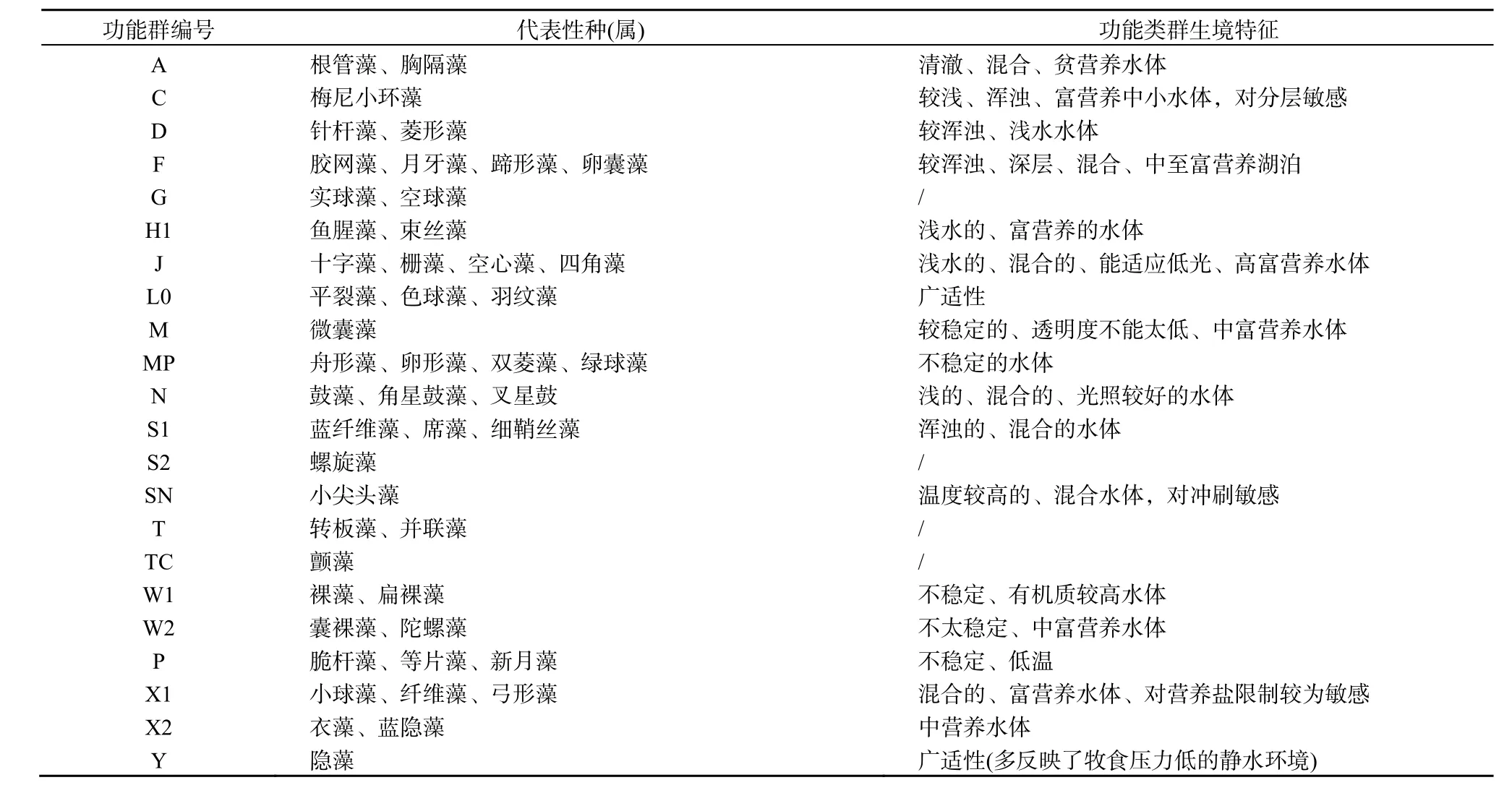
表1 常见功能群、代表性种(属)及生境描述Table 1 Representative species (genera) and habitat characteristics of phytoplankton functional groups
2.2 优势功能群的季节演替规律
浮游植物的演替过程是最适应特定生境条件的物种替代了其他物种,从而生物量占优的一系列的自发性过程的集合(李哲等,2011)。生物量占优势的物种发生交替可作为演替的标志。本文将功能群按月份计算其相对生物量,筛选出相对生物量≥10%的视为该月份的优势功能群。

表2 优势功能群组季节演替规律Table 2 Succession of dominant functional groups
结果显示,TC、X1、X2、Y、C、W1、D、MP、J、S1、L0、F、SN、N、H1、P是乌梁素海的优势功能群,其季节演替规律见表2。C+J组合是2011年初夏6月的主要优势功能群,为61.62%。进入夏季7月,优势功能群组明显增多,除TC为22.20%,其它均在10%左右。夏末8月,功能群组减少,TC、Y未形成优势功能群,W1、C、D的相对生物量增加。进入秋季,X2成为主要优势功能群,为40.32%,同时功能群数明显减少。10月,C+MP组合是主要优势功能群,为 47.42%。进入2012年1月,W1是主要优势功能群,为40.86%。X2也较大,为26.72%。春末5月,W1相对生物量明显下降,为21.94%。X2+Y组合演替为C+D+J组合,为47.90%。进入初夏6月,C+W1+J组合相对生物量略有增加。MP+D组合演替为L0+S1组合,为23.18%。夏季7月,MP+D又形成优势功能群。
L0+S1组合演替为TC+SN组合,为30%左右。夏末8月,优势功能群数明显减少。Y是主要优势功能群,为42.69%。进入秋季9月,MP+X2是主要优势功能群,为62.90%。10月,X2是主要优势功能群,达41.16%。进入2013年1月冬季,MP+C+W1组合是主要优势功能群,为 58.46%。5月,W1+MP+C组合仍是主要优势功能群,N+Y组合演替为J功能群,为11.24%。6月,J+C是主要优势功能群,为64.22%。7月,H1+TC组合为32.24%。P、J均在10%左右。8月,TC+H1组合相对生物量上升到 58.23%,为主要优势功能群。2011─2013年调查期间,优势功能群的演替过程呈现出一定的规律性。C、MP、W1、X2是乌梁素海湖区出现频率最多,且生物量比重较大的优势功能群。C、MP在全年均出现,且主要在温度较低的冬季以及春季、秋季较大。L0、J在每年的春、夏季易形成优势功能群。TC主要是在夏季形成优势功能群,H1仅在2013年夏季形成优势功能群。X2功能群在秋季、冬季形成优势功能群,W1功能在全年中均可能成为优势功能群,且冬季的生物量比重较大。
2.3 优势功能群的空间变化过程
将乌梁素海功能群分为包含优势功能群组的MP、C、D、H1、J、L0、TC、W1、X2、F、Y以及其它共 12个功能群组来讨论乌梁素海空间各样点的功能群组成差异(见图3)。利用Kruskal-Wallis对 12个功能群组进行非参数检验。结果显示,乌梁素海各样点间 C(χ2=70.304,P=0.000)、X2(χ2=44.886,P=0.000)、J(χ2=49.741,P=0.000)功能群组(以生物量计)具有极显著性差异;MP(χ2=21.403,P=0.011)、W1(χ2=21.190,P=0.012)、Y(χ2=20.787,P=0.014)功能群组(以生物量计)具有显著性差异,其它功能群组没有显著差异。
J11样点主要功能组成为C+MP+W1,其中以C占绝对优势,尤其在2011期间。2012年功能群组明显增加,但大部分期间仍以C+MP+W1为主要功能群组。2012年 8月较为特殊,功能群组成为W1+TC+Y。W1在每年的1月份和5月份的相对生物量增加。I12样点主要功能组成为W1+C+X2。不同季节功能群相对生物量差异较大。其中W1功能群在冬季组成较大。X2功能群在秋季9月、10月以及冬季1月组成较大。L11样点主要功能群组成为C+W1+X2。L15样点功能群组成在不同年际间的差异较为明显。2011年主要功能群组成为C+X2+Y+J,其中1月X2功能群占绝对优势,2012年5月下旬C+J,9月份MP占绝对优势。2013年其它功能群组所占比例较大,主要组成为W1+H1+J+其它。N13、Q8、Q10功能群组成较为丰富,主要组成为 C+MP+W1+X2+D+TC+ Y+C+H1。O10样点的功能群组成主要是J+TC+W1+X2+Y。X2功能群在9月份占绝对优势。S6样点,MP在2011年组成比例较大,X2在2011年 9月份成为主要功能群,其它月份主要为L0+D+C+MP+TC+X2+H1等组成。U4样点,组成为D+MP+L0+Y。D+MP在2011年期间是其绝对占优功能群组。其它功能在 2012─2013年间所占比例也较大。Y在夏季及冬季的比例较大。
整个乌梁素海湖区功能群组成的丰富程度呈现湖区中部>湖区南部>湖区入口的规律,其中功能群组较为丰富的湖区中部包括N13、Q8、Q10样点,其 主 要 功 能 群 组 为 C+MP+W1+X2+D+ TC+Y+C+H1;其次是湖区南部的S6、U4样点的功能群组,主要组成为L0+D+C+MP+TC+X2+H1;功能群组成最少的为入湖区域J11、I12以及L11样点,主要组成为C+W1+X2+MP。

表3 各采样点环境因子统计特征Table 3 Statistical characteristic of environmental variables in every sampling sites
2.4 浮游植物主要功能群与环境因子的关系

图3 优势功能群的时空分布特征Fig. 3 The spatial and temporal distribution of dominant functional groups
环境因子(表3)共选取水深(WD)、水温(T)、透明度(SD)、pH值、电导率(EC)、溶解氧(DO)、总氮(TN),总磷(TP)以及总溶解性固体(TDS)等9个水质参数。对所选的9个环境因子进行蒙特卡罗置换检验(Monte Carlo permutation test)。结果显示,WD(F=55.687,P=0.000)、T(F=42.252,P=0.000)、pH(F=36.112,P=0.009)等环境因子
呈极显著;TN(F=18.469,P=0.032)、EC(F=20.201,P=0.028)、TDS(F=24.628,P=0.019)、TP(F=30.218,P=0.011)呈显著;SD(F=5.567,P=0.058)、DO(F=10.214,P=0.052)不显著。RDA统计表 4、5中,轴1、轴2对浮游植物功能群的解释率分别为57.4%、18.6%,累计解释率为76.0%。功能群与环境因子的相关性均在0.9以上,且功能群与环境因子的累计方差为83.6%,说明RDA排序图中的前两个排序轴能很好地解释功能群与环境因子之间的关系。从环境因子与排序轴1、排序轴2的相关性表中可以看出,浮游植物功能群的季节分布主要受湖区的水深、温度、pH、总磷的影响较大。其中水深(r=-0.835)、温度(r=-0.727)与第一排序轴呈强负相关,而总磷(r=-0.761)、pH(r=-0.688)与第二排序轴呈强负相关。

表4 主要浮游植物功能群组与环境因子的冗余分析(RDA)统计特征Table 4 Statistical characteristic for RDA analysis on the main functional groups and environmental variables

表5 环境因子与排序轴1、排序轴2的相关系数Table 5 Correlation coefficients of environmental factors with the first two axes
位于RDA排序图右上方第一象限的环境因子有EC和TDS(图4),分别与排序轴1的相关系数为0.484、0.521,与排序轴2的相关系数为0.381、0.382。该区主要反映了湖区中离子含量的多少。S1、MP、W1、C功能群组与湖泊中离子含量关系较大,说明这些功能群组主要分布在盐度相对较高的水域中。位于RDA排序图左上方第二象限的环境因子有DO、T,分别与排序轴1的相关系数为-0.489、-0.727,与排序轴2的相关系数为0.298、0.207。F、 J功能群组与湖区水体温度、溶解氧的关系较大。位于 RDA排序图左下方第三象限的环境因子有WD、pH、TP,分别与排序轴1的相关系数为-0.835、-0.178、-0.030,与排序轴2的相关系数为-0.077、-0.688、-0.761。该区域主要是反映湖区水深及酸碱程度。P、L0、X1功能群组受水体温度及水深的影响较大。位于RDA排序图右下方第四象限的环境因子有 SD、TN,分别与排序轴 1的相关系数为0.038、0.413,与排序轴 2的相关系数为-0.305、-0.400。该区域主要是反映湖区营养盐水平。X2、TC、Y功能群受湖区营养盐的影响较大。

图4 浮游植物主要功能群组与环境因子的RDA排序Fig. 4 RDA analysis based on relationship between the main functional groups and envionmental facotors
总体而言,乌梁素海浮游植物主要功能群与环境因子的季节影响关系较为明显,可根据主要功能群组对环境因子的响应变化以及结合乌梁素海实际环境特征,将功能群分为三大群落,分别为浅水区高盐度的功能群组S1、MP、W1、C,高温深水低营养盐功能群组P、L0、X1、F、J以及低温高营养盐功能群组X2、TC、Y。
3 讨论
目前,将水域中浮游植物按照功能群划分的方法,已经在多数河流、湖泊中得到广泛的应用(Kruk et al.,2002;Becker et al.,2008;董静等,2013)。该划分方法更多地结合了浮游植物的生境、耐受性以及敏感性等特征,能更好地解释浮游植物物种对特定环境的响应关系。与浮游植物群落组成相似,功能群组成也要受到水域的水动力、水文、营养盐以及捕食作用等多个环境因子及过程的影响。水域不同其影响功能群组成及演替的主要环境因子也不同。乌梁素海优势功能群具有明显的组成特征及演
替规律,且乌梁素海浮游植物功能群组的季节分布主要受湖区的水深、温度、pH及总磷的影响较大。
整体来说,乌梁素海的功能群组成较为丰富,全年主要出现的功能群组有C、MP、W1、X2、D、L0、J、Y、S1、TC、H1及SN。按照功能类群对环境的指示作用分析,C功能群(梅尼小环藻)主要是分布在富营养化及水体混合程度较高的中型湖泊中,在较低温度及低光照的条件下形成优势,这一特征与乌梁素海湖泊的实际情况相一致。J功能群组(栅藻、空心藻)适合在较浅的、混合程度较好及富营养化较高的水域中生存。S1功能群组(假鱼腥藻、鞘丝藻)适应生境为浑浊的、混合的水域中(高国敬等,2013)。乌梁素海每年5月为春浇时期,大量的污染物排入湖区,且水量较大,尤其是在乌梁素海的入湖区,水体较浑浊,透明度较低,水下的光照较弱,因此,有利于J+S1功能群在春季及夏初形成优势功能群。L0功能类群(平裂藻、色球藻)所适应的生境为浅水或深水,贫营养到富营养水体,中等到大型湖泊,其生境范围较广,是广泛类群,主要在初春形成优势功能群组。研究表明,L0的分布与水体温度相关性较高,RDA图中也显示L0功能群分布与温度因子关系较为密切。根据黄享辉(高国敬等,2013)对不同营养水平的热带水库的优势功能群研究发现,低营养盐的水库中主要出现的功能群组有B、X2、Y、E、M、L0和MP,而超富营养状态的东丫湖中浮游植物功能群主要有W1、J、P、D耐污的功能群组。乌梁素海功能群也主要由MP、X2、Y以及W1、D、L0、J、S1等组成,说明乌梁素海功能群水体处于中-富营养化状态。同时富营养化及有机污染较严重水库中 P、W 和 J功能群主要与水体中的营养盐相关性较大,但在乌梁素海的RDA分析中显示,J、P以及L0、X1均处于低营养盐的环境。分析其原因可能是,乌梁素海营养盐的总体水平偏高,尤其冬季营养盐浓度最高,因此在各季节变化中营养盐不会成为功能群的限制因子。D功能群组(尖针杆藻)能适应透明度较低的湖泊,甚至是河流水体。在乌梁素海春夏季D功能群组也占一定的优势,且主要在湖泊南部的开阔水域中分布较多,主要原因是该区域水深较大,水面为开阔水域,易受到风的作用而增强水动力条件。W1(尖尾裸藻)、Y(卵形隐藻)主要与水域中总氮及总磷的关系较大,但温度也是其主要的限制因子。乌梁素海水体环境较为特殊,除了受季节变化,它主要还受入湖口污染物负荷的影响,因此,属于受外界干扰较大且不稳定的湖泊环境。
4 结论
(1)乌梁素海湖区共 23个常见功能群,D、MP、F、C、J、X2、L0、W1、X1、S1、Y、P是出现频率较多的浮游植物功能群。优势功能群为C、MP、X1、X2、W1、TC、Y、D、J、S1、L0、F、SN、N、H1、P。
(2)调查期间优势功能群的演替过程呈现出一定的规律性。C、MP、W1、X2是乌梁素海湖区出现频率最高,且生物量比重较大的优势功能群。其中C、MP在各季节均形成优势功能群,且相对生物量在温度较低的冬季、春季以及秋季较大。L0、J在每年的春、夏季形成优势功能群。TC主要是在夏季形成优势功能群,H1仅在2013年夏季形成优势功能群。X2功能群在秋季、冬季占有优势,W1功能在全年中均可能成为优势功能群,且冬季的生物量比重较大。
(3)功能群组成具有明显的空间差异,呈现湖区中部>湖区南部>湖区入口的规律。湖区中部包括N13、Q8、Q10样点,其功能群组最为丰富(C+MP+W1+X2+D+TC+Y+H1),其次是湖区南部的S6、U4样点(L0+D+C+MP+TC+X2+H1),入湖区域J11、I12、L11样点组成最少(C+W1+X2 +MP)。
(4)乌梁素海湖区水深、温度、pH及总磷等环境因子是浮游植物功能群季节演替的主要驱动因子。结合乌梁素海实际环境特征,可将功能群分为三大群落,分别为浅水区高盐度的功能群组S1、MP、W1、C,高温深水低营养盐功能群组P、L0、X1、F、J以及低温高营养盐功能群组X2、TC、Y。
BECKER V, HUSZAR V L, NASELLI-F, et al. 2008. Phytoplankton equilibrium phases during thermal stratification in a deep subtropical reservoir [J]. Freshwater Biology, 53(5): 952-963.
KRUK C, MAZZEO N, LACEROT G, et al. 2002. Classification schemes for phytoplankton: a local validation of a functional approach to the analysis of species temporal replacement [J]. Journal of Plankton Research, 24(9): 901-912.
NASELLI F. 2000. Phytoplankton assemblages in twenty-one sicilian reservoirs: relationships between species composition and environmental factors [J]. Hydrobiologia, 424(1): 1-11.
PADISÁK J, CROSSETTI L O, NASELLI F. 2009. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates [J]. Hydrobiologia, 621(1): 1-19.
REYNOLDS C S, HUSZAR V, KURK C, et al. 2002. Towards a functional classification of the freshwater phytoplankton [J]. Journal of Plankton Research, 24(5): 417-428.
RYCHTECKÝ P, ZNACHOR P. 2011. Spatial heterogeneity and seasonal succession of phytoplankton along the longitudinal gradient in a eutrophic reservoir [J]. Hydrobiologia, 663(1): 175-186.
TENEVA I, MLADENOV R, BELKINOVA D, et al. 2010. Phytoplankton community of the drinking water supply reservior Borovitsa (South
Bulgaria) with an emphasis on cyanotoxins and water quality [J]. Central European Journal of Biology, 5(2): 231-239.
董静, 李艳晖, 李根保, 等. 2013. 东江水系浮游植物功能群季节动态特征及影响因子[J]. 水生生物学报, 37(5): 836-843.
高国敬, 肖利娟, 林秋奇, 等. 2013. 海南省典型水库浮游植物功能类群的结构特征与水质评价[J]. 生态科学, 32(2): 144-150.
国家环境保护总局. 2002. 水和废水监测分析方法(第四版)(增补版)[M].北京: 中国环境科学出版社: 88-284.
胡鸿钧, 魏印心. 2006. 中国淡水藻类-系统、分类及生态[M]. 北京: 科学出版社: 23-903.
黄享辉, 胡韧, 雷腊梅, 等. 2013. 南亚热带典型中小型水库浮游植物功能类群季节演替特征[J]. 生态环境学报, 22(2): 311-318.
李亚红, 周筝, 赵小芳, 等. 2015. 天津大港发电厂附近海域浮游植物群落结构及与环境因子的相关性[J]. 安全与环境学报, 15(5): 367-373.
李哲, 方芳, 郭劲松, 等. 2011. 三峡小江(澎溪河)藻类功能分组及其季节演替特点[J]. 环境科学, 2(32): 392-400.
刘足根, 张柱, 张萌, 等. 2012. 赣江流域浮游植物群落结构与功能类群划分[J]. 长江流域资源与环境, 21(3): 375-384.
王丽, 魏伟, 周平, 等. 2013. 铜陵市河流冬季浮游植物群落结构及其与环境因子的关系[J]. 应用生态学报, 24(1): 243-250.
张怡, 胡韧, 肖利娟, 等. 2012. 南亚热带两座不同水文动态的水库浮游植物的功能类群演替比较[J]. 生态环境学报, 21(1): 107-117.
中国生态系统研究网络科学委员会. 2007. 水域生态系统观测规范[M].北京: 中国环境科学出版社: 7-9.
周凤霞, 陈剑虹. 2005. 淡水微型生物图谱[M]. 北京: 化学工业出版社: 35-178.
朱爱民, 胡菊香, 李嗣新, 等. 2013. 三峡水库长江干流及其支流枯水期浮游植物多样性与水质[J]. 湖泊科学, 25(3): 378-385.
Seasonal Succession of Phytoplankton Functional Groups and Their Relationship with Environmental Factors in Wuliangsuhai Lake
LI Xing1, LI Jianru2, XU Xiaoqing1, BAI Xuliang3
1. Inner Mongolia engineering research center for water-saving agriculture, Inner Mongolia Normal University, Hohhot 010022, China; 2. Hydraulic and Civil engineering department, Inner Mongolia technical college of mechanics and electrics, Hohhot 010017, China; 3. Municipal Engineering Administration Bureau, Hohhot 010017, China
Phytoplankton functional groups plays an important role in aquatic ecosystems. Phytoplankton can produce oxygen and food, which sustain all other life forms, ensuring aquatic ecological balance. Information about phytoplankton functional groups related to environmental conditions in Cold and Arid Regions is little. Wuliangsuhai Lake is located in cold and arid regions of Inner Mongolia and is a typical grass algae lake. To explore the characteristics of phytoplankton functional groups related to environmental conditions, phytoplankton were collected and analyzed from June 2011 to August 2013, and they were analyzed using Excel and species-environmental factors biplot. The results showed that twenty-three common functional groups were found in Wuliangsuhai Lake. In the above function group C, MP, W1 and X2 appeared the most frequent, and had the largest proportion in dominant functional groups. C and MP were the dominant species in the whole year, especially in the relatively low temperature winter, as well as spring and autumn. L0and J were the dominant species in spring and summer. TC was the dominant species in summer. X2 was the dominant species in autumn and winter. W1 hold a large proportion in winter. Functional groups had significant spatial differences. The spatial variance of functional groups was central lakes > southern lakes > lakes entrance. Redundancy analysis showed that correlation between phytoplankton functional groups and environmental factors were more than 0.9, cumulative variance of species and environmental variables is 83.6%. Lake water depth, temperature, pH and other environmental factors were the main driving factors on seasonal dynamics of phytoplankton functional groups. Combined with the actual environmental characteristics in Wuliangsuhai Lake, functional groups were divided into three categories and respectively as shown below: Functional groups were S1, MP, W1 and C which located in shallow water with high salinity. Functional groups were P, L0, X1, F and J which located in high temperature deepwater with low-nutrient. Functional groups were X2, TC and Y which is located in low temperature water with high nutrient.
cold and arid regions; phytoplankton; functional groups; seasonal dynamics
10.16258/j.cnki.1674-5906.2015.10.012
X826
A
1674-5906(2015)10-1668-08
李兴,李建茹,徐效清,白旭亮. 乌梁素海浮游植物功能群季节演替规律及影响因子[J]. 生态环境学报, 2015, 24(10): 1668-1675.
LI Xing, LI Jianru, XU Xiaoqing, BAI Xuliang. Seasonal Succession of Phytoplankton Functional Groups and Their Relationship with Environmental Factors in Wuliangsuhai Lake [J]. Ecology and Environmental Sciences, 2015, 24(10): 1668-1675.
国家自然科学基金项目(51469026);内蒙古青年科技英才计划(NJYT-15-B09);内蒙古人才开发基金项目
李兴(1981年生),男,副研究员,博士,研究方向为水环境保护与水污染控制。E-mail: lixinggmm@163.com
2015-09-02

