黄芩素对A375细胞黑素合成的抑制作用及相关细胞信号通路调控的初步研究
陈 晨, 徐艳明, 王 雪, 耿 放, 刘国良, 雷双媛, 张 宁
(1.黑龙江中医药大学,黑龙江哈尔滨150040;2.哈尔滨师范大学,黑龙江哈尔滨150025)
黄芩素对A375细胞黑素合成的抑制作用及相关细胞信号通路调控的初步研究
陈 晨, 徐艳明, 王 雪, 耿 放*, 刘国良, 雷双媛, 张 宁*
(1.黑龙江中医药大学,黑龙江哈尔滨150040;2.哈尔滨师范大学,黑龙江哈尔滨150025)
目的 研究黄芩素对体外培养的A375细胞黑素合成的影响及丝裂原活化蛋白激酶 (MAPK)信号通路与该作用的相关性。方法 用黄芩素处理A375细胞,采用四甲基噻唑蓝 (MTT)法测定A375细胞的活性,NaOH法测定黑素量,多巴氧化法测定酪氨酸酶(TYR)活性,RT-PCR法测定TYR、酪氨酸酶相关蛋白-1(TRP-1)和TRP-2以及MAPK信号通路关键蛋白激酶ERK1、ERK2、JNK2的mRNA表达。结果 0.1~0.001μmol/L的黄芩素可明显抑制A375细胞黑素合成及TYR活性,0.1μmol/L黄芩素明显下调A375细胞TYR、TRP-1、TRP-2 mRNA表达,以及ERK1、ERK2、JNK2 mRNA表达。结论 黄芩素具有抑制A375细胞的黑素合成的作用,其机制可能与抑制TYR活性和/或下调TYR、TRP-1及TRP-2 mRNA表达,以及抑制ERK1、ERK2、JNK2的表达有关。
黄芩素;A375细胞;黑素;MAPK信号通路
黑素代谢障碍是黄褐斑产生的主要病机。黑素在黑素细胞内由酪氨酸经酪氨酸酶氧化而合成,酪氨酸酶 (TYR)过表达导致黑素合成亢进。近年来研究发现,MAPK信号通路参与了黑素细胞中黑素生成的调控,在调节黑素细胞生理活动及功能方面发挥重要作用[1]。Jang Ji Yeon[2]等体外培养鼠B16 F10黑素瘤细胞发现,甘松提取物能够诱导MEK/ERK磷酸化和PI3K/Akt信号激活,抑制环磷酸腺苷(cAMP)表达水平来下调小眼畸形转录因子(MITF)和TRP蛋白表达,从而抑制TYR活性,抑制黑素的合成。杜仲是青娥方中君药,能够使未成熟小鼠子宫质量增加,阴道细胞角化提前进入动情周期,促使未成熟小鼠靶器官发育,发挥雌激素样作用[3]。黄芩素是杜仲的有效成分,属雌激素类化合物。李晓红等[4]通过研究发现黄芩素能够诱导雌激素反应元件 (ERE)的激活来下调MITF蛋白表达,对TYR活性有抑制作用,从而降低黑素合成起到脱色素作用。雌激素受体 (ER)的生理作用与MAPK信号通路的转导密切相关,MAPK家族主要包括三个亚家族—细胞外调节蛋白激酶(ERK1/2)、c-JunN末端蛋白激酶(JNK1/ 2)和p38蛋白激酶 (p38 MAPK)[5]。因此,本研究探讨黄芩素对黑素细胞黑素分泌的调节作用以及与MAPK信号通路的相关性,初步确定黄芩素对黄褐斑的潜在治疗作用及作用机制。
1 材料与仪器
1.1 材料 人黑素瘤细胞A375(中国科学院细胞中心提供);DMEM培养液(美国Gibco生物公司);二甲基亚砜DMSO(美国Sigma公司);四甲基噻唑蓝MTT(美国Sigma公司);Trizol细胞裂解液 (美国 Gibco生物公司);焦碳酸二乙酯(DEPC) (美国Gibco生物公司);PCR试剂盒(上海生工生物工程技术服务有限公司)。
1.2 仪器 TGL-16G-C型高速台式冷冻离心机(上海安亭科学仪器厂),PCR扩增仪 (德国Biometra公司),酶标仪 (上海热电仪器有限公司),Olympus倒置显微镜(日本Olympus株式会社),Heλiosγ可见紫外分光光度计 (美国热电公司),DYYOC型电泳仪 (北京市六一仪器厂),Cham1Ge15000凝胶成像系统 (北京赛智创业科技有限公司)。
1.3 药品 黄芩素购于南京泽朗科技有限公司,纯度98%,批号为491678120525;雌二醇购于中国食品药品检定研究院,纯度98%,批号为150-28-21。
2 实验方法
2.1 药液配制 精密称取雌二醇5.5 mg,用4 mL无水乙醇溶解,配制成20μmol/L的原液,实验前再用DMEM完全培养液稀释至0.001μmol/L,待用。精密称取黄芩素5.4 mg,用DMEM完全培养液溶解,配制成200μmol/L的原液,实验前再梯度稀释成0.001~100μmol/L的6种药液,待用。
2.2 细胞分组与处理 选取对数生长期的A375细胞常规消化,计数,以3×103个/孔接种细胞于96孔培养板上,每孔200μL,24 h后,分别设空白对照组、阳性对照组(0.001μmol/L的雌二醇)、黄芩素组 (设定浓度的黄芩素),各组设6个复孔。将另一部分细胞以9×104个/孔接种细胞于6孔培养板中,每孔2 mL,分组处理同前,每组设4个复孔。培养48 h后,分别进行MTT实验、黑素含量实验、TYR活性实验、RT-PCR实验。
2.3 指标检测
2.3.1 细胞活性 向96孔板各孔加20μL MTT(5 mg/mL),继续培养4 h,弃上清,每孔加入150μL DMSO振荡10 min,选择490 nm在酶标仪上测定各孔吸光度值。细胞增值率用D490表示。
细胞增值抑制率=D490给药/D490空白×100%
2.3.2 黑素含量 弃掉6孔板培养液,PBS洗2次,每孔加入1 mL 0.25%胰酶消化10 min后,再加入1 mL DMEM培养液终止消化,收集各组细胞悬液至15 mL离心管中,1 500 r/min离心3 min,弃上清,加入1 mol/L的NaOH溶液100μL,混匀,37℃水浴1 h,加入400μL双蒸水,混匀,从每支离心管中取出100μL溶液加至96孔板中,选择490 nm在酶标仪上测定各孔吸光度值。黑素合成用D490表示。
2.3.3 TYR活性 弃掉96孔板培养液,PBS洗2次,每孔加入1%Triton X-100溶液100μL,迅速将其置于-80℃冰箱中30 min,取出室温融化。每孔加入50μL预热的0.2%左旋多巴(L-dopa)溶液,37℃下反应3 h,选择490 nm在酶标仪上测定各孔吸光度值。TYR活性用D490表示。
2.3.4 RT-PCR法检测细胞TYR、TRP-1、TRP-2、ERK1、ERK2、JNK2 mRNA表达 收集6孔板中各组细胞,按照Trizol说明书提取总RNA,各组以RNA 3μg进行反转录。反应条件:25℃反应10 min,42℃反应60 min,70℃反应10 min终止反应,得到cDNA。引物序列由上海生工生物工程技术服务有限公司设计与合成,以β-actin为内参照,引物序列信息见表1。
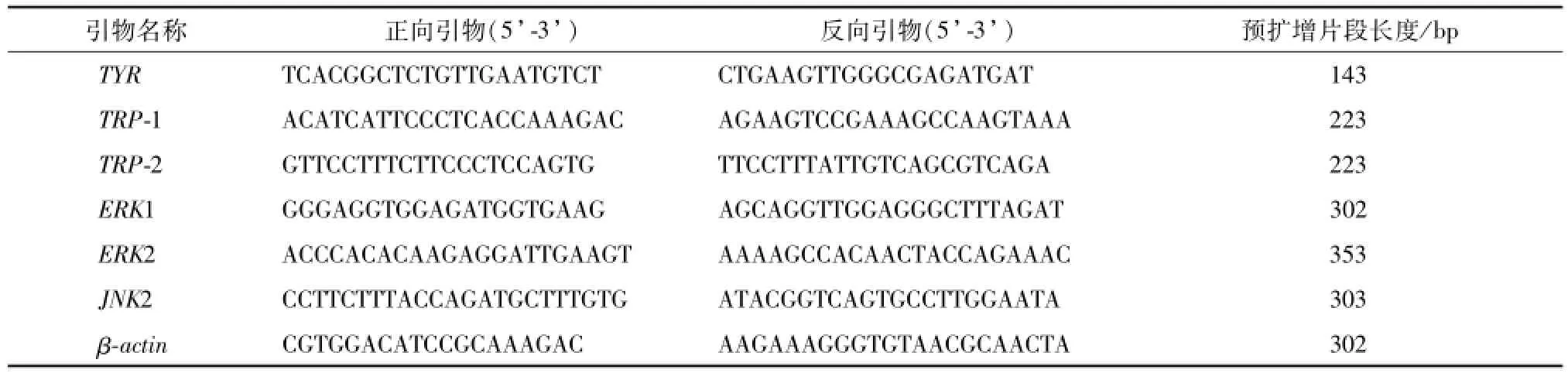
表1 RT-PCR引物序列Tab.1 Primer sequences of RT-PCR
扩增条件:94℃预变性时间2 min;94℃变性30 s、退火40 s(TYR 54℃、TRP-1 57℃、TRP-2 55℃、ERK1 57℃、ERK2 54℃、JNK2 54℃、βactin 54℃)、72℃延伸40 s,35个循环;72℃终止延伸10 min。PCR扩增产物5μL与6×DNA loading buffer 1μL混匀,加入1.5%琼脂糖凝胶中,80 V恒压电泳30 min后,凝胶成像系统观察电泳结果,应用gel-pro凝胶分析软件对电泳谱带进行分析,用校正值(TYR/β-actin、TRP-1/β-actin、TRP-2/β-actin、ERK1/β-actin、ERK2/β-actin、JNK2/β-actin)表示mRNA水平。
2.4 统计学方法 实验数据用SPSS 19.0软件进行单因素方差分析(ANOVA),用LSD法对数据进行两两比较。P<0.05具有统计学意义。
3 结果
3.1 对细胞活性的影响 结果见表2,与空白对照组相比,100、10、1μmol/L的黄芩素对细胞的增殖有显著抑制作用 (P<0.05或P<0.01),说明上述剂量的药物对细胞有毒性作用,不适合进行下一步的药效学研究;0.1、0.01、0.001μmol/L的黄芩素不影响细胞活性。
3.2 对黑素合成的影响 结果见表3,与空白对照组相比,黄芩素组给药剂量为 0.1、0.01、0.001μmol/L时,对黑素合成有显著的抑制作用(P<0.05或P<0.01);阳性对照组对黑素合成有极显著的促进作用 (P<0.01)。
3.3 对TYR活性的影响 结果见表4,与空白对照组相比,黄芩素组给药剂量为 0.1、0.01、0.001μmol/L时,对TYR活性有极显著的抑制作用(P<0.01);阳性对照组对TYR活性有极显著的促进作用 (P<0.01)。
3.4 对细胞TYR、TRP-1、TRP-2 mRNA表达的影响
表2 黄芩素对A375细胞活性的影响 (,n=6)Tab.2 Effects of bicalein on the activity of A375 cells(,n=6)

表2 黄芩素对A375细胞活性的影响 (,n=6)Tab.2 Effects of bicalein on the activity of A375 cells(,n=6)
注:与空白对照组比较,*P<0.05,**P<0.01
组别 剂量/(μmol·L-1) 吸光度值 细胞增殖率/% 0.336±0.025 100阳性对照组 0.001 0.339±0.036 101黄芩素组 100 0.124±0.012** 37**黄芩素组 10 0.279±0.024** 83**黄芩素组 1 0.300±0.047* 89*黄芩素组 0.1 0.329±0.023 98黄芩素组 0.01 0.319±0.033 95黄芩素组空白对照组-0.001 0.326±0.041 97
表3 黄芩素对A375细胞黑素合成的影响 (,n=4)Tab.3 Effects of baicalein on the synthesis of melanocytes of A375(,n=4)

表3 黄芩素对A375细胞黑素合成的影响 (,n=4)Tab.3 Effects of baicalein on the synthesis of melanocytes of A375(,n=4)
组别 剂量/(μmol·L-1) 吸光度值 与空白组D比值/% - 0.074±0.003 100阳性对照组 0.001 0.093±0.006** 125**黄芩素组 0.1 0.060±0.006** 81**黄芩素组 0.01 0.063±0.004** 85**黄芩素组 0.001 0.065±0.002* 88空白对照组*
注:与空白对照组比较,*P<0.05,**P<0.01表4 黄芩素对A375细胞TYR活性的影响(,n=6)Tab.4 Effect of baicalein on TYR activity of A375 cells(,n=6)

注:与空白对照组比较,*P<0.05,**P<0.01表4 黄芩素对A375细胞TYR活性的影响(,n=6)Tab.4 Effect of baicalein on TYR activity of A375 cells(,n=6)
注:与空白对照组比较,*P<0.05,**P<0.01
组别 剂量/(μmol·L-1) 吸光度值 与空白组D比值%空白对照组- 0.079±0.002 100阳性对照组 0.001 0.096±0.003** 121**黄芩素组 0.1 0.068±0.004** 86**黄芩素组 0.01 0.069±0.002** 87**黄芩素组 0.001 0.070±0.002** 88**
结果见表5和图1,与空白对照组相比,黄芩素组(0.1μmol/L)TYR、TRP-1、TRP-2的mRNA的表达均明显降低(P<0.05或P<0.01),阳性对照组TYR、TRP-1、TRP-2的mRNA表达均明显增强(P<0.01)。
表5 TYR、TRP-1、TRP-2 m RNA的RT-PCR产物凝胶电泳定量分析结果(,n=4)Tab.5 Quantitative analysis of gel electrophoresis results on the RT-PCR products of TYR、TRP-1、TRP-2 mRNA(,n=4)

表5 TYR、TRP-1、TRP-2 m RNA的RT-PCR产物凝胶电泳定量分析结果(,n=4)Tab.5 Quantitative analysis of gel electrophoresis results on the RT-PCR products of TYR、TRP-1、TRP-2 mRNA(,n=4)
注:与空白对照组比较,*P<0.05,**P<0.01
-actin空白对照组组别 剂量/(μmol·L-1) TYR/β-actin TRP-1/β-actin TRP-2/β 0.602±0.013 0.534±0.032 0.574±0.089阳性对照组 0.001 0.859±0.062** 0.698±0.065** 0.845±0.046**黄芩素组 0.1 0.499±0.025* 0.235±0.040** 0.437±0.035 -*

注:a.阳性对照组;b.黄芩素组(0.1μmol/L);c.空白对照组;A.β-actin与TYR的PCR结果;B.β-actin与TRP-1的PCR结果;C.β-actin与TRP-2的PCR结果
3.5 对细胞ERK1、ERK2、JNK2 mRNA表达的影响 结果见表6和图2,与空白对照组相比,黄芩素组(0.1μmol/L)ERK1、ERK2、JNK2的mRNA表达均明显降低 (P<0.05),阳性对照组ERK1、ERK2、JNK2的mRNA表达均明显增强(P<0.01)。

图2 黄芩素对A375 ERK1、ERK2、JNK2 m RNA表达水平的影响Fig.2 Effects of baicalein on themRNA expression levels of ERK1,ERK2,JNK2 in A375 cells
表6 ERK1、ERK2、JNK2 m RNA的RT-PCR产物凝胶电泳定量分析结果(,n=4)Tab.6 Quantitative analysis of gel electrophoresis results on the RT-PCR products of ERK1,ERK2,JNK2 mRNA(,n=4)

表6 ERK1、ERK2、JNK2 m RNA的RT-PCR产物凝胶电泳定量分析结果(,n=4)Tab.6 Quantitative analysis of gel electrophoresis results on the RT-PCR products of ERK1,ERK2,JNK2 mRNA(,n=4)
注:与空白对照组比较,*P<0.05,**P<0.01
-actin空白对照组组别 剂量/(μmol·L-1) ERK1/β-actin ERK2/β-actin JNK2/β 0.326±0.035 0.517±0.018 0.321±0.013阳性对照组 0.001 0.485±0.006** 0.853±0.087** 0.483±0.036**黄芩素组 0.1 0.272±0.014* 0.410±0.012* 0.271±0.013 -*
4 讨论
黄褐斑是一种常见的获得性色素沉着性皮肤病,黑素在皮肤内的增多是导致黄褐斑产生的主要原因[6]。黑素生成及代谢的任何一个环节发生改变,都可引起色素障碍性皮肤病。人体内黑素在黑素细胞黑素体中合成,其合成受酪氨酸酶(TYR)、酪氨酸酶相关蛋白-1(TRP-1)和TRP-2调控,TYR在黑素合成过程中起到关键限速酶的作用,而TRP-1和TRP-2在黑素生物合成途径下游起作用[7-9]。人黑素细胞合成黑素的量取决于酪氨酸酶的活性水平,降低酪氨酸酶活性可阻止皮肤黑素生成,能够抑制酪氨酸酶活性并减少黑素生成
的药物可以提高黄褐斑的治疗效果[10]。在黑素瘤A375细胞中存在着雌激素受体 (ER),雌激素作为一种细胞外信号,其发挥作用的途径一般是与ER结合,MAPK信号通路是细胞外信号引起细胞生理反应的共同途径。雌激素通过皮肤细胞ER对黄褐斑的产生有调节作用,而植物雌激素有类雌激素作用。黄芩素作为一种植物雌激素能够抑制MCF-7和MDA-MB-231细胞增殖并且诱导细胞凋亡[11]。因此,选择具有雌激素样作用成分黄芩素来进行治疗黄褐斑的研究。
实验表明,黄芩素安全剂量作用于A375细胞后,能显著抑制细胞黑素合成及TYR活性且呈正相关,抑制A375细胞中TYR、TRP-1、TRP-2的mRNA表达,提示黄芩素可能通过抑制TYR活性和/或抑制TYR、TRP-1、TRP-2 mRNA表达抑制黑素合成,并且黄芩素能显著抑制MAPK信号通路蛋白激酶ERK1、ERK2、JNK2的mRNA表达,推测MAPK信号通路可能参与了黑素细胞中黑素生成的调控。
现在医学中常用的脱色剂等虽对黄褐斑有一定的疗效,但长期应用容易产生毒副作用。中药因其毒副作用小,疗效较好,受到越来越多的关注。陈龙等[12]通过研究发现养颜青娥丸对黑素细胞的增殖以及酪氨酸酶的活性有抑制作用,对黑素合成的量也有降低作用,认为养颜青娥丸具有治疗黄褐斑的作用。养颜青娥丸处方中的君药杜仲对黑素细胞增殖及酪氨酸酶活性有抑制作用且对黑素合成有降低作用,对黄褐斑有一定的治疗作用[12]。李洪武[13]等用中波紫外线 (UVB)诱导豚鼠背部肤色素沉着后用白术、茯苓、山茱萸等乙醇提取物治疗,可显著抑制TYR活性,茯苓、白术乙醇提取物能在基因转录水平下调豚鼠皮肤酪氨酸酶mRNA表达抑制酶蛋白生物合成。我们通过从ER信号通路角度,探索植物雌激素成分黄芩素对相关细胞信号通路的调控作用,推测中药植物雌激素治疗黄褐斑的分子机制,探讨黄芩素对黄色斑等色素性皮肤病可能具有的治疗作用,为合理利用中药植物雌激素防治黄褐斑等皮肤色素沉着疾病提供理论基础,更好的指导临床用药。
[1] 姜泽群.几种中药有效成分促黑色素生成的机制研究[D].武汉:华中科技大学,2009.
[2] Jang JY,Kim H N,Kim Y R,et al.Partially purified components of Nardostachys chinensis suppress melanin synthesis through ERK and Aktsignaling pathway with cAMP down-regulation in B16F10 cells[J].J Ethnopharmacol,2011,137(3):1207-1214.
[3] Xu Y,Zhang Z J,Geng F,et al.Treatmentwith Qing'E,a kidney invigorating Chinese herbal formula,antagonizes the estrogen decline in ovariectomized mice[J].Rejuvenation Res,2010,13(4):497-488.
[4] 李晓红,栗玉珍,党 林,等.黄芩素通过ERK途径抑制黑素生成 [C]//中华医学会第16次全国皮肤性病学术年会摘要集.广州:中华医学会皮肤性病学分会,2010.
[5] Cohen P.The search for physiological substrates of MAP and SAP kinases in mammalian cells[J].Trends Cell Biol,1997,7(9):353-361.
[6] Cayce K A,Mcmichael A J,Feldman S R.Hyperpigmentation:an overview of the common afflictions[J].Dermatol Nurs,2004,16(5):401-406,413-416,417.
[7] Hashimoto Y,Ito Y,Kato T,et al.Expression profiles of melanogenesis-related genes and proteins in acquired melanocytic nevus[J].JCutan Pathol,2006,33(3):207-215.
[8] Lu F,Yan D,Zhou X,et al.Expression ofmelanin-related genes in cultured adult human retinal pigment epithelium and uveal melanoma cells[J].Mol Vis,2007,13(3):2066-2072.
[9] Fang D,Kute T,Setaluri V.Regulation of tyrosinase-related protein-2(TYRP-2)in human melanocytes:relationship to growth and morphology[J].Pigment Cell Res,2001,14(2):132-139.
[10] 赵玲玲,张理平.抑制酪氨酸酶药物研究新进展[J].海峡药学,2009,21(12):124-126.
[11] 徐维恒,肖 雷,马宜明.黄芩素对乳腺癌细胞MCF-7和MDA-MB-231增殖的影响[J].中国药师,2011,14(1):26-28.
[12] 陈 龙,郑 义,高 进,等.养颜青娥丸对小鼠B16黑素瘤细胞株黑素合成和酪氨酸酶的影响[J].中国医院药学杂志,2002,22(3):151-153.
[13] 李洪武,朱文元,夏明玉,等.白术及茯苓提取物对豚鼠皮肤酪氨酸酶mRNA基因表达水平的影响[J].中华皮肤科杂志,2001,34(2):134-135.
Inhibitory effect of melanogenesis in A375 cells and related cell signaling pathways regulating m echanism of baicalein
CHEN Chen, XU Yan-ming, WANG Xue, GEN Fang*, LIU Guo-liang, LEI Shuang-yuan,ZHANG Ning*
(1.Heilongjiang University of Chinese Medicine,Harbin 15OO4O,China;2.Harbin Normal University,Harbin 15OO25,China)
AIM To study the effects of baicalein on melanogenesis and investigate the relationship between MAPK signal pathway and the role in A375 cell lines.METHODS The A375 cell lineswere treated with baicalein.Effects of baicalein on cell viability,tyrosinase(TRY)activity and melanogenesis in cultured A375 cells were measured by MTTmethod,NaOH method and L-dopa oxidation method,respectively.RT-PCR wasapplied to measuring themRNA expression levels of(TYR)and tyrosinase related proteins and themRNA expression levels of ERK1,ERK2 and JNK2.RESULTS 0.1~0.001μmol/L baicalein can significantly inhibitmelanin synthesis and TYR activities in A375 cell lines.Baicalein(0.1μmol/L)can significantly inhibit TYR,TRP-1,TRP-2 mRNA and ERK1,ERK2,JNK2 mRNA expression levels.CONCLUSION It is assumed that baicalein can significantly suppressmelanogenesis of A375 cells.The possiblemolecularmechanism of baicalein inhibitingmelanin synthesismay be by cutting TYR,TRP-1 and TRP-2 mRNA expression quantity and associating with the inhibi-
baicalein;A375 cells;melanin;MAPK signal pathway
R966
A
1001-1528(2015)12-2600-05
10.3969/j.issn.1001-1528.2015.12.006
2014-07-15
国家自然科学基金面上项目 (81274035);黑龙江省自然科学基金面上项目 (D201234);黑龙江省博士后科研启动金(LBH-Q13162);黑龙江中医药大学优秀创新人才支持计划资助 (2012)
陈 晨(1991—),女,硕士生,主要从事中药理学研究。Tel:(0454)6050350,E-mail:chenchen1208@yeah.net
*通信作者:张 宁 (1974—),男,博士,副教授,主要从事中药药效物质基础及体内代谢研究。Tel:(0454)6050350,E-mail:zhangning0454@163.com耿 放 (1981—),女,博士,副教授,硕士生导师,主要从事天然药物活性成分研究。Tel:(0451)82475863,Email:gengfang1980@163.com
日期:2014-10-17
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20141017.1200.001.html
tion of the expression of ERK1、ERK2 and JNK2.

