细叶益母草化学成分及其抗血小板聚集活性的研究
刘 娟, 周勤梅, 彭 成, 刘露丝, 熊 亮*, 刘昭华
(1.成都中医药大学药学院中药资源系统研究与开发利用国家重点实验室培育基地,四川成都611137;2.成都第一药业有限公司,四川成都610031)
[成分分析]
细叶益母草化学成分及其抗血小板聚集活性的研究
刘 娟1, 周勤梅1, 彭 成1, 刘露丝1, 熊 亮1*, 刘昭华2
(1.成都中医药大学药学院中药资源系统研究与开发利用国家重点实验室培育基地,四川成都611137;2.成都第一药业有限公司,四川成都610031)
目的 对细叶益母草Leonurus sibiricus的化学成分和血小板聚集活性进行研究。方法 细叶益母草提取液采用大孔树脂、MCI、反相C18、硅胶、Sephadex LH-20柱色谱及重结晶等方法进行分离纯化,所得化合物的结构通过波谱分析和TLC来鉴定,然后对其进行抗血小板聚集活性筛选。结果 从中分离鉴定出9个化合物,分别为益母草碱(1)、丁香脂素 (2)、梣皮树脂醇 (3)、蒙花苷 (4)、芹菜素-7-O-β-D-吡喃葡萄糖苷 (5)、丁香酸乙酯 (6)、对羟基苯甲酸乙酯 (7)、对羟基苄乙醚 (8)、β-胡萝卜苷 (9)。结论 化合物2~4、6、8均为首次从该植物中分离得到,其中3和6为首次从益母草属植物中分离得到。而且,化合物1、4和5对ADP诱导的血小板聚集均有明显的抑制作用。
细叶益母草;化学成分;抗血小板聚集;二磷酸腺苷 (ADP);分离鉴定
益母草作为一味传统中药,常用于治疗月经不调、胎漏难产、行经腹痛及产后瘀阻等症,素有“血家圣药”、“经产良药”之称。其中,细叶益母草Leonurus sibiricus为唇形科益母草属植物,具有
活血、调经、拨云退翳之功效[1],是市场上除药典收载品种益母草Leonurus japonicus外最常见的商品药材[2]。目前,对该植物中二萜和生物碱类化合物的研究较多[3-4],但黄酮和酚类较少[5]。本课题组前期已经对益母草进行了系统研究,发现了一系列活性化合物[6-14],尤其是抗血小板聚集活性。为了进一步研究益母草属其他植物,并探讨其化学成分的多样性及生物活性,本实验对细叶益母草展开了初步研究,并对所得成分进行抗血小板聚集活性筛选。
1 材料
MicroTOF-QⅡ型质谱仪(美国安捷伦公司);Bruker-500、600型核磁共振波谱仪(德国Bruker公司);Búchi Gradient Former B-687型中压液相色谱仪(瑞士Buchi公司)。Sephadex LH-20(瑞士Amershan Pharmacia公司);MCI柱色谱CHP 20P(日本Mitsubishi Chemical公司);薄层色谱硅胶GF254、柱色谱硅胶 (青岛海洋化工有限公司)。所用试剂均为分析纯 (国药集团化学试剂有限公司)。
细叶益母草于2013年8月采集于山西大同,经成都中医药大学龙飞教授鉴定为细叶益母草Leonurus sibiricus L.的干燥全草,标本(SLS-0809)保存于成都中医药大学药学院。
2 提取与分离
取干燥粉碎的细叶益母草3 kg,95%乙醇回流提取3次,每次2 h,提取液减压浓缩,得浸膏240 g,混悬于水中,依次用乙酸乙酯、正丁醇萃取,回收溶剂,得乙酸乙酯 (95 g)和正丁醇 (40 g)部位。
乙酸乙酯部位经石油醚-丙酮 (100:0~0:100)洗脱后,回收溶剂,得到 15个部分Fr.1~Fr.15。其中,Fr.9经硅胶和凝胶LH-20柱色谱分离后,通过制备薄层色谱,得到化合物7(10 mg)和8(9 mg);Fr.15中析出白色粉末,即化合物9(28 mg)。
正丁醇部位采用D101大孔树脂分离,以不同体积分数乙醇 (10%、30%、50%、70%、95%)梯度洗脱,回收溶剂,得到5个洗脱部分A~E。其中,C经MCI柱色谱分离,甲醇-水(20%~100%)梯度洗脱,回收溶剂,得到6个亚组分(C1~C6)。C3和C4分别经反相中压液相色谱分离后,析出黄色粉末,甲醇洗涤纯化,得到化合物4(36 mg)和5(75 mg);C5经反相中压液相、LH-20凝胶柱、硅胶柱、制备薄层以及半制备液相色谱等方法,得到化合物1(23 mg)、2(6 mg)、3(8 mg)和6(5 mg)。
3 结构鉴定
化合物1:无色针晶(甲醇),ESI-MS m/z:312.2[M+H]+。1H-NMR(CD3OD,600 MHz)δ:4.33(2H,t,J=6.6 Hz,3-H),1.85(2H,m,4-H),1.74(2H,m,5-H),3.26(2H,t,J=7.2 Hz,6-H),7.31(2H,s,2′,6′-H),3.89(6H,s,3′,5′-OCH3)。13C-NMR(CD3OD,150 MHz)δ:158.9(C-1),42.2(C-3),26.8(C-4),27.3(C-5),65.4(C-6),121.3(C-1′),108.3(C-2′,6′),149.3(C-3′,5′),142.6(C-4′),168.4(C-7′),57.0(C-8′,9′)。以上数据与文献 [15]报道基本一致,确定化合物1为益母草碱。
化合物2:无色胶状物,ESI-MS m/z:441.2[M+Na]+。1H-NMR(CD3OD,600 MHz)δ:3.16(2H,m,1,5-H),4.74(2H,d,J=4.2 Hz,2,6-H),4.28(2H,dd,J=9.0,6.6 Hz,4a,8a-H),3.90(2H,dd,J=9.0,3.6 Hz,4b,8b-H),6.67(4H,s,2′,6′,2″,6″-H),3.86(12H,s,3′,5′,3″,5″-OCH3)。以上数据与文献 [16]报道基本一致,确定化合物2为丁香脂素。
化合物3:无色胶状物,ESI-MS m/z:411.1[M+Na]+。1H-NMR(CD3OD,600 MHz)δ:3.16(2H,m,1,5-H),4.73(2H,d,J=4.2 Hz,2,6-H),4.26(2H,m,4a,8a-H),3.88(2H,m,4b,8b-H),6.67(2H,s,2′,6′-H),3.86(6H,s,3′,5′-OCH3),6.96(1H,d,J=1.8 Hz,2″-H),3.87(3H,s,3″-OCH3),6.78(1H,d,J=8.4 Hz,5″-H),6.83(1H,dd,J=8.4,1.8 Hz,6″-H)。以上数据与文献 [17]报道基本一致,确定化合物3为梣皮树脂醇。
化合物4:黄色粉末,ESI-MS m/z:593.2[M+H]+。1H-NMR(DMSO-d6,600 MHz)δ:6.96(1H,s,3-H),6.45(1H,d,J=1.8 Hz,6-H),6.80(1H,d,J=1.8 Hz,8-H),3.70~3.10(10H,m,Glc,Rha-H),8.06(2H,d,J=9.0 Hz,2′,6′-H),7.16(2H,d,J=9.0 Hz,3′,5′-H),3.87(3H,s,4′-OCH3),5.06(1H,d,J=7.2 Hz,1″-H),4.53(1H,brs,1‴-H),1.08(3H,d,J= 6.0 Hz,6‴-H),12.91(1H,brs,5-OH)。13C-NMR(DMSO-d6,150 MHz)δ:164.3(C-2),103.9(C-3),182.0(C-4),161.5(C-5),100.2(C-6),
163.7(C-7),95.2(C-8),157.4(C-9),105.8(C-10),123.0(C-1′),128.4(C-2′,6′),114.5(C-3′,5′),162.4(C-4′),55.8(OCH3-4′),100.1(C-1″),73.4(C-2″),76.5(C-3″),70.4(C-4″),75.5(C-5″),66.3(C-6″),100.9(C-1‴),70.5(C-2‴),70.6(C-3‴),72.3(C-4‴),68.6(C-5‴),17.9(C-6‴)。以上数据与文献[18]报道基本一致,确定化合物4为蒙花苷。
化合物5:黄色粉末,ESI-MS m/z:433.1[M +H]+。1H-NMR(DMSO-d6,600 MHz)δ:6.87(1H,s,3-H),6.44(1H,d,J=2.4 Hz,6-H),6.83(1H,d,J=2.4 Hz,8-H),7.96(2H,d,J= 8.4 Hz,2′,6′-H),6.94(2H,d,J=8.4 Hz,3′,5′-H),5.07(1H,d,J=4.8 Hz,1″-H),12.96(1H,s,5-OH),10.40(1H,s,4′-OH)。13C-NMR(DMSO-d6,150 MHz)δ:164.4(C-2),103.2(C-3),182.2(C-4),161.3(C-5),99.8(C-6),163.1(C-7),93.0(C-8),157.1(C-9),105.5(C-10),121.2(C-1′),128.6(C-2′),116.2(C-3′),161.5(C-4′),116.2(C-5′),128.9(C-6′),99.9(C-1″),77.4(C-3″),67.2(C-4″),76.6(C-5″),73.5(C-6″),60.4(C-7″)。以上数据与文献[19]报道基本一致,确定化合物5为芹菜素-7-O-β-D-葡萄糖苷。
化合物6:无色针晶,ESI-MS m/z:249.1[M +Na]+。1H-NMR(CD3OD,600 MHz)δ:7.35(2H,brs,2,6-H),3.92(6H,s,3,5-OCH3),4.35(2H,q,J=7.2 Hz,1′-H),1.39(3H,t,J=7.2 Hz,2′-H)。以上数据与文献 [20]报道基本一致,确定化合物6为丁香酸乙酯。
化合物7:白色粉末,ESI-MS m/z:189.0[M +Na]+。1H-NMR(CD3COCD3,600 MHz)δ:7.88(2H,d,J=9.0 Hz,2,6-H),6.91(2H,d,J= 9.0 Hz,3,5-H),4.28(2H,q,J=7.2 Hz,1′-H),1.33(3H,t,J=6.6 Hz,2′-H)。13C-NMR(CD3COCD3,150 MHz)δ:162.6(C-1),116.0(C-2,6),132.4(C-3,5),122.8(C-4),166.6(C-7),60.9(C-1′),14.7(C-2′)。以上数据与文献 [21]报道基本一致,确定化合物7为对羟基苯甲酸乙酯。
化合物8:白色粉末,ESI-MS m/z:175.1[M+Na]+。1H-NMR(CD3COCD3,500 MHz)δ:7.16(2H,d,J=8.5 Hz,2,6-H),6.79(2H,d,J=8.5 Hz,3,5-H),4.36(2H,s,7-H),3.45(2H,q,J=7.0 Hz,1′-H),1.18(3H,t,J=7.0 Hz,2′-H)。13C-NMR(CD3COCD3,125 MHz)δ:151.5(C-1),115.8(C-2,6),130.0(C-3,5),72.8(C-7),65.7(C-1′),15.6(C-2′)。以上数据与文献 [22]报道基本一致,确定化合物8为对羟基苄乙醚。
化合物9:白色无定形粉末,与β-胡萝卜苷对照品在3种溶剂系统中展开,发现两者Rf值及显色行为一致,确定化合物9为β-胡萝卜苷。
4 抗血小板聚集活性研究
对SD大鼠进行股动脉取血,与枸橼酸钠溶液按9:1的比例混合,离心10 min(800 r/min)后,取上清液,得富血小板血浆(platelet rich plasma,PRP)。余下部分离心10 min(3 500 r/min)后,取上清液,得贫血小板血浆(platelet poor plasma,PPP)。然后,按照Born氏比浊法,用血小板聚集仪对二磷酸腺苷 (ADP,终质量浓度为0.05 mg/mL)诱导的血小板聚集率进行测定,通过比较化合物1~9和空白组的血小板最大聚集率来评价其抗血小板聚集活性[10]。
结果显示,化合物1、4和5具有明显的抗血小板聚集作用,见表1。然后,计算其抑制率(AIR),计算公式为AIR=(空白对照组最大聚集率-给药组最大聚集率)/空白对照组最大聚集率×100%。
表1 化合物对ADP诱导血小板聚集的影响Tab.1 Effects of com pounds on p IateIet aggregation induced by ADP
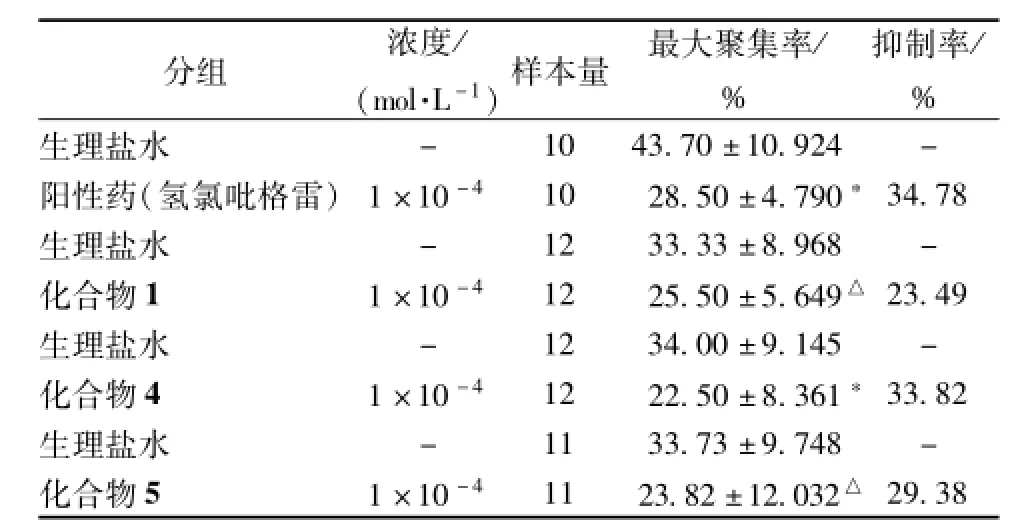
表1 化合物对ADP诱导血小板聚集的影响Tab.1 Effects of com pounds on p IateIet aggregation induced by ADP
注:与生理盐水组比较,△P<0.05;*P<0.01
分组 浓度/(mol.L-1)样本量 最大聚集率/ %抑制率/ % - 10 43.70±10.924 -阳性药(氢氯吡格雷)1×10-4 10 28.50±4.790*34.78生理盐水 - 12 33.33±8.968 -化合物1 1×10-4 12 25.50±5.649△23.49生理盐水 - 12 34.00±9.145 -化合物4 1×10-4 12 22.50±8.361*33.82生理盐水 - 11 33.73±9.748 -化合物5 1×10-4 11 23.82±12.032△生理盐水29.38
5 讨论
在前期对益母草L.japonicas化学成分研究[6-14]的基础上,本实验进一步对细叶益母草L. sibiricus进行化学和活性成分研究,结果从中分离出9个化合物。其中,化合物2~4、6、8为首次从该植物中得到,而且3和6为首次从益母草属植物中得到。另外,化合物1、4和5对ADP诱导的
血小板聚集有明显抑制作用,其中化合物1(益母草碱)的活性与文献 [4]报道一致,而4和5与文献 [23]报道的黄酮具有抑制血小板聚集及抗血栓形成的作用相符,提示这些成分可能与细叶益母草活血化瘀的功效存在一定关联,故须作进一步深入研究。
[1] 内蒙古自治区卫生厅.内蒙古蒙药材标准[M].赤峰:内蒙古科学技术出版社,1987:469-470.
[2] 朱兆仪,郭艳文,周远鹏,等.常用中药材品种整理和质量研究[M].北京:人民卫生出版社,1995:527.
[3] Narukawa Y,Niimura A,Noguchi H,et al.New diterpenoids with estrogen sulfotransferase inhibitory activity from Leonurus sibiricus L.[J].JNat Med,2014,68(1):125-131.
[4] Lin H C,Pan SM,Ding H Y,et al.Antiplatelet effect of leonurine from Leonurus sibiricus[J].Taiwan Pharm J,2007,59(3):149-152.
[5] Rolim de Almeida L F,De Maria E,Sannomiya M,et al.In vitro allelopathic potential of Leonurus sibiricus L.leaves[J].J Plant Interact,2008,3(1):39-48.
[6] Xiong L,Peng C,Zhou QM,et al.Chemical composition and antibacterial activity of essential oils from different parts of Leonurus japonicus Houtt.[J].Molecules,2013,18(1):963-973.
[7] Zhou Q M,Peng C,Li X H,et al.Aromatic compounds from Leonurus japonicus Houtt.[J].Biochem Syst Ecol,2013,51:101-103.
[8] Xiong L,Zhou QM,Peng C,et al.Sesquiterpenoids from the herb of Leonurus japonicus[J].Molecules,2013,18(5):5051-5058.
[9] Peng F,Xiong L,Zhao XM.A bicyclic diterpenoid with a new 15,16-dinorlabdane carbon skeleton from Leonurus japonicus and its coagulant bioactivity[J].Molecules,2013,18(11):13904-13909.
[10] Xiong L,Zhou Q M,Peng C,et al.Bis-spirolabdane diterpenoids from Leonurus japonicus and their anti-platelet aggregative activity[J].Fitoterapia,2015,100:1-6.
[11] Zhou QM,Peng C,Yang H,et al.Steroids from the aerial parts of Leonurus japonicus[J].Phytochemistry Lett,2015,12:287-290.
[12] 杨 槐,周勤梅,彭 成,等.益母草香豆素类化学成分与抗血小板聚集活性[J].中国中药杂志,2014,39(22):4356-4359.
[13] 何成军,彭 成,戴 鸥,等.益母草注射液化学成分研究[J].中草药,2014,45(21):3048-3052.
[14] 周勤梅,彭 成,蒙春旺,等.益母草中脂肪族化合物的研究[J].中草药,2015,46(9):1283-1286.
[15] 丛 悦,王金辉,郭洪仁,等.益母草化学成分的分离与鉴定Ⅱ[J].中国药物化学杂志,2003,13(6):349-352.
[16] Hu C L,Zheng C J,Ma X Q,et al.Lignans and phenylpropanoids from Fagopyrum tataricum roots[J].Ghem Nat Gompd,2012,48(2):303-304.
[17] Nakasone Y,Takara K,Wada K,et al.Antioxidative compounds isolated from Kokuto,noncentrifugal cane sugar[J]. Biosci Biotech Biochem,1996,60(10):1714-1716.
[18] Quintin J,Lewin G.Semisynthesis of linarin,acacetin,and 6-iodoapigenin derivatives from diosmin[J].J Nat Prod,2004,67(9):1624-1627.
[19] He F,Wang M,Gao M,et al.Chemical composition and biological activities of Gerbera anandria[J].Molecules,2014,19(4):4046-4057.
[20] Hufnagel JC,Hofmann T.Orosensory-directed identification of astringentmouthfeel and bitter-tasting compounds in red wine[J].JAgric Food Ghem,2008,56(4):1376-1386.
[21] Marshall L J,Cable K M,Botting N P,et al.The synthesis of substituted phenols from pyranone precursors[J].Tetrahedron,2009,65(39):8165-8170.
[22] Galetto W G,Hoffman PG.Some benzyl ethers present in the extract of vanilla(Vanilla planifolia)[J].J Agric Food Ghem,1978,26(1):195-197.
[23] 陆兔林,叶定江,毛春芹,等.三棱总黄酮抗血小板聚集及抗血栓作用研究[J].中草药,1999,30(6):439-440.
Chem icaIconstituents and their anti-p IateIet aggregation activities of Leonurus sibiricus L.
LIU Juan1, ZHOU Qin-mei1, PENG Cheng1, LIU Lu-si1, XIONG Liang1*, LIU Zhao-hua2
(1.Gollege of Pharmacy,Ghengdu University of Traditional Ghinese Medicine;State Key Laboratory Breeding Base of Systematic Research,Development and Utilization of Ghinese Medicine Resources,Ghengdu 611137,Ghina;2.Ghengdu No.1 Pharmaceutical Go.,Ltd.Ghengdu 610031,Ghina)
AIM To study the chemical constituents and their anti-platelet aggregation activities of Leonurus sibiricus L.METHODS The analysis of L.sibiricus extract was carried out on macroporous resin,MCI,ODS C18,silica,Sephadex LH-20 gel column and recrystallization.The structures of isolated compoundswere identified by spectral analysis and TLC.Then their anti-platelet aggregation activities were screened.RESULTS Nine compounds were isolated from this plant and identified as leonurine(1),syringaresinol(2),medioresinol(3),linarin(4),apigenin-7-O-β-D-glucopyranoside(5),syringic acid ethyl ester(6),ethyl 4-hydroxybenzoate(7),p-hydroxybenzyl ethyl ether(8),β-daucosterol(9).CONCLUSION Compounds 2-4,6 and 8 are obtained from L.sibiricus for the first time.Among them,compounds3 and 6 are firstly isolated from genus Leonurus.In addition,compounds 1,4 and 5 can significantly inhibit platelet aggregation induced by ADP.
Leonurus sibiricus;chemical constituents;anti-platelet aggregation;adenosine diphosphate(ADP);isolation and identification
R284.1
A
1001-1528(2015)11-2439-04
10.3969/j.issn.1001-1528.2015.11.022
2015-07-24
国家自然科学基金资助项目 (81303209);中国博士后科学基金资助项目 (2014M562291);四川省应用基础研究项目(2012JYZ005);四川省科技支撑计划 (2011SZ0056)
刘 娟(1989—),女,硕士,从事中药药效物质基础研究。E-mail:liuj755088@163.com
*通信作者:熊 亮 (1983—),男,博士,副研究员,硕士生导师,从事中药药效物质研究。Tel:(028)61800231,E-mail:xiling0505@126.com

