HPLC法同时测定红花注射液中3种活性成分
刘 静, 赵剑锋, 马双成, 戴 忠*
(1.中国食品药品检定研究院,北京100050;2.北京市延庆县食品药品监督管理局,北京102100)
HPLC法同时测定红花注射液中3种活性成分
刘 静1, 赵剑锋2, 马双成1, 戴 忠1*
(1.中国食品药品检定研究院,北京100050;2.北京市延庆县食品药品监督管理局,北京102100)
目的 建立同时测定红花注射液中紫丁香苷、羟基红花黄色素A与(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷3种活性成分的反相高效液相色谱法。方法 红花注射液0.45μm微孔滤膜滤液分析采用Phenomenex Luna C18色谱柱(4.60mm×250mm,5μm),以乙腈-0.1%磷酸水溶液为流动相,梯度洗脱,体积流量1.0mL/min,柱温30℃,检测波长265 nm。结果 紫丁香苷、羟基红花黄色素A与(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷分别在0.101~2.02 μg(r=0.999 6),0.216~4.32μg(r=0.999 7),0.510~10.2μg(r=1)范围内线性关系良好;平均加样回收率分别为97.4%、102.3%、100.3%,RSD分别为2.1%、2.1%、1.5%。结论 本法准确、简单、重复性好,能更好地控制红花注射液的质量。
红花注射液;紫丁香苷;羟基红花黄色素A;(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷;HPLC
红花注射液是由红花Garthamus tinctorius L.药材经水煮醇沉等工艺加工而成的中药注射剂,具有活血化瘀功效,用于治疗闭塞性脑血管疾病、冠心病和脉管炎,临床疗效显著。文献调研表明,红花注射液的质量控制研究主要集中于羟基红花黄色素A、腺苷及槲皮素等个别成分的定量测定以及特征图谱研究等方面[1-10]。
为阐明红花注射液的活性成分,课题组对红花注射液化学成分进行了较为深入的研究,同时采用功效相关生物活性测定方法[11-12],对其中分离得到的单体成分进行了体外抗血小板聚集活性测试,并报道除公认的羟基红花黄色素A外,黄酮、多炔苷等成分亦具有较好活性[13]。综合分析上述研究结果发现,紫丁香苷、羟基红花黄色素A以及(8Z)-癸烯-4,6-二炔-1-O-葡萄糖苷在红花注射液中不仅含有量高、而且活性较好。此外,鉴于红花注射液现行质量标准含量测定项下仅对羟基红花黄色素A单一活性成分进行测定的现状[14],本实验旨在建立能够同时测定红花注射液中紫丁香苷、羟基红花黄色素A与 (8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷3种活性成分的高效液相色谱法,以便为更好地控制红花注射液质量提供科学依据。
1 仪器与试药
1.1 仪器 Waters e2695高效液相色谱仪及工作站(美国Waters公司);Mettler AE-240电子分析天平(瑞士Mettler公司);Millipore Synergy-UV超纯水机(美国Millipore公司)。
1.2 试药 紫丁香苷 (批号111574-200603)、羟基红花黄色素A(批号111637-201207)对照品由中国食品药品检定研究院提供;(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷(自制,纯度大于98%)。红花注射液,批号分别为13051601、13082002、13082501、 13021502、 13082301、 13062801、13062701、13021701、13082801(规格均为 10 mL),12040701(企业小样)均由A企业提供。乙腈为色谱纯(美国Thermofischer公司);磷酸为分析纯 (中国北京化工厂);水为超纯水。
2 方法与结果
2.1 色谱条件 Phenomenex Luna C18色谱柱(4.6 mm×250 mm,5μm);流动相A为0.1%磷酸水溶液,B为乙腈,梯度洗脱 (0~20 min,10%~12%B;20~50 min,12%~35%B;50~60 min,10%B);柱温30℃;体积流量1.0mL/min;检测波长265 nm;进样量为10μL。在上述条件下,样品中各对照品与其他组分基本达到基线分离。结果见图1。
2.2 混合对照品溶液制备 取对照品适量,精密称定,加甲醇制成每1 m L含紫丁香苷、羟基红花黄色素A、(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖
苷分别为0.101、0.216、0.510 mg的混合对照品溶液,摇匀,即得。

图1 对照品与红花注射液样品HPLC图谱Fig.1 HPLC chromatograms of reference substances and Honghua Injection sam p Ies
2.3 供试品溶液制备 取红花注射液样品,0.45 μm微孔滤膜滤过,即得。
2.4 方法学研究
2.4.1 测定波长的选择 根据紫丁香苷、羟基红花黄色素A以及(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷3种成分的UV光谱图,设定265 nm,能够同时检测3种成分。
2.4.2 线性关系考察 精密吸取 “2.2”项下混合对照品溶液各1、2、5、10、20μL进样,按“2.1”项下色谱条件测定。以进样量X(μg)为横坐标,峰面积Y为纵坐标,绘制标准曲线,计算回归方程,结果见表1。

表1 回归方程Tab.1 Regression equations
2.4.3 精密度试验 精密吸取供试品溶液10μL,重复进样6次,按 “2.1”项下色谱条件测定。按紫丁香苷、羟基红花黄色素A、(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷的峰面积计算RSD值分别为0.2%、0.1%和0.2%,表明仪器精密度良好。
2.4.4 重复性试验 取同一批样品6份,按“2.1”项下色谱条件测定,记录峰面积,计算,结果样品中紫丁香苷、羟基红花黄色素A和(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷的含有量分别为0.050 4、0.161、0.341 mg/mL,RSD分别为1.3%、2.9%、2.5%,表明方法重复性良好。
2.4.5 稳定性试验 取同一供试品溶液,于0、2、4、6、8、12 h按 “2.1”项下色谱条件测定,记录峰面积。结果样品中紫丁香苷、羟基红花黄色素A和(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷在12 h内峰面积的RSD分别为0.3%、0.4%和0.2%,表明供试品溶液在12 h内稳定。
2.4.6 加样回收率试验 精密吸取已知成分含有量的红花注射液样品 (12040701)5 mL,平行6份,置10 m L量瓶,分别精密加入混合对照品溶液(含紫丁香苷0.050 8 mg/mL,羟基红花黄色素A 0.161 mg/mL,[8Z]-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷0.338mg/mL)5mL,摇匀,滤过,取续滤液,即得,进样20μL,其余色谱条件按 “2.1”项下进样测定,计算加样回收率,结果见表2。
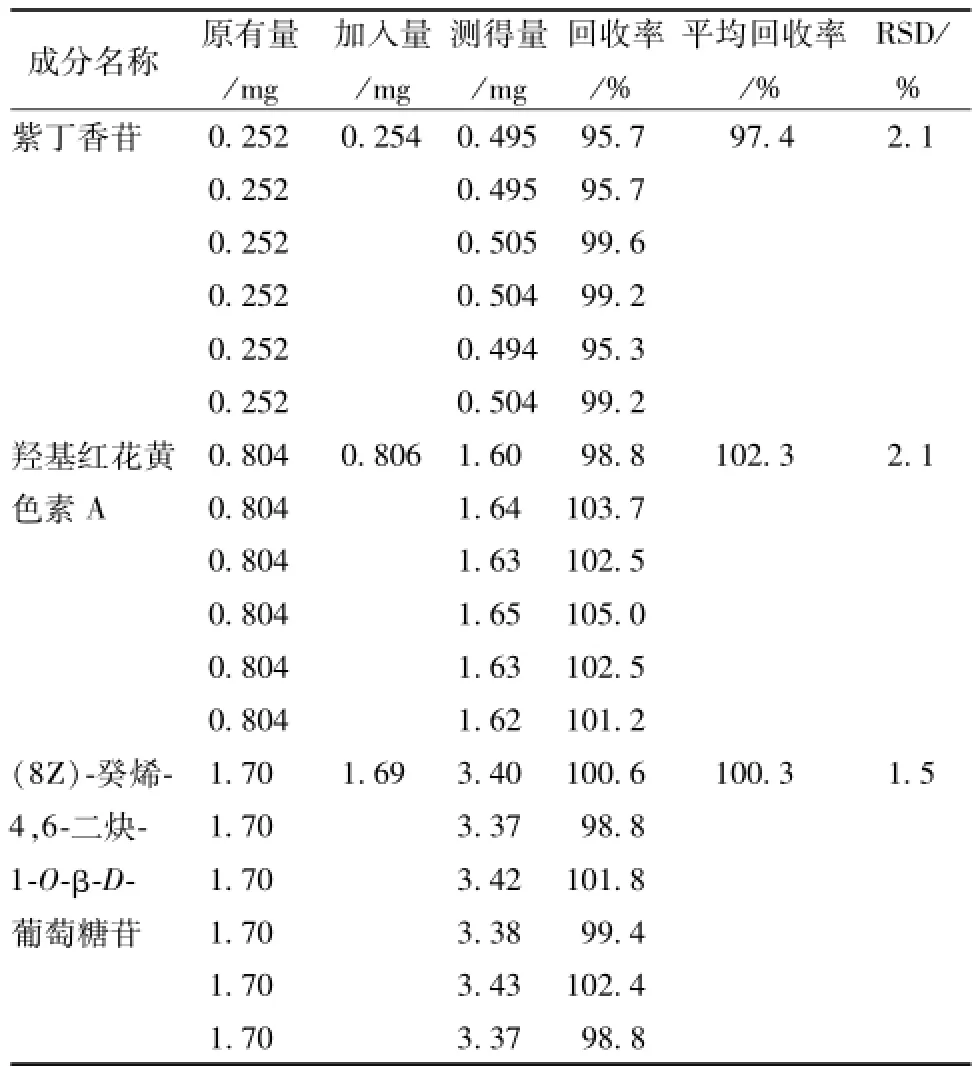
表2 加样回收试验结果(n=6)Tab.2 Resu Its of recovery tests(n=6)
2.4.7 样品测定 取不同批次的红花注射液,按“2.3”项下制备供试品溶液,进样10μL,按“2.1”项下色谱条件测定。以标准曲线计算样品中紫丁香苷、羟基红花黄色素A及 (8Z)-癸烯-
4,6-二炔-1-O-β-D-葡萄糖苷3种活性成分的量,结果见表3。

表3 样品测定结果(mg/m L)Tab.3 Resu Its of determ ination of samp Ies(mg/m L)
3 讨论
本实验检测波长的选择依据紫丁香苷、羟基红花黄色素A与(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷3个化合物的紫外吸收光谱及其分离度等因素确定为265 nm。
流动相分别考察了甲醇-水、乙腈-水、甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液等系统,最终选择分离度较好的乙腈-0.1%磷酸水溶液为流动相。
本实验建立的HPLC法同时测定了红花注射液中紫丁香苷、羟基红花黄色素A与(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷3种不同结构类型活性成分的量,更好地体现了中药制剂的多组分特性,为红花注射液质量控制水平的进一步提高与完善提供了科学依据。
本实验建立的质量控制方法对于红花注射液的多指标控制提供了有益参考。今后通过多厂家多批次的红花注射液产品测定和验证,可以确定上述各成分指标的含有量限度,为进一步提升为红花注射液的质量控制标准奠定基础。
[1] 苗爱东,彭 燕,王本富,等.RP-HPLC法测定红花注射液中腺苷的含量[J].中成药,2003,25(3):199-200.
[2] 刘月庆,王 睿,毕开顺.HTRP-HPLC法测定红花注射液中红花黄色素A的含量[J].中国中药杂志,2003,28(10):937-939.
[3] 李 颖,张 戈,郭美丽,等.红花药材及注射液中羟基红花黄色素A的含量测定[J].第二军医大学学报,2005,26(5):587-588.
[4] 徐凤云,刘玉根.HPLC法测定红花注射液中槲皮素的含量[J].医学信息,2011,24(9):5017-5018.
[5] 黄燕萍.HPLC法同时测定红花注射液中腺苷和羟基红花黄色素 A的含量[J].中国药房,2013,24(43):4092-4094.
[6] 胡晓茹,孙 磊,戴 忠,等.高效液相质谱法和超高效液相色谱法研究红花注射液中的核苷类成分[J].中国药学杂志,2013,48(12):1022-1026.
[7] 何梅凤,吴 伟,邓新国.HPLC法测定兔房水中羟基红花黄色素A[J].中成药,2014,36(7):1558-1560.
[8] 梁选革,刘莉丽,张若燕.红花注射液质量控制研究进展[J].中国药物警戒,2013,10(8):468-472.
[9] 刘 燕,于健东,戴 忠,等.红花注射液质量控制研究[J].药物分析杂志,2010,30(9):1732-1734.
[10] 任爱农,姚苗苗,王大为.红花注射液热转化的HPLC/ UV/MS特征图研究[J].中成药,2011,33(6):917-920.
[11] 刘 倩,陈 晨,戴 忠,等.红花注射液有效成分的确定及不同厂家中量效关系的比较[J].药物分析杂志,2012,32(7):1158-1161.
[12] 陈 晨,刘 倩,张 媛,等.红花注射液生物活性测定方法的筛选[J].药物分析杂志,2013,33(1):12-17.
[13] 赵剑锋,刘 静,郭 颖,等.红花注射液化学成分及其活性研究[J].中国中药杂志,2014,39(16):3102-3106.
[14] WS3-B-3825-98-2012,红花注射液药品标准[S].
Sim u Itaneous determ ination of three active constituents in Honghua Injection by HPLC
LIU Jing1, ZHAO Jian-feng2, MA Shuang-cheng1, DAIZhong1*
(1.National Institutes for Food and Drug Gontrol,Beijing 100050,Ghina;2.Yanqing Gounty Food and Drug Administration,Beijing 102100,Ghina)
AIM To establish a reversed-phase high-performance liquid chromatography(RP-HPLC)method for simultaneously identifying the contents of three major active constituents(sirongoside,hydroxysafflor yellow A and[8Z]-decaene-4,6-diyne-1-O-β-D-glucopyranoside)in Honghua Injection.METHODS The analysis of Honghua Injection filtrate through microporousmembrane was performed on a Phenomenex Luna C18column with acetonitrile and 0.1%phosphoric acid solution asmobile phase in a gradient elutionmanner.The detection wavelength was set at265 nm.RESULTS The calibration curveswere linearwithin the ranges of 0.101-2.02μg for sirongoside(r=0.999 6),0.216-4.32μg for hydroxysafflor yellow A(r=0.999 7)and 0.510-10.2μg for(8Z)-decaene-4,6-diyne-1-O-β-D-glucopyranoside(r=1),respectively.Their average recoveries were 97.4%,102.3%and 100.3%,and RSDswere1.3%,2.1%and 1.5%,respectively.CONCLUSION This accurate,simple and repeatable method provides sound support for the quality control of Honghua Injection.
Honghua Injection(Garthamus tinctorius L.);sirongoside;hydroxysafflor yellow A;(8Z)-decaene-4,6-diyne-1-O-β-D-glucopyranoside;HPLC
R927.2
A
1001-1528(2015)11-2426-04
10.3969/j.issn.1001-1528.2015.11.019
2015-01-19
中国食品药品检定研究院2012年中青年发展研究基金课题 (2012A7)
刘 静,女,博士,副研究员,从事中药化学、中药分析研究。Tel:(010)67095376,E-mail:liujing_zsm@126.com
*通信作者:戴 忠,男,博士,研究员,硕士生导师,从事中药质量控制及中药化学对照品研究。Tel:(010)67095376,E-mail:daizhong@nifdc.org.cn

