林窗对凋落物分解过程中细菌群落结构和多样性的影响
张明锦,张健,纪托未,刘华,李勋,张艳,杨万勤,陈良华*
1. 长江上游林业生态工程重点实验室//生态林业研究所,四川农业大学,四川 成都 611130;2. 高山森林生态系统定位研究站//华西雨屏区生态环境监测站,四川 成都 611130;3. 长江上游生态安全协同创新中心,四川 成都 611130
林窗对凋落物分解过程中细菌群落结构和多样性的影响
张明锦1,2,3,张健1,2,3,纪托未1,2,3,刘华1,2,3,李勋1,2,3,张艳1,2,3,杨万勤1,2,3,陈良华1,2,3*
1. 长江上游林业生态工程重点实验室//生态林业研究所,四川农业大学,四川 成都 611130;2. 高山森林生态系统定位研究站//华西雨屏区生态环境监测站,四川 成都 611130;3. 长江上游生态安全协同创新中心,四川 成都 611130
基于细菌16S rDNA的PCR-DGGE方法,以林下(US)为对照,研究了长江上游低山丘陵区人为采伐形成的马尾松(Pinus massoniana)人工林7种不同大小林窗(G1:100 m2、G2:225 m2、G3:400 m2、G4:625 m2、G5:900 m2、G6:1 225 m2、G7:1 600 m2)在冬夏两季对凋落物分解过程中细菌群落结构和多样性的影响。结果表明,凋落物中的细菌群落结构和多样性受到林窗大小的显著影响,这种差异性受到季节的影响。有些菌纲只出现在特定大小的林窗,例如,绿弯菌纲(Chloroflexi)和放线菌纲(Actinobacteria)都只出现在US和G1林窗,芽孢杆菌纲(Bacilli)只出现在大中型(G4~G7)林窗,黄杆菌纲(Flavobacteria)只出现在中型(G4和G5)林窗,浮霉菌纲(Planctomycetacia)只存在于G5、G7和US。冬夏两季细菌群落结构差异较大,冬季的细菌类群高于夏季。在冬季,细菌群落的多样性与林窗大小、凋落物含水率、日平均温度、凋落物的全碳、可溶性有机碳和全氮含量显著相关;在夏季,细菌群落的多样性仅与日平均温度和全碳含量显著相关。总体来看,变形菌门是凋落物分解过程中的优势类群,有利于凋落物分解过程中的碳氮循环。林窗的形成改变了凋落物中的细菌群落结构和组成,减小了凋落物分解过程中细菌群落的丰富度指数、多样性指数和均匀度指数,但增大了优势度指数。冬季的细菌群落的丰富度、多样性和均匀度高于夏季,优势度则低于夏季。
林窗;凋落物分解;细菌群落;多样性;PCR-DGGE
微生物群落是凋落物分解过程中重要的生物因素,在陆地生态系统中的生物地球化学循环中扮演着重要的角色。已有研究表明,不同微生物群落的生长和发展可以改变土壤有机质的周转和命运(Creamer et al.,2015)。微生物的活动推动着土壤中碳和能量的流动,有研究表明土壤微生物具有很高的多样性,但相关的研究较少(Prosser,2002)。微生物群落主要包括真菌和细菌,其丰富度(Bekku et al.,2004)和组成(Lipson et al.,2002;Schadt et al.,2003;Lipson,2007)具有较大的时空变化。这些变化与温度(Wardle,1998)、水分(Michelsen et al.,2004)和养分有效性(Lipson et al.,2000)等非生物因素变化以及植物养分竞争(Bardgett et al.,2002)、植物与微生物互利共生(Wardle et al.,2004)等生物因素密切相关。同样地,微生物群落的变化对凋落物分解、土壤养分循环的速度和养分的有效性也有影响(Corre et al.,2002)。可见,微生物群落的变化强烈影响着生态系统的功能和生产力(van der Heijden et al.,2008)。微生物群落的变化通常可以归因于水分和温度的变化,以及碳和氮的可用性等方面(Zhang et al.,1995)。
林窗是森林生态系统中普遍存在的干扰方式之一,也是森林更新和演替的重要驱动力之一(Splechtna et al.,2005)。林窗的存在会直接影响太阳辐射量和到达地面的降水量。这些变量的差异影响着林窗和周围林下的空气温度、相对湿度、土壤温度和土壤含水量。与林下相比,林窗内具有更高的太阳辐射量,能够直接导致空气温度、土壤温度的增加和相对湿度下降(Clinton,2003;Abd Latif et al.,2010)。林窗内的非生物和生物条件的变化主要取决于林窗的大小和林窗内的位置(Nagel et al.,2010)。一些研究发现较大的林窗由于太阳辐射的增加,因而具有较高的土壤温度(Ritter,2005)。但也有研究发现较小的林窗中植被的保温效应好,因而较更大的林窗具有更高的土壤温度(Sariyildiz,2008)。土壤水分与林窗大小之间的关系也并不明确,一些研究发现为负相关关系(Prescott et al.,2003),而有的研究表明两者没有关系(Ritter et al.,2005;Sariyildiz,2008),这些研究的不同结果可能是因为土壤含水率受较多因素的影响。较大的林窗往往减少了植物的蒸腾作用并且有较高的净降水量,但同时具有较高的径流和地面蒸发量(Gray et al.,2002)。可见,林窗的形成以及不同大小的林窗改变了森林生态系统中的微气候环境,而微生物对周围环境条件的变化非常敏感。虽然目前关于林窗对气候因子的研究已取得了大量的成果,但关于林窗对森林凋落物分解过程中细菌群落结构的影响的研究还很少。凋落叶分解过程中细菌群落结构的变化不仅受到温度、湿度等环境因子的影响,而且还可能会受到凋落物基质养分有效性的影响。因此,有必要针对林窗对凋落物分解过程中细菌群落结构的影响进行深入研究,以进一步认识林窗中微生物对有机质分解的作用以及相关养分和碳循环的影响。
1 材料与方法
1.1 研究区域概况
研究区域位于长江上游四川省宜宾市高县境内 ( 28°35′45″N~28°36′19″N , 104°33′37″E~104°34′22″E),地处岷江、金沙江交汇段,海拔高度410~560 m,是典型的低山丘陵地区;属于亚热带季风性湿润气候,雨量充沛,雨热同季;最高气温40.3 ℃,最低气温-3.7 ℃,年均气温18.1 ℃;年均降水量1021.8 mm,相对湿度81%。试验地位于来复镇毛巅坳工区经营小班,地处川云公路中段,总面积约为33.4 hm2。土壤为山地黄壤,成土母岩为黄色砂岩,土壤发育完善,层次过渡明显,土壤养分状况差,缺乏氮和磷。林地为42年生成熟马尾松人工纯林,坡度平缓,坡向S、SE,郁闭度0.7左右。林下灌木主要有枹栎(Quercus serrata)、黄荆(Vitex negundo)、黄牛奶(Symplocos laurina)、梨叶悬钩子(Rubus pirifolius)、野桐(Mallotus japonicus)、展毛野牡丹(Melastoma normale)等;草本主要有淡竹叶(Lophatherum gracile)、金星蕨(Parathelypteris glanduligera)、马唐(Digitaria sanguinalis)、芒(Miscanthus sinensis)、芒萁(Dicranopteris dichotoma)、乌蕨(Stenoloma chusanum)、皱叶狗尾草(Setaria plicata)等。
1.2 样地设置
2011年8月在试验区域对样地的植物多样性、土壤理化性质、林分结构等作初步调查。2011年10月在踏查基础上在实验区选择立地条件相近的马尾松(Pinus massoniana)人工纯林进行采伐,形成7种面积不等的近正方形林窗各3个,面积大小分别为G1:100 m2、G2:225 m2、G3:400 m2、G4:625 m2、G5:900 m2、G6:1225 m2、G7:1600 m2,未砍伐的人工林作为对照-US(林下)。林窗斑块主要位于山体中部和中上坡位,坡向基本为东,坡度为20°~30°,海拔400 m左右,林窗间距大于10 m。将林窗内砍伐的树枝、树干等残体移出,但未进行掘根处理。样地基本情况见表1。
1.3 动态采样
在2013年10月下旬凋落物高峰期,在研究区域收集人工林下新鲜的马尾松凋落叶,带回实验室风干。实验处理采用凋落物袋分解法,凋落物袋大小约为20 cm×20 cm,孔径0.5 mm。将风干的马尾松凋落叶按每袋10 g装入凋落物分解袋并封口,在7种不同大小林窗的林窗中心和林窗边缘2个位置和林下对照放置凋落物分解袋,每种林窗大小和林下对照都设置了3个重复样地,计划进行7次采样,每次采样在每个放置点采 3袋,所以共计(7×2×3+3)×3×7=945袋。于2013年11月中旬,在 7个大小梯度的林窗中心和林窗边缘及林下对照,去除样地表面凋落物层,将凋落物样袋放置于土壤表面,让凋落叶自然分解。在7个林窗的中心、边缘及林下的凋落物袋中放入纽扣式温度记录器(Button DS1923-F5,Maxim/Dallas Semiconductor,Sunnyvale,CA,USA),每2 h记录一次温度数据。分别在冬季(2014年2月中旬)和夏季(2014年8月中旬)进行采样,在每个设置的样点各采集3袋凋落物分解袋。将样品装入已灭菌的封口聚乙烯袋,并标记,迅速放入冰盒中带回实验室。除去样品中的土壤、根系等杂质后,剪碎过2 mm筛,一部分装入已灭菌的封口聚乙烯袋于 4 ℃保存用于测定细菌群落结构,另一部分烘干用于凋落物含水率、全碳、全氮、全磷和可溶性有机碳的测定。
1.4 测定方法
凋落物 C、N、P含量的测定参照《中华人民共和国林业行业标准 LY/T─1999》。全碳用重铬酸钾氧化外加热法测定。样品用硫酸-高氯酸消煮,用凯式定氮仪(浙江托普仪器有限公司KDN系列)测定全N,用钼锑抗比色法测定全P。DOC含量的测定步骤如下(王春阳等,2011):将烘干的植物样品粉碎过2 mm筛,精确称取植物样品0.05 g于20 mL离心管中,加入10 mL蒸馏水,振荡0.5 h,4000 r·min-1、4 ℃离心 15 min,取上清液在-0.08 MPa下经孔径为0.45 μm滤膜(上海市新亚净化器件厂生产,使用前首先要用蒸馏水淋洗滤膜,以淋洗滤膜可能残留的有机组分)过滤,即获得植物凋落物DOC提取液,4 ℃低温保存待测液,用TOC分析仪(multi N/C 2100,AnalytikJena)测定待测液中DOC浓度。
凋落物中细菌基因组DNA的提取采用北京艾德莱生物科技有限公司(Aidlab Biotechnologies Co.,Ltd.,China)的SoilPure试剂盒,按操作说明提取并纯化,纯化后的DNA在1%琼脂糖凝胶上进行电泳检测。采用细菌通用引物对总基因组 16S rDNA的V3区进行PCR扩增,其引物序列为:F338:5′GC-ACTCCTACGGGAGGCAGCAG3′;R518:5′ATTACCGCGGCTGCTGG3′;F338的5′GC夹子结构为:5′CGCCCGCCGCGCCCCGCGCCCGG CCCGCCGCCCCCGCCCC3′。PCR反应体系为:25 ng模板、2.5 pmol正反引物,10 μg Bovine Serum Albumin(TaKaRa)、12.5 μL Premix Taq(TaKaRa)、无菌纯水补足到25 μL。反应程序为:95 ℃预变性3 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环,循环结束后72 ℃延伸5 min。用1.5%琼脂糖凝胶电泳检测PCR扩增产物。
PCR 产物检测后,通过 CBS Denaturing Gradient Gel Electrophoresis System(CBS Scientific Company,Inc)电泳仪进行 DGGE电泳分离。电泳缓冲液为 1×TAE,胶浓度为 8%,变性梯度为40%~70%。PCR产物和6×LoadingBuffer按照5∶1混合均匀后点样。电泳条件设置:电压为100 V,温度为60 ℃,时间为930 min,电泳结束后进行银染,并用 GS-800TM Calibrated Densitometer(Bio-Rad Laboratories,Hercules,USA)进行扫描成像。使用Quantity One(Bio-Rad,Hercules,USA)软件对 DGGE图谱进行细菌群落组成结构和多样性的分析。选择电泳胶上的优势条带进行切胶回收,回收DNA用不含GC夹子的引物进行PCR扩增,扩增后进行纯化。纯化产物连接到pMD19-T载体(TaKaRa),再转入大肠杆菌感受态细胞DH5α在培养皿中进行培养,挑阳性单克隆送华大基因研究院进行测序,以确定优势条带所对应的细菌种属。
1.5 数据处理与统计分析
DGGE主要条带的测序结果去除载体序列后,在GenBank中进行BLAST分析,找出相似性大于95%的相似序列,以确定条带所对应的细菌类群。用Quantity One软件分析出各泳道条带的相对强度后,结合Blast比对的测序结果,计算细菌类群在各样品中的相对比例。用Quantity One软件对DGGE图谱进行分析,通过计算各个样品的Patrick丰富度指数即条带数(S)、Shannon多样性指数(H)、Pielou均匀度指数(EH)、Simpson优势度指数(C)来评价样品中细菌群落的多样性。其中,计算公式如下:

式中,S表示每个泳道检测到的不同条带的总和,Pi表示每个泳道中各个条带的强度占总强度的百分含量。
采用SPSS 17.0作统计分析,用单因素方差分析方法(one-way ANOVA)和Duncan(D)多重比较法检验不同季节凋落物含水率在不同大小林窗间的差异。用配对样本T检验(Paired Sample T test)检验不同大小林窗下不同林窗位置处凋落物含水率在冬夏两季之间的差异。细菌多样性指数与环境因子的相关关系采用Pearson法进行分析。数据整理和计算采用Microsoft Excel 2007软件,作图采用Origin 9.0。

表1 马尾松人工林不同面积林窗样地基本概况Table 1 General characteristics in the sampling plots in different size forest gaps of Pinus massoniana plantations
2 结果与分析
2.1 日平均温度和凋落物含水率
从采样当月的日平均温度来看(表2),在冬季,林窗中心的最低和最高日平均温度分别是 9.27 ℃(G2)和10.15 ℃(G7),林窗边缘是8.78 ℃(G5)和10.67 ℃(G6)。在G1~G5林窗,林窗中心的日平均温度高于林窗边缘,但在G6和G7,林窗中心的日平均温度低于林窗边缘。在夏季,林窗中心的最低和最高日平均温度分别是 23.81 ℃(G2)和28.10 ℃(G7),林窗边缘是 22.97 ℃(G2)和26.13 ℃(G3)。林窗中心的日平均温度都高于林窗边缘。

表2 采样当月的日平均温度Table 2 Average daily temperature in sampling month ℃
从凋落物含水率来看(图 1所示),在冬季,无论在林窗中心还是林窗边缘,大型林窗(G6和G7)中的凋落物含水率都只有15.43%~19.78%,显著低于林下和 G1~G4林窗。在夏季,凋落物的含水率随林窗大小无显著变化。在G5~G7和G3林窗中心和边缘,以及G1林窗中心,凋落物在冬季的含水率显著低于夏季,其余无显著差异。
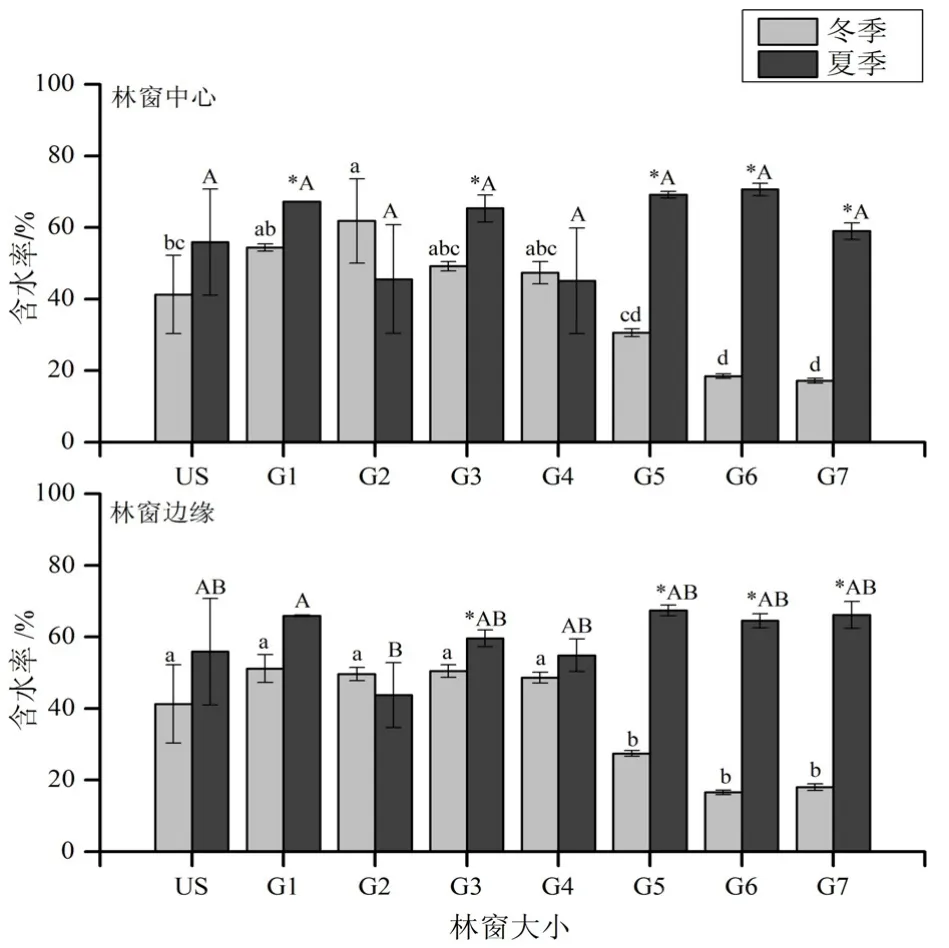
图1 凋落物含水率Fig. 1 Water content of litter
2.2 细菌群落组成
如图2所示,从已知的细菌类群来看,在冬季,凋落物中的细菌主要归属于变形菌门( Proteobacteria) 中 的 α-变 形 菌 纲( Alphaproteobacteria )、 β-变 形 菌 纲( Betaproteobacteria ) 、 γ-变 形 菌 纲(Gammaproteobacteria),酸杆菌门(Acidobacteria)的酸杆菌纲(Acidobacteria),异常球菌-栖热菌门( Deinococcus-Thermus) 的 异 常 球 菌 纲(Deinococci),拟杆菌门(Bacteroidetes)的鞘脂杆 菌 纲 ( Sphingobacteria) 、 黄 杆 菌 纲(Flavobacteria),厚壁菌门(Firmicutes)的芽孢杆菌纲(Bacilli),绿弯菌门(Chloroflexi)的绿弯菌纲(Chloroflexi),放线菌门(Actinobacteria)的放线菌纲(Actinobacteria),共7大门10大纲。在林窗中心(图 2a),已知细菌类群只占了16.99%~40.95%。在林窗边缘(图2b),已知细菌类群也只有29.12%~65.56%,多数类群为未知类群。从已知的细菌类群来看,无论是在林窗中心还是林窗边缘,除了G3林窗是以γ-变形菌纲为优势类群外,其余林窗中心和边缘以及林下都是以α-变形菌纲为优势类群。在林窗中心,β-变形菌纲只出现在G2~G5林窗;在林窗边缘,β-变形菌纲也只出现在G2、G3和G5林窗。黄杆菌纲只出现在G4林窗中心和边缘,以及G5林窗中心。芽孢杆菌纲只出现在G4、G6、G7林窗中心和边缘,以及G5林窗中心。只有G1林窗中心和边缘以及US出现了绿弯菌纲和放线菌纲。

图2 冬季不同林窗内凋落物中不同细菌类群的相对含量Fig. 2 Percentage of relative content of different bacterial groups of litter in different forest gap in winter
如图3所未,从已知的细菌类群来看,夏季凋落物中的细菌主要归属于变形菌门(Proteobacteria)的 α-变形菌纲(Alphaproteobacteria)、β-变形菌纲( Betaproteobacteria ) 、 γ- 变 形 菌 纲(Gammaproteobacteria),拟杆菌门(Bacteroidetes)的鞘脂杆菌纲(Sphingobacteria),放线菌门(Actinobacteria)的放线菌纲(Actinobacteria),浮霉 菌 门 ( Planctomycetes) 的 浮 霉 菌 纲(Planctomycetacia),酸杆菌门(Acidobacteria)的酸杆菌纲(Acidobacteria),共5大门7大纲。林窗中心的已知类群占细菌群落的11.14%~57.82%(图3a),林窗边缘的已知类群为28.37%~56.59%(图3b),多数类群仍为未知类群。从已知的细菌类群来看,在US和G5林窗中心,放线菌纲为优势类群;在G1、G3和G6林窗中心,α-变形菌纲为优势类群;在G2林窗中心,β-变形菌纲占优势类群;在G4和G7林窗中心,γ-变形菌纲所占比例最高。在林窗边缘,除了G5和G6林窗的优势类群为鞘脂杆菌纲外,其余林窗边缘的优势类群都是α-变形菌纲。酸杆菌纲只在G1和G3林窗边缘以及G4林窗中心和边缘出现,浮霉菌纲只出现在 G5和 G7林窗中心以及US。

图3 季不同林窗内凋落物中不同细菌类群的相对含量Fig. 3 Percentage of relative content of different bacterial groups of litter in different forest gap in summer

表3 细菌群落多样性指数Table 3 bacterial community diversity index
2.3 细菌群落多样性
如表3所示,在冬季,无论在林窗中心还是林窗边缘,细菌群落的Patrick丰富度指数和Shannon多样性指数除了G1高于林下外,其余林窗都低于林下,且随着林窗面积的增大,两者均先减小后增大,其中G4林窗的最小。Simpson优势度指数与前两者相反,除了G1林窗略低于林下外,其余林窗都高于林下,且随着林窗面积的增大先增大后减小,在 G4林窗达到最大。在林窗中心,除了 G1和G6以外,其余林窗的Pielou均匀度指数都低于林下;在林窗边缘,除了G1、G6和G7以外,其余林窗也低于林下。在夏季,在林窗中心,除了G4和G6的Patrick丰富度指数高于林下外,其余林窗都低于林下,Shannon多样性指数除了G4高于林下外,其余林窗都低于林下。林窗中心的Pielou均匀度指数都低于林下,但Simpson优势度指数都高于林窗。在林窗边缘,只有G4和G5的Patrick丰富度指数低于林下。除了 G2和 G3林窗的Shannon多样性指数高于林下外,其余林窗都低于林下。Simpson优势度指数与此相反,除了G2和G3低于林下外,其余林窗都高于林下。在林窗边缘,除了G3林窗外,其余林窗的Pielou均匀度指数都低于林下。总体来看,林窗的形成减小了凋落物分解过程中细菌群落的 Patrick丰富度指数、Shannon多样性指数和Pielou均匀度指数,但增大了Simpson优势度指数。从季节变化来看,夏季的patrick丰富度指数、Shannon多样性指数和Pielou均匀度指数低于冬季,但Simpson优势度指数高于冬季。
2.4 细菌群落多样性与环境因子和凋落物化学质量的相关分析
从相关性分析结果来看(表4),在冬、夏两季,环境因子和凋落物化学质量对细菌群落结构多样性的影响差异较大。在冬季,丰富度和多样性指数与林窗大小显著相关,丰富度指数还与WC、DOC、N显著相关,多样性指数与DOC、N呈显著正相关,均匀度指数与WC呈显著负相关,与AT、TC呈显著正相关,优势度指数与N呈显著负相关。在夏季,细菌群落结构的丰富度、多样性、均匀度和优势度指数与林窗大小的相关性都不显著,但都与AT显著相关,均匀度指数还与TC显著相关。
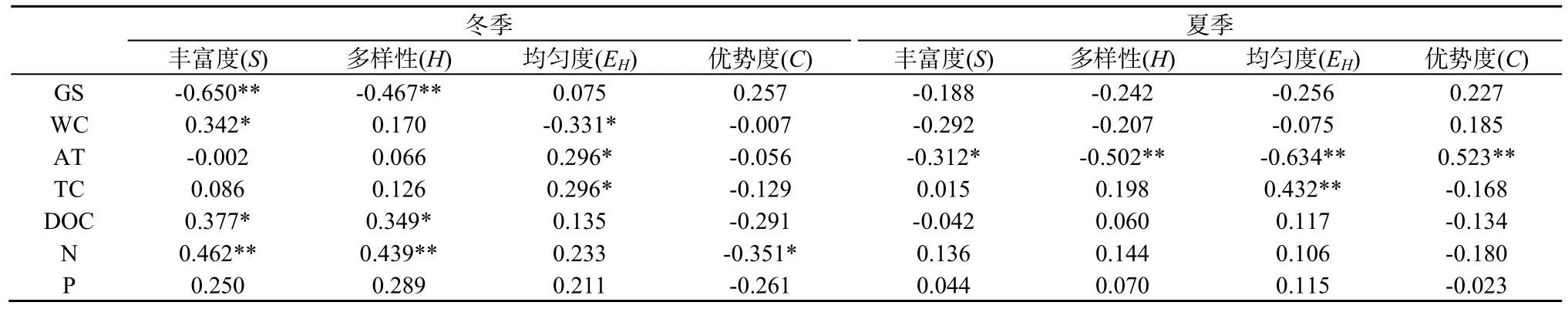
表4 细菌群落多样性指数的相关性分析Table 4 Correlation analysis of bacterial community diversity index
3 讨论与结论
3.1 讨论
林窗大小是林窗的重要特征之一,不同大小的林窗干扰可能产生不同的森林微环境(光照、温度及水分等)(Galhidy et al.,2006),从而影响到土壤养分有效性以及土壤微生物群落等(Muscolo et al.,2007)。在冬季,细菌群落的丰富度指数和多样性指数与林窗大小的相关性都极显著(表4)。一些菌纲的细菌类群只出现在特定大小的林窗内。这可能与冬季凋落物的含水率随林窗大小有显著变化有关。细菌群落结构不仅在不同大小林窗间有差异,在冬、夏两季间的差异也很明显(图2和图3)。从已知类群来看,在冬季凋落物分解中,出现了 7大菌门中的 10个菌纲的细菌类群,但在夏季,只出现了5大门中7个菌纲的细菌类群。冬季的细菌类群高于夏季。一方面,可能是因为不同细菌类群的生态适应性有所差异(蒲玲玲,2006;郑贺云等,
2012)。研究区域冬夏两季温差很大,冬冷夏热(表2),同时夏季的雨水较多,凋落物的含水率明显高于冬季(图1)。另一方面,可能与凋落物养分有效性的改变有关(Marschner et al.,2011),在本研究中,马尾松凋落叶中DOC、N、P的平均含量分别从冬季的9.65、10.60、0.45 g·kg-1减少到只有4.40、2.00、0.42 g·kg-1,DOC/TC从0.03减小到0.01,TC/TN从34.75增大到313.99。有研究发现微生物底物有效性较差,所能支持的微生物类群及数量相对较少(Taylor et al.,1989)。林窗大小的改变和凋落物分解的不同阶段导致的温度、水分、养分有效性的差异使细菌群落发生着变化,细菌群落多样性和结构组成的变化直接关系到微生物类群的功能和作用(Torsvik et al.,2002;Wellington et al.,2003)。
从已知类群来看,在冬夏两季,变形菌门、放线菌门、拟杆菌门和酸杆菌门均存在,这说明在调落物分解过程中,这4类细菌对环境的适应能力和凋落物的分解能力较强。在冬季,变形菌门是凋落物分解过程中的优势菌类群。在夏季,变形菌门、拟杆菌门和放线菌门分别在不同大小林窗的中心和边缘具有优势地位。细菌种类不同其功能也有所差异,细菌群落组成的变化将直接影响到各种细菌类群不同功能的发挥(Taylor et al.,1989),以及相互间的互作关系,从而对各种营养元素的循环、有机物的分解利用、植物对养分的吸收和生长发育产生影响。关于变形菌门的研究发现变形菌门是土壤中较为丰富的一个细菌门(Janssen,2006;杨鑫等,2008),对全球的碳、氮循环具有极为重要的作用(Kersters et al.,2006)。变形菌门在凋落物分解过程中的优势地位有利于凋落物分解过程中的碳氮循环。马尾松分解过程中的拟杆菌主要以黄杆菌纲和鞘脂杆菌纲为主,该类菌群也是调落物分解过程中的重要细菌类群,这类细菌对凋落物中纤维素的降解起着重要作用(赵野逸,2013)。放线菌能促使凋落物迅速腐烂,在氮素循环中起着重要作用。在冬季,不同大小林窗内凋落物中的优势细菌类群都属于变形菌门。但到了夏季,不同大小林窗内的优势细菌类群出现了差异,且不同细菌类群的相对含量也有很大变化。这说明随着马尾松凋落叶分解,不同大小的林窗对凋落物中细菌群落结构有着显著影响,进而可能会影响凋落物的分解过程。
从细菌群落多样性的相关性分析可以看出,环境因子和凋落物质量与细菌群落结构多样性的相关性在冬夏两季之间差异很大(表4)。在冬季,细菌多样性不仅与WC和AT显著相关,同时与TC、DOC和N也有着很强的相关性。前人的研究也表明土壤温度(Rinnan et al.,2007;Frey et al.,2008;Feng et al.,2009)、碳氮的可利用性(Hogberg et al.,2007;Ushio et al.,2008)影响着土壤微生物群落。而在夏季,除了均匀度指数与TC有显著的相关性,其余指数只与AT有显著的相关性。WC和AT的变化受林窗大小的影响,而TC、DOC和N含量作为凋落物基质的基本特征,随凋落物分解过程不断发生改变。细菌主要通过对凋落物的分解而获取碳源和氮源,随着凋落物的分解,凋落物的可溶性有机碳(DOC)、全氮(N)等分解逐渐释放,含量不断减少,养分有效性降低,进而导致可供细菌利用的能源物质减少,对细菌群落结构和多样性影响也逐渐减小(周晓庆等,2011)
3.2 结论
综上所述,人工林窗的形成对凋落物中细菌群落的多样性有着显著影响。林窗的形成减小了凋落物分解过程中细菌群落的丰富度指数、多样性指数和均匀度指数,但增大了优势度指数。从季节变化来看,夏季的丰富度指数、多样性指数和均匀度指数都低于冬季,但优势度指数高于冬季。由于冬、夏两季气候特征的差异以及凋落物分解引起的自身有机质和养分含量的变化导致了冬、夏两季凋落物分解过程中细菌群落结构和多样性的差异。相同气候下不同大小林窗的形成使得在林窗内形成了不同的微气候环境,微气候环境的差异能在一定程度上改变凋落物分解过程中的细菌群落结构和多样性,进而影响到森林生态系统中的物质和能量循环。虽然林窗的形成导致了细菌菌落结构的改变,但由于对很多细菌类群的生物学和生态学特性的研究还相对缺乏,因此林窗与细菌群落之间的关系有待进一步研究。
ABD LATIF Z, BLACKBUMl G A. 2010. The effects of gap size on some microclimate variables during late summer and autumn in a temperate broadleaved deciduous forest [J]. International Journal of Biometeorology, 54(2): 119-129.
BARDGETT R D, STREETER T C, COLE L, et al. 2002. Linkages between soil biota, nitrogen availability, and plant nitrogen uptake in a mountain ecosystem in the Scottish Highlands [J]. Applied Soil Ecology, 19(2): 121-134.
BEKKU Y S, NAKATSUBO T, KUME A, et al. 2004. Soil microbial biomass, respiration rate, and temperature dependence on a successional glacier foreland in Ny-ålesund, Svalbard [J]. Arctic Antarctic and Alpine Research, 36: 395-399.
CLINTON B D. 2003. Light, temperature and soil moisture response to elevation, evergreen understory, and small canopy gaps in the southern Appalachians [J]. Forest Ecology and Management, 186(1-3): 243-255.
CORRE M, SCHNABEL R, STOUT W. 2002. Spatial and seasonal variation of gross nitrogen transformations and microbial biomass in a Northeastern US grassland [J]. Soil Biology and Biochemistry, 34(4): 445-457.
CREAMER C A, DE MENEZES A B, KRULL E S, et al. 2015. Microbial community structure mediates response of soil C decomposition to litter addition and warming [J]. Soil Biology and Biochemistry, 80: 175-188.
FENG X, SIMPSON M J. 2009. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality [J]. Soil Biology and Biochemistry, 41(4): 804-812.
FREY S D, DRIJBER R, SMITH H, et al. 2008. Microbial biomass, functional capacity, and community structure after 12 years of soil warming [J]. Soil Biology and Biochemistry, 40(11): 2904-2907.
GALHIDY L, MIHOK B, HAGYO A, et al. 2006. Effects of gap size and associated changes in light and soil moisture on the understorey vegetation of Hungarian beech forest [J]. Plant Ecology, 183(1): 133-145.
GRAY A, SPIES T, EASTER M. 2002. Microclimatic and soil moisture responses to gap formation in coastal Douglas-fir forests [J]. Canadian Journal of Forest Research, 32(2): 332-343.
HOGBERG M N, HOGBERG P, MYROLD D D. 2007. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three? [J]. Oecologia, 150(4): 590-601.
JANSSEN P H. 2006. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes [J]. Applied and Environmental Microbiology, 72(3): 1719-1728.
KERSTERS K, DE V P, GILLIS M, et al. 2006. Introduction to the Proteobacteria [M]. New York: Springer.
LIPSON D A. 2007. Relationships between temperature responses and bacterial community structure along seasonal and altitudinal gradients [J]. Fems Microbiology Ecology, 59(2): 418-427.
LIPSON D A, SCHADT C W, SCHMIDT S K. 2002. Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt [J]. Microbial Ecology, 43(3): 307-314.
LIPSON D A, SCHMIDT S K, MONSON R K. 2000. Carbon availability and temperature control the post-snowmelt decline in alpine soil microbial biomass [J]. Soil Biology and Biochemistry, 32(4): 441-448.
MARSCHNER P, UMAR S, BAUMANN K. 2011. The microbial community composition changes rapidly in the early stages of decomposition of wheat residue [J]. Soil Biology and Biochemistry, 43(2): 445-451.
MICHELSEN A, ANDERSSON M, JENSEN M, et al. 2004. Carbon stocks, soil respiration and microbial biomass in fire-prone tropical grassland, woodland and forest ecosystems [J]. Soil Biology and Biochemistry, 36(11): 1707-1717.
MUSCOLO A, SIDARI M, MERCURIO R. 2007. Influence of gap size on organic matter decomposition, microbial biomass and nutrient cycle in Calabrian pine (Pinus laricio, Poiret) stands [J]. Forest Ecology and Management, 242(2): 412-418.
NAGEL T A, SVOBODA M, RUGANI T, et al. 2010. Gap regeneration and replacement patterns in an old-growth Fagus-Abies forest of Bosnia-Herzegovina [J]. Plant Ecology, 208(2): 307-318.
PRESCOTT C, HOPE G, BLEVINS L. 2003. Effect of gap size on litter decomposition and soil nitrate concentrations in a high-elevation spruce-fir forest [J]. Canadian Journal of Forest Research, 33(11): 2210-2220.
PROSSER J I. 2002. Molecular and functional diversity in soil microorganisms [J]. Plant and Soil, 244(1/2): 9-17.
RINNAN R, MICHELSEN A, BÅÅTH E, et al. 2007. Fifteen years of climate change manipulations alter soil microbial communities in a subarctic heath ecosystem [J]. Global ChangeBiology, 13(1): 28-39.
RITTER E. 2005. Litter decomposition and nitrogen mineralization in newly formed gaps in a Danish beech (Fagus sylvatica) forest [J]. Soil Biology and Biochemistry, 37(7): 1237-1247.
RITTER E, STARR M, VESTERDAL L. 2005. Losses of nitrate from gaps of different sizes in a managed beech (Fagus sylvatica) forest [J]. Canadian Journal of Forest Research, 35: 308-319.
SARIYILDIZ T. 2008. Effects of Gap-Size Classes on Long-Term Litter Decomposition Rates of Beech, Oak and Chestnut Species at High Elevations in Northeast Turkey [J]. Ecosystems, 11(6): 841-853.
SCHADT C W, MARTIN A P, LIPSON D A, et al. 2003. Seasonal dynamics of previously unknown fungal lineages in tundra soils [J]. Science, 301(5638): 1359-1361.
SPLECHTNA B E, GRATZER G, BLACK B A. 2005. Disturbance history of a European old-growth mixed-species forest——a spatial dendroecological analysis [J]. Journal of vegetation science, 16(5): 511-522.
TAYLOR B R, PARKINSON D, PARSONS W F J. 1989. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test [J]. Ecology, 70(1): 97-104.
TORSVIK V, ØVREÅS L. 2002. Microbial diversity and function in soil: from genes to ecosystems [J]. Current Opinion in Microbiology, 3(5): 240-245.
USHIO M, WAGAI R, BALSER T C, et al. 2008. Variations in the soil microbial community composition of a tropical montane forest ecosystem: Does tree species matter? [J]. Soil Biology and Biochemistry, 40(10): 2699-2702.
VAN DER HEIJDEN M G A, BARDGETT R D, VAN STRAALEN N M. 2008. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems [J]. Ecology Letters, 11(3): 296-310.
WARDLE D A. 1998. Controls of temporal variability of the soil microbial biomass: a global-scale synthesis [J]. Soil Biology and Biochemistry, 30(13): 1627-1637.
WARDLE D A, BARDGETT R D, KLIRONOMOS J N, et al. 2004. Ecological linkages between aboveground and belowground biota [J]. Science, 304(5677): 1629-1633.
WELLINGTON E M H, BERRY A, KRSEK M. 2003. Resolving functional diversity in relation to microbial community structure in soil: exploiting genomics and stable isotope probing [J]. Current Opinion in Microbiology, 3(6): 295-301.
ZHANG Q, ZAK J. 1995. Effects of gap size on litter decomposition and microbial activity in a subtropical forest [J]. Ecology, 76(7): 2196-2204.
蒲玲玲. 2006. 青藏高原冰川与冻土微生物多样性的研究[D]. 兰州: 兰州大学硕士学位论文.
王春阳, 周建斌, 王祥, 等. 2011. 黄土高原区不同植物凋落物可溶性有机碳的含量及生物降解特性[J]. 环境科学, 32(4): 1139-1145.
杨鑫, 曹靖, 董茂星, 等. 2008. 外来树种日本落叶松对森林土壤质量及细菌多样性的影响[J]. 应用生态学报, 19(10): 2109-2116.
赵野逸. 2013. 雪被对高山森林凋落物分解过程中微生物群落的影响[D].四川: 四川农业大学硕士学位论文.
郑贺云, 黎志坤, 李超, 等. 2012. 新疆阿克苏地区盐碱地细菌类群多样性及优势菌群分析[J]. 微生物学通报, 39(7): 1031-1043.
周晓庆, 吴福忠, 杨万勤, 等. 2011. 高山森林凋落物分解过程中的微生物生物量动态[J]. 生态学报, 31(14): 4144-4152.
Influence of Forest Gap on Bacterial Community Structure and Diversity during Litter Decomposition
ZHANG Mingjin1,2,3, ZHANG Jian1,2,3, JI Tuowei1,2,3, LIU Hua1,2,3, LI Xun1,2,3, ZHANG Yan1,2,3, YANG Wanqin1,2,3, CHEN Lianghua1,2,3*
1. Key laboratory of Ecological Forestry Engineering of Sichuan Province//Institute of Ecology & Forest, Sichuan Agricultural University, Chengdu 611130, China; 2. Long-term Research Station of Alpine Forest Ecosystems//Monitoring Station for Eco-environments in the Rainy Zone of SW China, Chengdu 611130, China; 3. Collaborative Innovation Center of Ecological Security in the Upper Reaches of Yangtze River, Chengdu 611130, China
The research on the bacterial community structure and diversity in litter in winter and summer was based on polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE) for 16S rDNA in seven gap sizes of a Pinus massoniana plantation (G1: 100 m2, G2: 225 m2, G3: 400 m2, G4: 625 m2, G5: 900 m2, G6: 1 225 m2, G7: 1 600 m2) in a hilly area of the upper Yangtze River. Results indicated that the bacterial community structure and diversity in litter were influenced by gap size, and this difference was also affected by the seasons. Some bacteria classes only appeared in forest gap of certain size, for example, Chloroflexi and Actinobacteria only appeared in US and G1, Bacilli only appeared in large and medium-sized (G4 to G7) forest gap, Flavobacteria only appeared in medium-sized (G4 and G5) forest gap, Planctomycetacia only existed in G5, G7 and US. The difference of bacteria community structure between winter and summer was very big. The bacteria groups of winter were more than summer. In winter, the diversity of bacterial community showed very close correlation with gap size, litter water content, daily average temperature, total carbon, dissolved organic carbon and total nitrogen content of litter; in summer, it was only related to daily average temperature and total carbon content of litter. Overall, Proteobacteria was the dominant in the process of litter decomposition, was conducive to the cycle of carbon and nitrogen in the process of litter decomposition. The formation of forest gap changed bacterial community structure and composition in litter, reduced the richness index, diversity index and evenness index of bacterial community in the process of litter decomposition, but increased the dominance index. Richness, diversity and evenness of bacterial community in winter were higher than those in summer, but dominance was lower than that in summer.
forest gap; litter decomposition; bacterial community; diversity; PCR-DGGE
10.16258/j.cnki.1674-5906.2015.08.005
Q948;X171.1
A
1674-5906(2015)08-1287-08
张明锦,张健,纪托未,刘华,李勋,张艳,杨万勤,陈良华. 林窗对凋落物分解过程中细菌群落结构和多样性的影响[J]. 生态环境学报, 2015, 24(8): 1287-1294.
ZHANG Mingjin, ZHANG Jian, JI Tuowei, LIU Hua, LI Xun, ZHANG Yan, YANG Wanqin, CHEN Lianghua. Influence of Forest Gap on Bacterial Community Structure and Diversity during Litter Decomposition [J]. Ecology and Environmental Sciences, 2015, 24(8): 1287-1294.
国家自然科学基金项目(31370628);国家科技支撑计划项目(2011BAC09B05);四川省科技支撑计划项目(12ZC0017);四川省科技厅应用基础项目(2012JY0047);四川省教育厅科技创新团队计划项目(11TD006)
张明锦(1990年生),硕士研究生,主要从事退化人工林生态恢复与重建研究。E-mail: 958192283@qq.com *通信作者:陈良华(1982年生),副研究员,研究生导师,主要从事植物生理生态,生态环境修复等研究。E-mail: chenlh@sicau.edu.cn
2015-06-01

