水溶性和醇溶性红曲色素的光稳定性
张庆庆,张 帝,汤文晶,杨 超
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
水溶性和醇溶性红曲色素的光稳定性
张庆庆,张 帝,汤文晶,杨 超
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
利用照度计量化红曲色素所接受的光,研究不同光照强度、波长和照射时间对红曲色素保存率的影响。结果表明:阳光(2 800~31 000 lx)对红曲色素的光降解最为显著;室内自然光(54~2 050 lx)对红曲色素的光稳定性影响较小,避光条件(0 lx)对红曲色素保存率无明显影响。红曲色素保存率随着光照时间的延长而降低,随着光照强度的增大而降低。在光照强度相同,单色光波长不同的条件下,红曲色素保存率由大到小依次为红光组>黄光组>绿光组>蓝光组>紫光组。红曲色素对短波紫外线较为敏感。在相同光照条件下,水溶性红曲色素光稳定性大于醇溶性红曲色素光稳定性。
红曲色素;光稳定性;光照强度;保存率
红曲色素是红曲霉的次级代谢产物,是一类聚酮化合物[1],按溶解性可分为水溶性和醇溶性两大类。红曲色素因具有天然、安全、营养、多功能等优点[2]而被广泛应用于食品特别是肉品工业中[3]。红曲色素的酸碱稳定性和热稳定性较好[4-5],但在溶液中对光不稳定,在光照条件会下发生光化学反应,逐渐降解[6-8],制约了红曲色素的应用。目前,对红曲色素光稳定性的研究[9-11]基本分为两类,一是将样品直接放置于阳光下或室内自然光下,忽视了自然条件光的不可控制、不稳定、变化差异较大等缺陷,对色素的稳定性研究造成了一定的局限性;二是以日光灯或紫外灯为光源照射样品,日光灯或紫外灯因质量、功率和样品距离的差异导致实验的可重复性较低且数据缺乏可比较性。光照强度表示被照明的表面单位面积上所接收的光通量[12],简称照度,表征受照面被照明程度的物理量,但又与被照射物体无关,比较适用于量化光对色素稳定性的影响。
本实验通过培养红曲霉发酵红曲色素,制备水溶性和醇溶性色素粗提液,采用照度计量化样品接收的光,对红曲色素的光稳定性进行研究,探讨了不同光源、不同光照强度、不同波长的光对红曲色素稳定性的影响,为在标准化条件下研究红曲色素的光稳定性研究提供一定的基础,也为红曲色素的研究和应用提供参考。
1 材料与方法
1.1 材料与试剂
红曲霉(Monascus ZZ307)由本实验室保藏;乙醇等试剂均为国产分析纯。
1.2 仪器与设备
BS-IEA振荡培养箱 国华电器有限公司;KQ-250DE医用数控超声波清洗器 昆山市超声仪器有限公司;TD5Z离心机 湖南凯达科学仪器有限公司;L5紫外-可见分光光度计 上海精科仪器有限公司;VC1010A数字照度计 深圳胜利仪器公司;H8000车灯改色膜 广州市欣浪广告材料有限公司。
1.3 方法
1.3.1 红曲色素粗提液的制备
红曲霉液态发酵料液3 500 r/min离心30 min,取上清液用适量蒸馏水稀释,调整溶液在495 nm波长处的初始吸光度为1.0±0.1,得到水溶性色素粗提液。离心后的沉淀用75%乙醇超声提取(250 W,60 ℃)2 h,3 500 r/min离心30 min,取上清液用适量75%乙醇稀释,调整溶液在505 nm波长处的初始吸光度为1.0±0.1[13-14],得到醇溶性色素粗提液。
1.3.2 色素保存率的测定和计算
样品处理后,用紫外-可见分光光度计分别在两种色素粗提液的最高吸收峰测定吸光度,并计算其色素保存率[15]。

式中:A0为样品初始吸光度;Ax为样品处理后的吸光度。
每次实验均作3 组平行实验,以3 组平行实验的平均值为最终结果。
1.3.3 自然光源对红曲色素光稳定性的影响
取10 mL水(醇)溶性色素粗提液置于具塞试管中,一组于早上6点开始置于日光直射条件下照射12 h,另一组于早上6点开始置于室内自然光条件下12 h,每隔1 h测定样品最高吸收峰的吸光度,计算其保存率;同时用光照强度计测量样品放置处的光照强度。
1.3.4 日光灯光源对红曲色素光稳定性的影响
分别取10 mL水(醇)溶性色素粗提液置于具塞试管中,置于温度为20 ℃的避光恒温培养箱中,以培养箱中的日光灯(预热30 min)为光源,调整日光灯的功率和样品与日光灯的距离,调节样品放置处的光照强度分别为100、300、500、800、1 000、1 200 lx,以完全避光条件(0 lx,20 ℃)的样品作为对照,每隔12 h测定样品最高吸收峰的吸光度,计算其保存率。
1.3.5 不同颜色的光源对红曲色素光稳定性的影响
分别用不同颜色的车灯改色膜覆盖光照强度计的测量探头,调节探头与日光灯(预热30 min)的距离光,记下不同颜色光源光照强度为500 lx的位置。用不同改色膜包裹装有10 mL水(醇)溶性色素粗提液的具塞试管放在相应的位置上,以1.3.4节中500 lx(日光灯光源,复合光)条件作为对照组,每隔12 h测定样品最高吸收峰的吸光度,计算其保存率。
1.3.6 短波紫外线对红曲色素光稳定性的影响
分别取3.5 mL水(醇)溶性色素溶液装在石英比色皿和玻璃比色皿中,置于温度为20 ℃的避光恒温培养箱中,以比色皿的光面对着紫外灯(预热30 min),放置在照度计显示紫外线光照强度为500 lx的位置上,每隔4 h测定样品最高吸收峰的吸光度,计算其保存率。
2 结果与分析
2.1 自然光源对红曲色素光稳定性的影响
2.1.1 阳光直射条件对红曲色素光稳定性的影响

图1 阳光直射对红曲色素光稳定性的影响Fig.1 Effect of direct sunlight on the photo-stability of Monascus pigments
实验当天室外温度为20~25 ℃。由图1可知,实验中阳光的光照强度变化为最低为2 800 lx,最高为31 000 lx,照射12 h后水溶性色素的保存率为54.39%,醇溶性色素的保存率为33.92%,说明照度较强的阳光对红曲色素的光降解较为显著。这是因为在光照强度较大时,红曲色素发色团吸收光量子,发生降解及合成反应,破坏其本身的结构,导致红曲色素保存率下降[16]。图1说明了水溶性色素的保存率要高于醇溶性色素的保存率,可能是因为水溶性色素是由醇溶性色素进一步糖基化和酰基化而来的[17],结构较为稳定,发生光化学反应需要的能量较高;也可能是水溶液中含有其他发酵产物,这些物质的某些基团与色素结构中发色团或辅色团结合,使色素构象稳定,减少了因能量跃迁发生的光化学反应[18],从而使得水溶性色素较醇溶性色素稳定。由图1还可知,在10:00~16:00期间,光照强度变化较大,色素保存率下降幅度相对较大,在其余时间段光照强度较低,色素保存率下降幅度不大。
2.1.2 室内自然光对红曲色素光稳定性的影响
实验当天室内温度为23~24 ℃。由图2可知,室内自然光的光照强度变化为54~2 050 lx,照射12 h后水溶性色素的保存率为95.05%,醇溶性色素的保存率为92.93%,说明室内自然光对红曲色素保存率影响较小,与阳光直射的情况相同,水溶性色素的保存率高于醇溶性色素的保存率。由图2还可知,在6:00~11:00期间,两类色素的保存率基本没有变化,在11:00~16:00期间,色素保存率下降幅度较大,在16:00之后,色素保存率降幅又趋于减小。
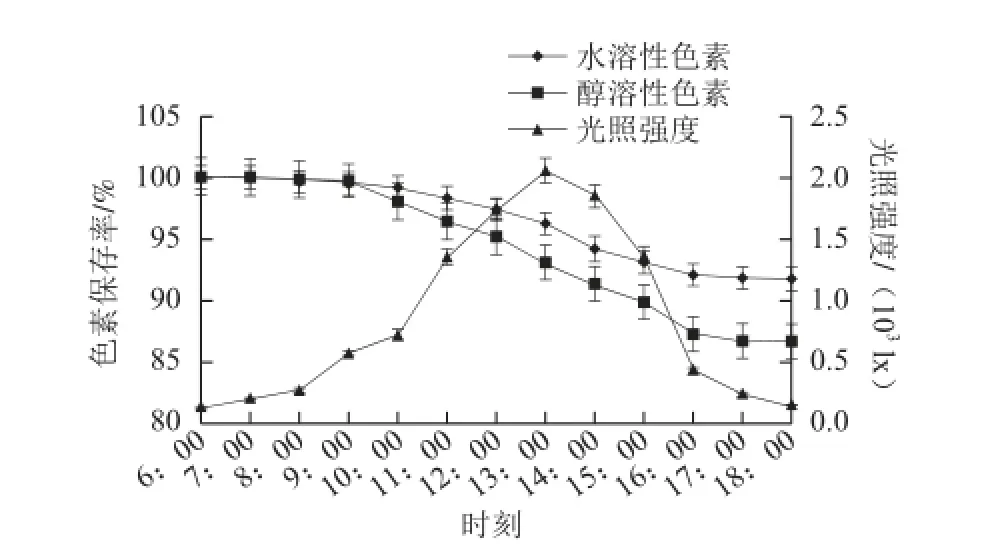
图2 室内自然光对红曲色素光稳定性的影响Fig.2 Effect of indoor natural light on the photostability of Monascus pigments
由图1、2可知,色素保存率与光照强度有很大关系,光照强度越大,色素越不稳定,保存率越低。这是因为光照强度越大,色素接收的光量子越多,接收的光的能量越多,导致色素的光降解增多,色素保存率下降较快。由于阳光直射的光照强度远大于室内自然光的光照强度,阳光直射下的色素保存率远低于自然光条件下色素的保存率。
2.2 日光灯光源对红曲色素光稳定性的影响
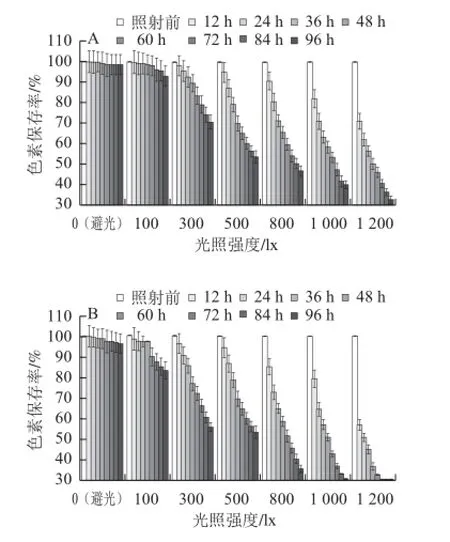
图3 不同光照强度对红曲色素光稳定性的影响Fig.3 Effect of illumination intensity on the photostability of Monascus pigments
日光灯的光波长范围和阳光可见光波长范围一致,且产生的紫外线很少,所以利用功率恒定的日光灯作为光源进行实验,可以较好地模拟可见光对色素稳定性的影响。图3为以日光灯为灯源,不同光照强度对水溶性和醇溶性色素稳定性的影响。由图3可知,红曲色素在避光条件(0 lx)下很稳定,经过96 h后水溶性色素的保存率为98.43%,醇溶性色素的保存率为96.22%。随着光照强度的增加,照射后的红曲色素保存率逐渐降低,光照强度1 200 lx照射96 h,水溶性色素的保存率为32.62%,醇溶性色素的保存率仅为12.9%。说明了避光(0 lx)贮存是保存红曲色素的最好方法。相同条件下水溶性色素的保存率要高于醇溶性色素的保存率,这与2.1.1、2.1.2节结果相同。
由图3还可知,在光照强度较小(100、300 lx)时,水溶性和醇溶性色素的保存率均随着照射时间的增加而缓慢下降;光照强度增加到500 lx及更大时,色素的保存率随着照射时间的延长先急速下降再缓慢下降。这说明红曲色素在接受较大的光照强度的照射一段时间后会出现保存率突然下降的现象,再照射一段时间后保存率的下降趋势会减小,这与文献[19-21]结果一致。可能是随着色素光降解的进行,溶液中色素的浓度越来越低,色素降解为其他物质,逐渐增多的光降解产物可能影响色素继续分解;也可能是色素光降解开始时生成的自由基较多,大量的自由基倾向于偶合而非歧化,不利于小分子的生成与释放,同时使分子链间出现交联,导致后期降解趋于缓慢[22]。
2.3 不同颜色的光源对红曲色素光稳定性影响

图4 不同颜色的光对红曲色素光稳定性的影响Fig.4 Effect of different colors of light on the photostability of Monascus pigments
由图4可知,在照射96 h后水溶性色素保存率由高到低依次为红光组71.16%、黄光组的67.52%、绿光组60.03%、蓝光组51.87%、紫光组48.66%,对照组保存率为53.77%;醇溶性色素保存率由高到底依次为红光组62.45%、黄光组58.58%、绿光组49.32%、蓝光组38.33%、紫光组35.01%,对照组保存率为40.77%,其中单色光对色素保存率影响的顺序与文献[23]报道一致。红光组、黄光组保存率较对照组有明显提高,蓝光组和紫光组较对照组保存率有所下降。这是因为根据光子能量公式E=hν(h为普朗克常量,ν为光波频率),单色光波长越短,频率越高,能量越大。照度相同情况下,各组单色光的能量由小到大依次为红光<黄光<绿光<蓝光<紫光,这与色素保存率由大到小的顺序一致;而对照组的白光是由七色光混合组成的复合光,在相同照度情况下,比红光等低频光的能量高,比紫光等高频光的能量低。
2.4 短波紫外线对红曲色素光稳定性的影响

图5 短波紫外线对红曲色素光稳定性的影响Fig.5 Effect of ultraviolet C ray of light on the photostability of Monascus pigments
本实验将色素溶液分别置于玻璃比色皿和石英比色皿中,以塞子封口,放置在紫外照度为500 lx的位置进行实验,使两种比色皿接受的紫外线强度一致。由图5可知,在玻璃比色皿中水溶性色素和醇溶性色素溶液保存率均良好,在照射24 h后水溶性色素和醇溶性色素的保存率分别为94.29%和90.68%;而在石英比色皿中的水溶性色素和醇溶性色素溶液稳定性较差,在照射24 h后保存率分别为56.08%和40.42%。推测是因为实验室所用的紫外灯产生的紫外线为短波灭菌紫外线,其穿透能力较弱,无法穿透大部分的透明玻璃和薄膜[24],但是可穿透石英比色皿。在玻璃比色皿中的样品因为短波紫外线被玻璃吸收,导致样品接受的短波紫外线很少,光的能量也很低,而在石英比色皿中的样品接受的短波紫外线较多。短波紫外线的波长远小于可见光的波长,光的能量较大,使红曲色素更易发生光化学反应,色素保存率较低;还可能因为溶液经紫外线照射可以产生活性氧自由基,•H和eaq(水合电子)等[25-26],进一步加速了色素分子的降解。
3 结 论
本实验从照射样品角度出发,引入了光照强度物理量,对水溶性和醇溶性红曲色素的光稳定性进行研究。结果表明,照度最强的阳光使红曲色素的保存率下降最大,阳光直射12 h后,水溶性红曲色素溶液保存率为54.39%,醇溶性红曲色素溶液保存率为33.92%。红曲色素在室内自然光条件下的保存率明显高于阳光直射条件,12 h后水溶性红曲色素和醇溶性红曲色素的保存率分别为95.05%和92.93%。以日光灯为光源进行实验发现,红曲色素保存率随着光照强度的增大而减小,随着光照时间的延长而减小。在照度相同,单色光波长不同的情况下,红曲色素保存率由大到小依次为:红 光组>黄光组>绿光组>蓝光组>紫光组。波长越长的单色光对红曲色素保存率的影响越低,短波紫外线对红曲色素的稳定性影响较大。相同光照条件下,水溶性红曲色素稳定性高于醇溶性红曲色素。在生产操作中,应注意避免阳光、紫外线照射红曲色素,尽量在避光或光照强度较低条件下进行生产操作。应采用避光材料或者红色等暖色材料作为红曲色素产品的包装,避免使用蓝紫色和透明材料作为包装。
[1] 黄志兵, 许杨, 张淑云, 等. 红曲菌两种荧光代谢产物与BSA相互作用的光谱法研究[J]. 食品工业科技, 2013, 34(13): 106-108.
[2] 周建建, 苏理, 赵双枝, 等. 采用响应曲面法优化红曲霉发酵培养基组分[J]. 食品工业科技, 2012, 33(23): 152-157.
[3] 崔莉, 胡晓丹, 张德权. HPLC法同时测定红曲色素中的红曲素和安卡红曲黄素[J]. 食品科学, 2009, 30(8): 163-166.
[4] SILVEIRA S T, DAROIT D J, SANT’ANNA V, et al. Stability modeling of red pigments produced by Monascus purpureus in submerged cultivations with sugarcane bagasse[J]. Food and Bioprocess Technology, 2013, 6(4): 1007-1014.
[5] VELMURUGAN P, HUR H, BALACHANDAR V, et al. Monascus pigment production by solid-state fermentation with corncob substrate[J]. Journal of Bioscience and Bioengineering, 2011, 112(6): 590-594.
[6] MAPARI S A S, MEYER A S, THRANE U. Colorimetric characterization for comparative analysis of fungal pigments and natural food colorants[J]. Journal of Agricultural and Food chemistry, 2006, 54(19): 7027-7035.
[7] de SANTIS D, MORESI M, GALLO A M, et al. Assessment of the dyeing properties of pigments from Monascus purpureus[J]. Journal of Chemical Technology and Biotechnology, 2005, 80(9): 1072-1079.
[8] JUNG H, CHOE D, NAM K Y, et al. Degradation patterns and stability predictions of the original reds and amino acid derivatives of monascus pigments[J]. European Food Research and Technology, 2011, 232(4): 621-629.
[9] 王昌禄, 王莹, 陈勉华, 等. 红曲色素不同成分的光稳定性研究[J].食品研究与开发, 2008, 29(10): 189-192.
[10] 雷恒, 汪芳安, 李永丽, 等. 响应面法优化红曲色素的提取工艺及其稳定性研究[J]. 食品工业科技, 2010, 31(6): 283-286.
[11] 赵文红, 朱豪, 梁彬霞, 等. 红曲色素TR的稳定性研究[J]. 食品科技, 2012, 37(1): 237-240.
[12] 李林. 应用光学[M]. 4版. 北京: 北京理工大学出版社, 2010: 107-111.
[13] 王红娟, 连喜军, 郭坤亮, 等. 红曲红色素光稳定性测定方法探讨[J].食品科学, 2005, 26(1): 201-204.
[14] NIMNOI P, LUMYONG S. Improving solid-state fermentation of Monascus purpureus on agricultural products for pigment production[J]. Food and Bioprocess Technology, 2011, 4(8): 1384-1390.
[15] 乔华, 李美萍, 冯彦琳, 等. 红曲色素与β-环糊精包合物的研究[J]. 食品工业科技, 2006, 27(7): 161-163; 166.
[16] 张晓伟, 王昌禄, 陈勉华, 等. 理化因子对红曲色素色价的影响及桔霉素的光降解性[J]. 食品科学, 2013, 34(15): 17-21.
[17] 衣珊珊, 沈昌. 红曲色素形成机制及提高其色价的途径[J]. 食品科学, 2005, 26(7): 256-261.
[18] 黄林, 程新, 魏赛金, 等. 红曲霉JR所产红曲色素的稳定性研究[J].中国调味品, 2011, 36(2): 93-96.
[19] 赵文红, 朱豪, 梁彬霞, 等. 红曲色素TY的稳定性研究[J]. 中国食品添加剂, 2012(3): 125-128.
[20] MAPARI S A S, MEYER A S, THRANE U. Photostability of natural orange-red and yellow fungal pigments in liquid food model systems[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6253-6261.
[21] 陈鼎, 夏春镗. 花青素类天然色素的光降解比较[J]. 同济大学学报:医学版, 2006, 27(5): 13-16.
[22] 许深, 高卫国, 孙涛, 等. 聚酮及其共混物的光降解性能[J]. 高分子材料科学与工程, 2005, 21(5): 178-180.
[23] 嵇豪, 蒋冬花, 叶砚, 等. 红曲色素的提取工艺及其稳定性研究[J].中国调味品, 2010, 35(7): 86-89.
[24] 孙红男, 卢义伯, 赵立庆, 等. 三种天然色素稳定性及其护色效果的研究[J]. 食品工业科技, 2010, 31(7): 308-312.
[25] 闻瑞梅, 邓守权, 葛伟伟. 用紫外光和双氧水降低工业废水色度的研究[J]. 电子学报, 2005, 33(8): 1353-1355.
[26] 刘满红, 杨明惠, 刘晓芳, 等. 紫外辐射诱发自由基体系及抗氧化活性的研究[J]. 化学世界, 2008, 49(1): 14-16.
Photostability of Water-Soluble and Alcohol-Soluble Monascus Pigments
ZHANG Qingqing, ZHANG Di, TANG Wenjing, YANG Chao
(College of Biology and Chemical Engineering, Anhui Polytechnic University, Wuhu 241000, China)
Effects of illumination intensity (which was determined by quantifying the light absorbed using a luxmeter), wavelength and irradiation time on the preservation rate of Monascus pigments were examined. Sunlight (2 800–31 000 lx) caused the most serious photodegradation for monascus pigments whereas indoor natural light (54–2 050 lx) had relatively less serious effects, and no photodegradation was observed under dark condition (0 lx) The preservation rate of Monascus pigments was decreased with increasing illumination intensity and irradiation time. Under the condition of the same illumination intensity but different wavelengths, the preservation rate of Monascus pigments followed the decreasing order: red light > yellow light > green light > blue light > purple light. Monascus pigments were more sensitive to ultraviolet-C light. Under the same condition, water-soluble Monascus pigments were more stable than alcohol-soluble Monascus pigments.
Monascus pigments; photostability; illumination intensity; preservation rate
TS202.3
A
1002-6630(2015)01-0094-05
10.7506/spkx1002-6630-201501018
2014-01-15
安徽高校省级自然科学研究重点项目(KJ2009A034);芜湖市重点科技项目(芜科计字[2009]109)
张庆庆(1954—),女,教授,本科,研究方向为现代微生物发酵技术。E-mail:zhangqq@ahpu.edu.cn

