5-羟色胺5-HT2C受体激动剂抑制吗啡依赖小鼠纳洛酮诱导的戒断行为
吴 县,江 勤,庞 刚,刘 欢,3,陶欣荣,4,董六一,章功良
(安徽医科大学1.药理学教研室、2.药物成瘾研究所、3.精神卫生临床学院,安徽合肥 230032;4.安徽理工大学,安徽淮南 232001)
阿片类药物吗啡及其化学合成衍生物海洛因的滥用、依赖和成瘾已成为我国以及许多其他国家特别是西南亚、中亚、东南欧和北美洲等地区日益严重的社会问题。中国的吸毒人群以滥用海洛因等阿片类毒品为主,截至2013年底,全国累计登记吸毒人员247.5万名,其中滥用阿片类毒品人员135.8万名、滥用合成毒品人员108.4万名,分别占54.9%和43.8%(2014年中国禁毒报告,国家禁毒委员会办公室、公安部禁毒局)。阿片类毒品成瘾严重损害了患者的身心健康、增加家庭和社会负担和诱发了各种违法犯罪活动。
中枢神经系统5-羟色胺(5-HT)调节行为、情绪和认知等多种功能活动。5-HT通过对中脑-边缘多巴胺系统的调节和与其受体相互作用影响大脑情感认知和成瘾行为功能[1]。目前关于5-HT递质系统在成瘾中的研究集中于5-HT2受体家族,5-HT2受体家族包括5-HT2AR、5-HT2BR 和 5-HT2CR[2]。国内外大量研究发现5-HT2CR与药物成瘾性密切相关,其受体激动剂可以减弱成瘾动物对可卡因、尼古丁和致幻剂的渴求、摄取以及复吸行为[3]。然而,目前5-HT2CR在吗啡依赖和戒断中的作用未见报道,在本实验中,我们建立吗啡依赖小鼠动物模型,研究5-HT2CR激动剂对吗啡依赖小鼠戒断行为的影响,初步探讨5-HT2CR在吗啡依赖防治中的作用。
1 材料与方法
1.1 材料
1.1.1 实验药物 吗啡:沈阳第一制药厂,批号:080301;WAY:上海医药科技有限公司,批号:20140112;纳洛酮:康哲(湖南)制药有限公司,批号:20120209;盐酸可乐定片:江苏云阳集团药业有限公司,批号:20130419。
1.1.2 实验动物 SPF级昆明种小鼠80只,♀♂各半,体质量18~22 g,购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2011-002,实验动物使用许可证号:SYXK(皖)2011-007。饲养室温:(22±2)℃;湿度:40% ~70%;照明周期:12 h明/12 h暗。
1.1.3 实验仪器 PhenoTyper system(Noldus Information Technology,Wageningen,TheNetherlands,XT5.1);电子天平:梅特勒-托利多仪器有限公司。
1.2 方法
1.2.1 小鼠自发活动记录和分析 取昆明种小鼠40只,♀♂各半,购入后适应动物房环境1周后,随机均分成4组:生理盐水对照组,5-HT2CR激动剂3个剂量组(0.5、0.75、1.0 mg·kg-1)每组10 只。动物每天记录体重,每天抚摸小鼠3~5 min以减少实验者对动物的应激刺激。实验前3 d,每天用针刺皮肤,模拟腹腔注射(i.p.)过程,腹腔注射生理盐水1次,以减少动物的应激反应。实验前不禁食不禁水,小鼠实验测试前一天适应记录环境,观察和记录小鼠60 min内在记录环境中运动距离和速度。5-HT2CR激动剂WAY 3个剂量组(0.5、0.75、1.0 mg·kg-1)腹腔注射给药1次,正常对照组小鼠给予等体积生理盐水。给药后立即放入旷野实验盒内,记录时间为60 min,记录分析运动距离和速度。所有动物进行1个星期的药物洗脱后,被用于下一次实验。
1.2.2 吗啡依赖小鼠模型的诱导 取昆明种小鼠30只,体质量18~22 g,♀♂各半,随机分为生理盐水对照组、纳洛酮(5.0 mg·kg-1)给药组、WAY(0.5 mg·kg-1)给药组。参照 EL-Kadi法,采用后肢皮下注射剂量递增法形成吗啡依赖模型[4-5],造模方法见(Tab 1)。末次给药2.5 h后,生理盐水对照组腹腔注射等体积生理盐水,纳洛酮给药组腹腔注射(5.0 mg·kg-1)剂量,WAY组腹腔注射(0.5 mg·kg-1)剂量。给药后放入观测盒内,记录各实验组小鼠60 min内运动距离和速度,以及在30 min内出现打洞、跳跃、清理脸部、“湿狗”样抖动、舔爪子、伸展、抓挠、清理皮毛、清理会阴、直立等症状发生总次数[6]。
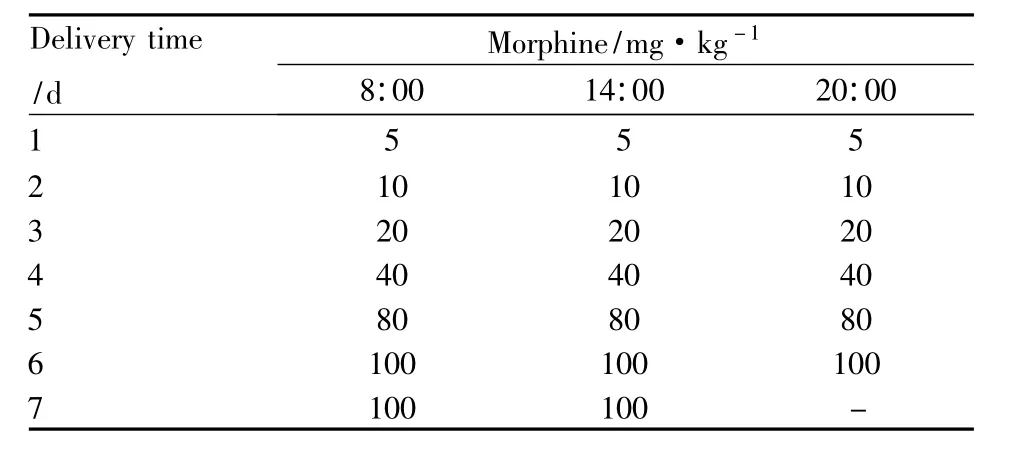
Tab 1 Induction of morphine dependence
1.2.3 不同剂量的5-HT2CR激动剂WAY对吗啡依赖小鼠戒断行为的影响 取昆明种小鼠50只,体质量18~22 g,♀♂各半,随机分为生理盐水对照组,5-HT2CR 激动剂 (0.5、0.75、1.0 mg·kg-1)剂量组及可乐定(0.2 mg·kg-1)阳性对照组,每组10只。参照“1.2.2”诱导吗啡依赖小鼠模型方法,末次给药2.5 h后,生理盐水对照组腹腔注射等体积生理盐水,阳性对照组腹腔注射可乐定(clonidine,0.2 mg·kg-1),给药组各组分别一次腹腔注射(0.5,0.75或1.0 mg·kg-1)剂量的5-HT2CR 激动剂WAY。30 min后腹腔注射纳洛酮(5.0 mg·kg-1)催瘾,立即放入观测盒内,记录各实验组小鼠60 min内运动距离和速度,以及在30 min内出现打洞、跳跃、清理脸部、“湿狗”样抖动、舔爪子、伸展、抓挠、清理皮毛、清理会阴、直立等症状发生总次数。1.3 统计学分析 将实验数据用SPSS 19.0(IBM)软件处理系统分析数据,结果以±s表示,组间进行单因素方差分析,如果差别有显著性,进一步进行post-hoc Bonferroni多重比较检验。
2 结果
2.1 5-HT2CR激动剂WAY对小鼠自发活动的影响 单因素方差分析结果显示,小鼠腹腔注射生理盐水,WAY(0.5、0.75 或 1.0 mg·kg-1)后运动距离(F3,34=0.12,n.s.)和运动速度(F3,34=0.12,n.s.),差异没有显著性(P >0.05),见 Fig 1。
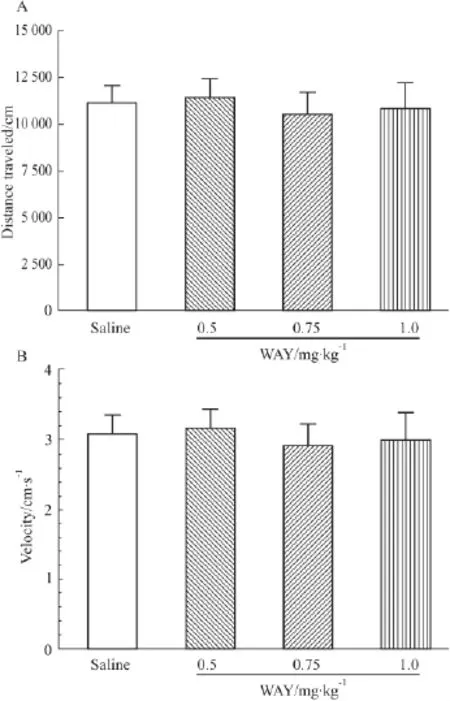
Fig 1 WAY alone does not affect locomotor activity
2.2 小鼠吗啡戒断模型 小鼠注射吗啡7 d,与生理盐水对照组相比,纳洛酮给药组可明显增加戒断行为,包括打洞、跳跃、清理皮毛、站立、“湿狗”样抖动、摇头、舔爪子、抓挠、清理脸部、清理会阴和体重减少(P<0.01,Tab 2),提示小鼠成功建立了吗啡依赖戒断模型。5-HT2CR激动剂WAY(0.5 mg·kg-1,i.p.)可以明显降低小鼠运动距离(Fig 2A)和速度(Fig 2B),对依赖小鼠的行为敏感化具有一定的抑制作用(Fig 2)。
2.3 5-HT2CR激动剂 WAY对纳洛酮催促吗啡依赖小鼠戒断行为的影响 与生理盐水对照组比较,(0.5、0.75、1.0 mg·kg-1)剂量的 WAY 明显减少小鼠的一些戒断症状,包括打洞、跳跃、清理皮毛、站立、“湿狗”样抖动、摇头、清理脸部和抓挠(P<0.05)。可乐定(0.2 mg·kg-1,i.p.)阳性对照药可乐定也可明显降低戒断症状,包括打洞、跳跃、清理皮毛、站立、“湿狗”样抖动、摇头、清理脸部和抓挠(P <0.05,Tab 3)。
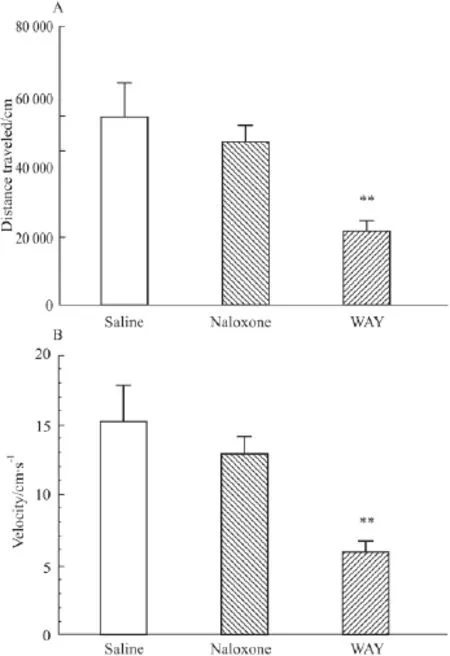
Fig 2 WAY alone reduces locomotor activity in mice received chronic morphine treatment
2.4 5-HT2CR激动剂WAY对纳洛酮催促吗啡依赖小鼠自发活动的影响 剂量递增法使小鼠形成对吗啡的依赖,用纳洛酮催促,记录运动距离和运动速度,记录时间为60 min。与生理盐水对照组相比,腹腔注射 WAY(0.5、0.75、1.0 mg·kg-1)剂量组和可乐定 (0.2 mg·kg-1)明显降低运动距离(Fig 3A)和运动速度(Fig 3B)(P<0.01)。
3 讨论
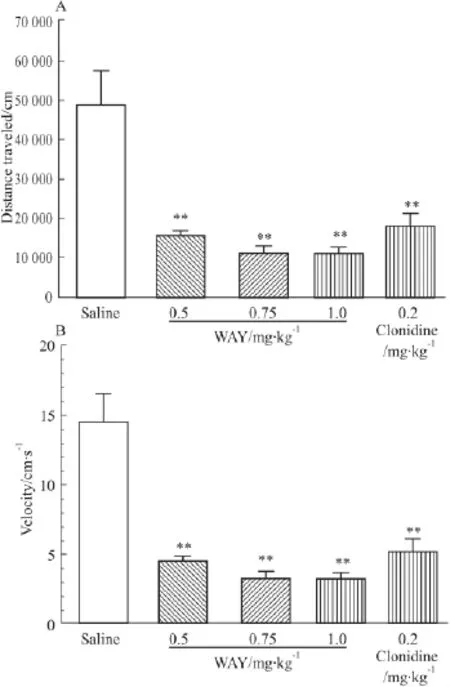
Fig 3 WAY inhibits naloxone-precipitated locomotor activity in morphine-dependent mice
在本研究中,我们首次发现5-HT2CR激动剂WAY抑制吗啡依赖小鼠纳洛酮诱导的戒断行为,提示5-HT2CR参与阿片类物质戒断和成瘾的发生过程。吸毒与戒毒一直是世界性的话题与难题,寻找安全有效、能迅速脱毒及长久戒断的药物是神经药理学家追求的目标。阿片类物质引起的强大的精神奖赏效应和戒断反应是其毒瘾形成、维持、复发以及强迫性觅药行为的基础[7-8]。中脑边缘系统多巴胺(DA)奖赏系统与吗啡成瘾的形成和强化密切相关,中脑腹侧被盖区(VTA)DA能神经元投射到伏膈核(NAc),内侧前额叶皮层(PFC)等脑区[9]。目前认为成瘾物质增加VTA的DA神经元兴奋性,导致NAc的DA水平增加是产生成瘾行为的基础。正常情况下,VTA的DA能神经元的活动受到γ-氨基丁酸(GABA)能神经元的紧张性抑制,而GABA能神经元上存在μ和5-HT2C受体,当吗啡与μ受体激动剂结合后,可抑制GABA能神经元。减少GABA的释放,取消对于DA能神经元的紧张性抑制,使释放到NAc区的DA量增加,作用于D1受体从而完成阿片的奖赏效应[10]。与此相对应,5-HT2C受体可以增加VTA的GABA能神经元活动,抑制DA能神经元输出,从而抑制药物摄取行为。此外,阿片类物质还可通过NAc的相应阿片受体,增加DA释放产生直接效应[11]。除DA外,去甲肾上腺素(NE)、5-HT和兴奋性氨基酸递质系统也参与吗啡等阿片类物质成瘾、依赖、耐受和戒断等反应。
目前治疗吗啡成瘾的主要手段为用阿片受体激动剂的替代药物递减疗法以及非阿片类脱毒药物,它们的主要作用是对戒断症状进行对症处理。利用麻醉剂实现意识剥夺,从而使成瘾者能够没有痛苦地渡过戒断期也是一种治疗手段[12],然而这些药物和手段仅能对症治疗,暂时缓解NE和乙酰胆碱(ACh)能等神经递质兴奋导致戒断症状。因此寻找一种能够较好地解决心理依赖从而降低复吸率的疗法,就成了当务之急。
神经系统5-HT2CR调控药物摄取和成瘾行为。5-HT2CR在脑内与成瘾发生、发展有关的多个区域表达,如皮质、中脑边缘系统和杏仁核等。药物滥用会导致 NAc细胞外 DA水平升高。研究发现在VTA中直接注射5-HT2CR激动剂Ro 60-0175可剂量依赖性的降低NAc和额叶内的细胞外DA水平,阻断可卡因的成瘾作用[13]。选择性5-HT2CR拮抗剂SB-242084则产生与Ro 60-0175相反的作用,它可以增强VTA细胞的兴奋和NAc及额叶DA的释放,提示5-HT2CR激动剂可以通过GABA神经元抑制DA释放,抑制药物成瘾行为。此外,Ro 60-0175除对于减少可卡因自身给药行为有明显效果,也可减少对酒精和尼古丁引起的自我给药行为[14]。
Tab 2Naroxone precipitates withdrawal in morphine-dependent mice(±s)
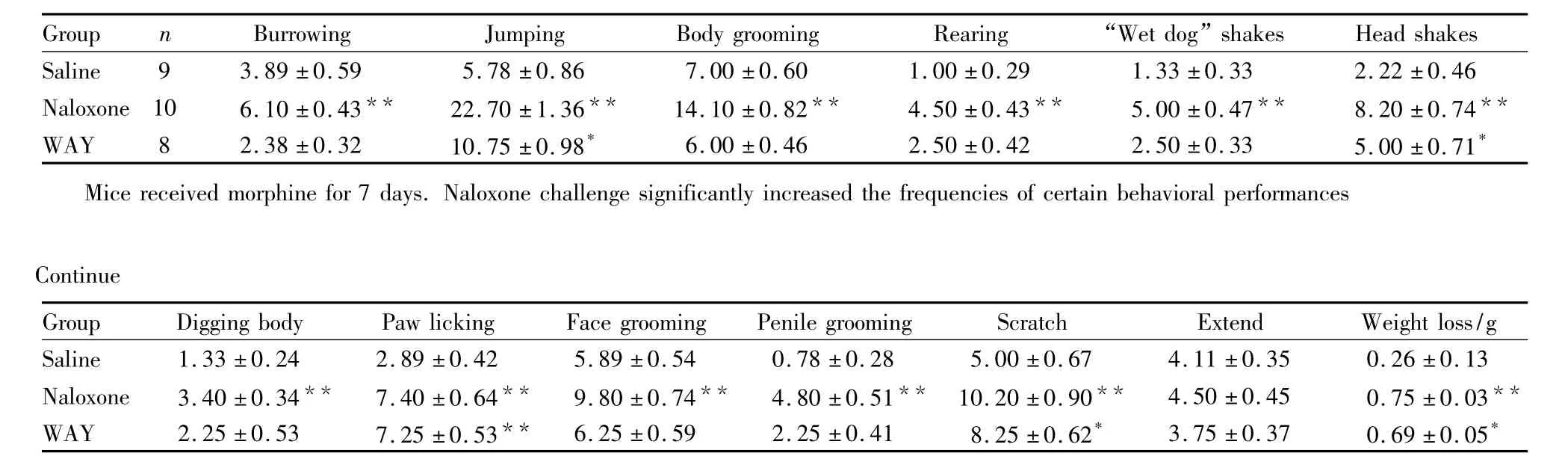
Tab 2Naroxone precipitates withdrawal in morphine-dependent mice(±s)
*P <0.05,**P <0.01 vs saline group
Group n Burrowing Jumping Body grooming Rearing “Wet dog”shakes Head shakes Saline 9 3.89 ±0.59 5.78 ±0.86 7.00 ±0.60 1.00 ±0.29 1.33 ±0.33 2.22 ±0.46 Naloxone 10 6.10 ±0.43** 22.70 ±1.36** 14.10 ±0.82** 4.50 ±0.43** 5.00 ±0.47** 8.20 ±0.74**WAY 8 2.38 ±0.32 10.75 ±0.98* 6.00 ±0.46 2.50 ±0.42 2.50 ±0.33 5.00 ±0.71*Mice received morphine for 7 days.Naloxone challenge significantly increased the frequencies of certain behavioral performances Continue Group Digging body Paw licking Face grooming Penile grooming Scratch Extend Weight loss/g Saline 1.33 ±0.24 2.89 ±0.42 5.89 ±0.54 0.78 ±0.28 5.00 ±0.67 4.11 ±0.35 0.26 ±0.13 Naloxone 3.40 ±0.34** 7.40 ±0.64** 9.80 ±0.74** 4.80 ±0.51** 10.20 ±0.90** 4.50 ±0.45 0.75 ±0.03**WAY 2.25 ±0.53 7.25 ±0.53** 6.25 ±0.59 2.25 ±0.41 8.25 ±0.62* 3.75 ±0.37 0.69 ±0.05*
Tab 3 WAY attenuates naloxone-precipitated withdrawal in morphine-dependent mice(±s,n=10)
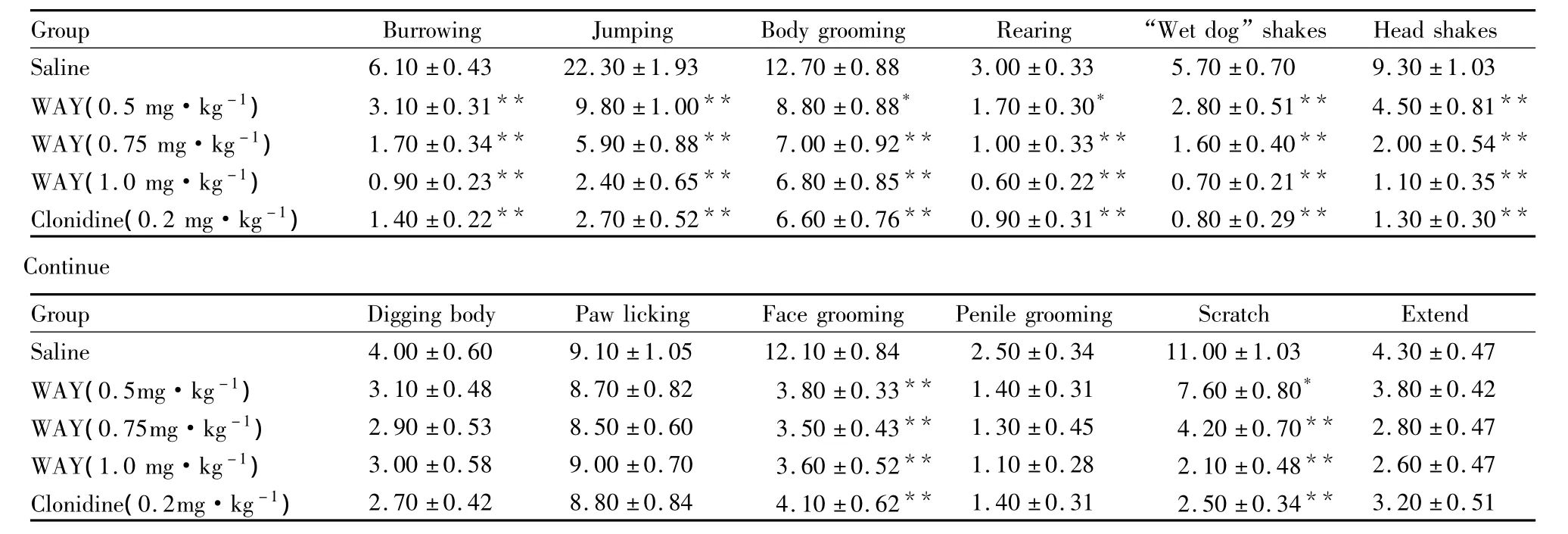
Tab 3 WAY attenuates naloxone-precipitated withdrawal in morphine-dependent mice(±s,n=10)
*P <0.05,**P <0.01 vs saline group
Group Burrowing Jumping Body grooming Rearing “Wet dog”shakes Head shakes Saline 6.10 ±0.43 22.30 ±1.93 12.70 ±0.88 3.00±0.33 5.70 ±0.70 9.30 ±1.03 WAY(0.5 mg·kg-1) 3.10 ±0.31** 9.80 ±1.00** 8.80 ±0.88* 1.70 ±0.30* 2.80 ±0.51** 4.50 ±0.81**WAY(0.75 mg·kg-1) 1.70 ±0.34** 5.90 ±0.88** 7.00 ±0.92** 1.00 ±0.33** 1.60 ±0.40** 2.00 ±0.54**WAY(1.0 mg·kg-1) 0.90 ±0.23** 2.40 ±0.65** 6.80 ±0.85** 0.60 ±0.22** 0.70 ±0.21** 1.10 ±0.35**Clonidine(0.2 mg·kg-1) 1.40 ±0.22** 2.70 ±0.52** 6.60 ±0.76** 0.90 ±0.31** 0.80 ±0.29** 1.30 ±0.30**Continue Group Digging body Paw licking Face grooming Penile grooming Scratch Extend Saline 4.00 ±0.60 9.10 ±1.05 12.10 ±0.84 2.50 ±0.34 11.00 ±1.03 4.30 ±0.47 WAY(0.5mg·kg-1) 3.10 ±0.48 8.70 ±0.82 3.80 ±0.33** 1.40 ±0.31 7.60 ±0.80* 3.80 ±0.42 WAY(0.75mg·kg-1) 2.90 ±0.53 8.50 ±0.60 3.50 ±0.43** 1.30 ±0.45 4.20 ±0.70** 2.80 ±0.47 WAY(1.0 mg·kg-1) 3.00 ±0.58 9.00 ±0.70 3.60 ±0.52** 1.10 ±0.28 2.10 ±0.48** 2.60 ±0.47 Clonidine(0.2mg·kg-1) 2.70 ±0.42 8.80 ±0.84 4.10 ±0.62** 1.40 ±0.31 2.50 ±0.34**3.20 ±0.51
吗啡戒断的表达依赖于完整的NE能通路的功能反应以及它的上下游通路[15-16]。急性吗啡治疗抑制NE的蓝斑(LC)神经元的活动,突然终止吗啡治疗会导致LC神经元失去抑制作用并且增加放电频率,并导致戒断症状。5-HT2CR发挥调控作用,在肾上腺素传输中起到抑制作用。5-HT2CR激动剂Ro 60-0175明显的抑制NE在额叶皮质的水平,而5-HT2CR 拮抗剂,SB-242084 明显的增加 NE[17]。同时,Ro 60-0175剂量依赖性地降低LC神经元的放电频率[18],这表明5-HT2CR影响中枢交感神经。5-HT2CR的药理特性已经有报道,主要是作用在GABA能神经元上抑制VTA的DA神经元的活性。我们推测,激活5-HT2CR抑制LC以及参与吗啡戒断与在VTA其他脑区具有相同的机制,即通过兴奋局部GABA神经元抑制NE能神经元活动,我们需要进一步的实验来验证这种假设。
本实验结果显示,选择性5-HT2CR激动剂WAY(0.5~1.0 mg·kg-1)腹腔注射对正常小鼠的自发活动没有明显的抑制作用。对吗啡依赖小鼠自发活动有明显抑制,对纳洛酮催促出现的小鼠吗啡戒断症状也有明显的抑制作用。5-HT2CR激动剂WAY(0.5、0.75、1.0 mg·kg-1,i.p.)剂量以及阳性对照药可乐定(0.2 mg·kg-1,i.p.)能明显降低纳洛酮催促出现的小鼠吗啡依赖戒断症状。本研究旨在探讨5-HT2CR激动剂在吗啡依赖防治中的作用及其可能作用机制。5-HT2CR信号传递有望成为揭示抑制阿片类物质成瘾和戒断反应发生的一种新机制,也将为抑制阿片类物质成瘾防治提供药物作用新靶点。
[1]Muller C P,Homberg J R.The role of serotonin in drug use and addiction[J].Behav Brain Res,2014,277:146 -92.
[2]Hannon J,Hoyer D.Molecular biology of 5-HT receptors[J].Behav Brain Res,2008,195(1):198 -213.
[3]Muller C P,Carey R J.Intracellular 5-HT 2C-receptor dephosphorylation:a new target for treating drug addiction[J].Trends Pharmacol Sci,2006,27(9):455 -8.
[4]eL-Kadi A O,Sharif S I.The role of histagminergic-noradrenergic axis naloxone-induced withdrawal symptoms in mice[J].Pharmacol Biochem Behav,1996,55(1):49 -54.
[5]郑久明,张 迪,刘新宇,刘春娜.神经肽urocortinⅡ对吗啡成瘾大鼠中脑腹侧被盖区神经元自发放电的影响[J].中国药理学通报,2014,30(5):735-6.
[5]Zheng J M,Zhang D,Liu X Y,Liu C N.Effects of neuropeptide urocortinⅡon spontaneous discharge of ventral tegmental area in morphine-addicted rats[J].Chin Pharmacol Bull,2014,30(5):735-6.
[6]马洪波,姜艳霞,雷钧涛.茉莉花根提取物对吗啡依赖性小鼠戒断作用的研究[J].时珍国医国药,2009,20(5):1084-5.
[6]Ma H B,Jiang Y X,Lei J T.Study the effects of radix jasmini sambac extract on withdrawal syndrome in morphine-dependent mice[J].Lishizhen Med Materia Med Res,2009,20(5):1084 -5.
[7]王 聪,肖 怀,王立云,等.紫金龙总提取物对吗啡依赖小鼠戒断症状的影响[J].安徽农业科学,2011,39(16):9594-5.
[7]Wang C,Xiao H,Wang L Y,et al.Effects of total extract of dactyicapnos scandens hutch on withdrawal syndrome in morphinedependent mice[J].J Anhui Agri,2011,39(16):9594 -5.
[8]刘 屏,陈世铭,陈慧英,吴树荣.钙拮抗剂、抗胆碱药对吗啡依赖小鼠催促戒断症状的治疗作用[J].中国药物依赖性杂志,1996,5(1):16 -8.
[8]Liu P,Chen S M,Chen H Y,Wu S R.Effects of calcium channel inhibitors and ant cholinergic drugs on the withdrawal syndromes in mice precipitated by naloxone[J].Chin Bull Drug Depend,1996,5(1):16-8.
[9]eL-Kadi A O,Sharif S I.The role of dopamine in the expression of morphine withdrawal[J].General Pharmacol,1998,30(4):499-505.
[10]Nestler E J.Historical review:Molecular and cellular mechanisms of opiate and cocaine addiction[J].Trends Pharmacol Sci,2004,25(4):210-8.
[11]David V,Cazala P.Anatomical and pharmacological specificity of the rewarding effect elicited by microinjections of morphine into the nucleus accumbens of mice.[J].Psychopharmacology(Berl),2000,150(1):24-34.
[12]李 锦,曹丹旎,吴 宁,等.抗阿片成瘾药物研究历史与现状[J].中国药理学与毒理学杂志,2012,26(3):255 -62.
[12]Li J,Cao D N,Wu N,et al.History and present situation of research and development of anti-opioid addiction drugs[J].Chin J Pharmacol Toxicol,2012,26(3):255 -62.
[13]Di Matteo V,Di Giovanni G,Di Mascio M,Esposito E.SB 242084,a selective serotonin2C receptor antagonist,increases dopaminergic transmission in the mesolimbic system [J].Neuropharmacology,1999,38(8):1195 -205.
[14]Prisco S,Pagannone S,Esposito E.Serotonin-dopamine interaction in the rat ventral tegmental area:an electrophysiological studyin vivo[J].J Pharmacol Exp Ther,1994,271(1):83 -90.
[15]eL-Kadi A O,Sharif S I.The role of 5-HT in the expression of morphine withdrawal in mice[J].Life Sci,1995,57(5):511 -6.
[16]Laorden M L,Fuertes G,González-Cuello A,Milanés M V.Changes in catecholaminergic pathways innervating paraventricular nucleus and pituitary-adrenal axis response during morphine dependence:implication of alpha(1)-and alpha(2)-adrenoceptors[J].J Pharmacol Exp Ther,2000,293:578 -84.
[17]Millan M J,Dekeyne A,Gobert A.Serotonin(5-HT)2C receptors tonically inhibit dopamine(DA)and noradrenaline(NA),but not 5-HT,release in the frontal cortexin vivo[J].Neuropharmacology,1998,37(7):953 -5.
[18]Gobert A,Rivet J M,Lejeune F,et al.Serotonin(2C)receptors tonically suppress the activity of mesocortical dopaminergic and adrenergic,but not serotonergic,pathways:a combined dialysis and electrophysiological analysis in the rat[J].Synapse,2000,36(3):205-21.

