胶质瘤干祖细胞分化与自噬的相关性研究*
魏子龙,赵耀东,黄 强,任 力△,沙龙贵
1.上海市浦东医院 神经外科(上海 201300);2.上海市第一人民医院 神经外科(上海 200080);3.苏州大学附属第二医院 神经外科(苏州 215004)
肿瘤干细胞理论认为,肿瘤是由肿瘤中为数不多的肿瘤干细胞增殖、发育所致。胶质瘤干祖细胞(GSPCs)又称胶质瘤始动细胞,在体内外均具有无限增殖能力[1]。神经干细胞(NSCs)能自发且完全分化为胶质细胞及神经元,而GSPCs不能,甚至在诱导分化过程中出现可逆分化[2]。目前,关于NSCs与GSPCs分化差异及分子机制的研究多见,而GSPCs分化与自噬关系的研究少见。自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,通过与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,以此实现某些细胞器的更新与细胞本身的代谢需要[3]。研究[4-5]表明,细胞分化及发育与自噬具有一定相关性。本实验通过观察GSPCs诱导分化前后自噬活性的变化,探讨GSPCs分化与自噬的相关性。
1 材料与方法
1.1 材料
1.1.1 细胞来源 GSPCs株由苏州大学附属第二医院神经外科黄强教授实验室建立,长期体外传代并由该实验室保存。GSPCs取自新鲜胶质瘤手术标本(52岁女性患者自愿捐赠),经分离、体外培养、鉴定及扩增保存。
1.1.2 试剂与仪器 1)主要试剂:DMEM/F12无血清培养基(体积比1∶1),1/100N2添加剂和20 ng/mL(终浓度)碱性成纤维细胞生长因子(bFGF,美国Gibco公司),20ng/mL(终浓度)表皮生长因子(EGF,美国Invitrogen公司),微管相关蛋白轻链3(LC3)抗体(美国 MBL公司),beclin-1抗体(美国Santa Cruze公司),胶质纤维酸性蛋白(GFAP)抗体、微管相关蛋白-2(MAP-2)抗体及β-actin抗体(德国Sigma公司),免疫组织化学试剂盒[含辣根过氧化物酶标记的羊抗兔(或羊抗鼠)IgG二抗(1∶2 500)]及DAB显色试剂盒(上海科兴生物公司),3-甲基腺嘌呤(3-MA,德国Sigma公司),BCA 蛋白定量试剂盒(美国Piece公司),雷帕霉素(RPM,上海齐奥化工科技有限公司);2)主要实验仪器:SDSPAGE凝胶电泳仪(美国Bio-Rad公司),精确度为1μm的Nikon Eclipse TE2000-U型倒置荧光显微镜(日本Nikon公司),精确度为0.1μm 的TCSSP2型共聚焦显微镜(德国Leica公司),点分辨精确度为0.24nm、线分辨精确度为0.10nm 的JEOL-1230型透射电子显微镜(日本电子株式会社)。
1.2 方法
1.2.1 GSPCs自噬活性检测 将GSPCs分为两组,分别培养于干细胞培养基和诱导分化培养基(含10%胎牛血清的DMEM/F12)中,隔天更换1次培养基,7d后终止培养。取两组细胞用于免疫染色、透射电镜标本制备及Western blot检测,实验重复3次。
1.2.2 GSPCs诱导分化 GSPCs培养于诱导分化的培养基(含10%胎牛血清的DMEM/F12)中,并分为两组。实验组加入终浓度为0.01mmol/L的自噬抑制剂3-MA;对照组不添加,培养基隔天更换1次,7d后终止培养。随机选取3个视野,每个视野至少包含100个细胞,细胞分化比例根据倒置相差显微镜下细胞突起伸长情况进行计算,以(±s,n=3)表示。同时行免疫染色,并检测GFAP、MAP-2、beclin-1表达,实验重复3次。
1.2.3 GSPCs未诱导和诱导分化下自噬激活剂RPM的使用 无血清条件下培养部分GSPCs,加入不同浓度RPM(0.2μg/mL~12.5ng/mL),24、48h后观察细胞形态的变化,并比较与未加RPM组细胞形态的异同;另一部分培养于含3%胎牛血清DMEM/F12的GSPCs,加入0.2μg/mL~12.5 ng/mL不同浓度RPM,24h后观察细胞形态的变化,并与未加RPM组比较细胞形态的异同。随机选取3个视野,每个视野至少包含100个细胞,细胞分化比例=倒置相差显微镜下有细胞突起的细胞/该视野下的细胞总数(包括有突起的细胞和无突起的细胞)×100%,以(±s,n=3)表示。
1.2.4 免疫细胞化学法检测LC3表达 诱导分化后,将种植于预铺多聚赖氨酸玻片上的GSPCs,在分化培养基中继续培养2h,固定于玻片表面后弃除培养基,PBS冲洗两次,5min/次;按1∶1比例(甲醇/乙醇)配制固定液,固定20min,PBS冲洗两次,5min/次,采用0.1%Triton-X100孵育10min后,再用PBS冲洗两次,5min/次;采用1%BSA封闭液孵育1h,PBS冲洗两次,5min/次;加入适量一抗,4℃孵育过夜,PBS冲洗3次,5min/次;加入Cy3耦联二抗,避光孵育2h,PBS冲洗3次,5min/次;0.5μg/mL DAPI孵育10min后梯度乙醇脱水,自然风干,于共聚焦显微镜下观察。
1.2.5 Western blot检测相关基因表达 GSPCs均以1mL PBS混匀,以离心半径5.5cm,转速2 000r/min,离心5min,弃上清,按1∶5比例加入聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液混匀,煮沸10min,凝胶电泳;将分离胶上蛋白质转移至硝酸纤维(NC)膜,5%脱脂奶粉封闭1h后滴加一抗,37℃孵育1.5h,TBST缓冲液洗膜3次,5min/次;加入IgG二抗(1∶2 500)室温孵育1h,TBST缓冲液洗膜3次,5min/次,化学发光法显影。根据目的基因条带密度值,半定量计算相关基因表达丰度。
1.2.6 透射电镜标本制备 采用0.1mol/L戊二醛溶液将待测GSPCs 4℃固定2h,PBS冲洗,1%锇酸固定30min后梯度乙醇脱水,醋酸铀70%丙酮饱和溶液脱水过夜,环氧树脂包埋、固化,钻石刀切割制作组织切片,镍网收集后,柠檬酸铅染色8min后观察自噬小体。
1.3 统计学方法
采用SPSS 17.0软件进行统计处理,定量资料比较采用t检验,以均数±标准差(±s)表示。检验水准α设定为0.05。
2 结果
2.1 GSPCs自噬活性检测结果
荧光显微镜显示,无血清干细胞培养基中生长的GSPCs内未见荧光强度高的斑点状结构(图1A)。GSPCs在含血清条件下培养7d后贴壁分化,细胞呈梭形或星形伸出突起样结构,显微镜下可见“突起”近端胞质区有小泡样结构,免疫染色示相应部位LC3呈点样分布(图1B);透射电镜下可见GSPCs分化细胞内存在典型的自噬小体(图1C)。Western blot检测LC3发现,诱导分化后GSPCs中LC3-Ⅱ/LC3-Ⅰ较分化前显著增加(图1D)。

图1 GSPCs自噬活性检测结果
2.2 3-MA对GSPCs诱导分化及自噬活性的作用
对照组贴壁分化为梭形或星形细胞(图2A),实验组贴壁减少(图2B),定量计数表明实验组分化比例显著低于对照组(图2C)。Western blot检测发现,实验组GFAP、MAP-2蛋白表达量均显著降低(图2D和图2E)。
Western blot检测发现,实验组beclin-1表达量显著低于对照组(图2F)。免疫细胞化学染色示,对照组胞浆内可见较多LC3阳性点状结构(图2G);实验组罕见LC3阳性点状结构(图2H)。
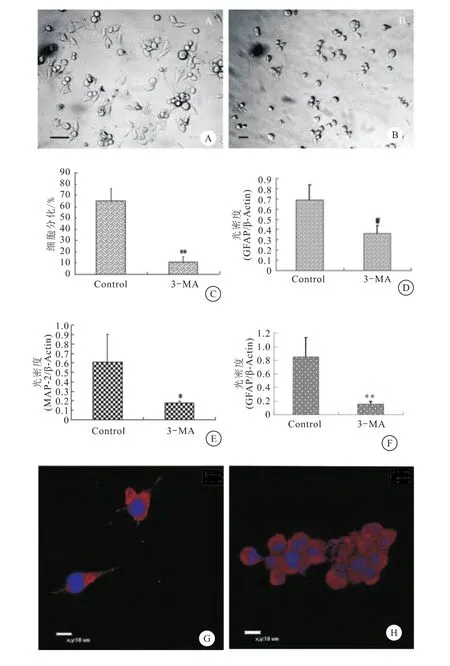
图2 3-MA对GSPCs诱导分化及自噬活性的作用
2.3 自噬激活剂RPM对GSPCs分化状态的影响
RPM浓度及作用时间对无血清条件下培养的GSPCs形态学影响不明显,而12.5ng/mL RPM能显著增加含血清条件下培养的GSPCs贴壁分化细胞(图3)。
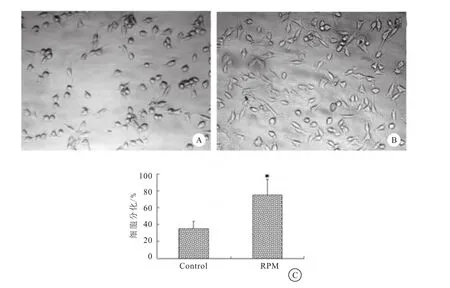
图3 自噬激活剂RPM对GSPCs分化状态的影响
3 讨论
肿瘤干细胞理论认为,肿瘤的生长及转移能力主要来源于肿瘤细胞中的一些细胞,即癌干细胞(CSCs)。目前,CSCs已在多种肿瘤组织中被证实。本研究亦从1例胶质瘤组织中成功获得GSPCs。一般而言,CSCs只能分化为具有亲本表型的癌细胞,而GSPCs只能分化为不成熟的神经元或胶质细胞。由于GSPCs具有自我更新及不能成熟分化的特征,导致肿瘤复发及对放化疗的阻抗[6]。研究已表明,自噬在多种细胞分化中具有重要作用[7-8]。LC3是自噬小体的特异性标志分子[9],以LC3-Ⅰ和LC3-Ⅱ两种分子存在,且两者比例与自噬小体数量有关。本实验中在无血清干细胞培养基中生长的GSPCs,经免疫细胞化学法检测示LC3呈阴性,表明其自噬活性低。GSPCs在含血清条件下培养7d后贴壁分化,免疫细胞化学染色示LC3呈点样分布;透射电镜下可见GSPCs分化细胞内存在典型自噬小体;Western blot检测LC3发现,诱导分化后GSPCs中LC3-Ⅱ/LC3-Ⅰ较分化前显著增加,表明GSPCs自噬活性显著增加,提示GSPCs在未分化状态下自噬活性低,诱导分化后自噬活性显著增加。
GFAP和 MAP-2表达量越高,说明细胞分化越成熟。beclin-1是自噬所必须的抑癌基因[10],其表达量降低提示自噬活性低下。本实验结果显示,实验组较对照组细胞贴壁减少,分化比例降低;免疫细胞化学染色示胞浆内罕见LC3阳性表达;Western blot检测证实,实验组GFAP、MAP-2及beclin-1表达量均显著降低,表明GSPCs诱导分化时,加入自噬抑制剂3-MA能抑制GSPCs诱导分化过程中原本增强的自噬活性,从而抑制GSPCs分化,提示自噬活性低可抑制GSPCs分化。此外,本实验还利用自噬激活剂RPM在无血清条件下作用于GSPCs,结果显示RPM浓度及作用时间对无血清条件下培养的GSPCs形态学无显著影响,与Zeng等[11]研究结果一致。GSPCs在含血清条件下培养时,适当浓度的RPM可促进其贴壁分化。为防止高浓度血清(10%)明显诱导GSPCs的分化,本实验将GSPCs培养于含3%胎牛血清的培养液中,24h后发现,在含3%胎牛血清条件下,无论是否有RPM,GSPCs均可贴壁分化,但RPM 存在时,GSPCs分化更明显,说明增强GSPCs自噬活性可提高其分化比例。
综上所述,GSPCs分化与其自噬活性密切相关。诱导分化后,GSPCs自噬活性增高,增强GSPCs自噬活性可促进分化,抑制其自噬活性可抑制分化,与Nabissi等[12]研究结果一致。
本研究提示,至少在部分肿瘤干细胞中自噬活性低下是其分化抑制的一种原因,这为抗肿瘤治疗提供了一种思路,在应用放化疗手段的同时可加用自噬活剂,通过增强其自噬活性而促进肿瘤细胞进一步分化成熟,减轻其恶性程度及对放化疗的阻抗,从而提高肿瘤治疗的疗效。
[1]Wang Z,Fei X,Dai X,et al.Differentiation of glioma stem cells and progenitor cells into local host cell-like cells:a study based on choroidcarcinoma differentiation of choroid plexus of GFP transgenic nude mouse[J].Cancer Biother Radiopharm,2015,30(5):225-232.
[2]Yamamuro S,Okamoto Y,Sano E,et al.Characterization of glioma stem-like cells from human glioblastomas[J].Int J Oncol,2015,47(1):91-96.
[3]Calabrese C,Poppleton H,Kocak M,et al.A perivascular niche for brain tumor stem cells[J].Cancer Cell,2007,11(1):69-82.
[4]Yuan J,Yu M,Li HH,et al.Autophagy contributes to IL-17-induced plasma cell differentiation in experimental autoimmune myocarditis[J].Int Immunopharmacol,2014,18(1):98-105.
[5]Orfali N,O′Donovan TR,Nyhan MJ,et al.Induction of autophagy is a key component of all-trans-retinoic acidinduced differentiation in leukemia cells and a potential target for pharmacologic modulation[J].Exp Hematol,2015,43(9):781-793.
[6]龚海东,张哲男,胡永珍,等.miR-155与胶质瘤的研究进展[J].现代生物医学进展,2013,13(35):6994-6997.
[7]蒋卉男,胡荣,刘卓刚,等.自噬与白血病治疗研究最新进展[J].中国实验血液学杂志,2015,23(1):290-294.
[8]朱朋飞,秦建民.细胞自噬在原发性肝癌发生与防治中的生物学作用[J].中国医药科学,2015,5(4):24-28.
[9]Kanzawa T,Germano IM,Komata T,et al.Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells[J].Cell Death Differ,2004,11(4):448-457.
[10]Wang RC,Wei Y,An Z,et al.Akt-mediated regulation of autophagy and tumorigenesis through beclin 1 phosphorylation[J].Science,2012,338(6109):956-959.
[11]Zeng M,Zhou JN.Roles of autophagy and mTOR signaling in neuronal differentiation of mouse neuroblastoma cells[J].Cell Signal,2008,20(4):659-665.
[12]Nabissi M,Morelli MB,Amantini C,et al.Cannabidiol stimulates Aml-1a-dependent glial differentiation and inhibits glioma stem-like cells proliferation by inducing autophagy in a TRPV2-dependent manner[J].Int J Cancer,2015,137(8):1855-1869.

