蛋白质精氨酸甲基转移酶6调控前列腺癌发生的分子机制*
徐 莹,阎 英,柳云恩
1.沈阳军区总医院 放射治疗科(沈阳 110840);2.沈阳军区总医院 急诊医学部,全军重症战创伤救治中心实验室(沈阳 110840)
前列腺癌(prostate cancer,PCa)是世界常见恶性肿瘤之一,多见于欧美等国家[1-2]。雄激素受体(androgen receptor,AR)作为核受体超家族蛋白成员,是一种配体依赖的转录因子,其结构主要包括转录激活功能域 1(activation function 1,AF-1)及AF-2。AF-1不依赖于配体的结合,AF-2需要同源配体结合,通过招募大多数的 AR辅助因子[3-4],参与蛋白质和蛋白质间的相互作用。当AR与配体(如雄激素)结合后,AR与其分子伴侣解离,从细胞质转运至细胞核,同时招募特定的转录辅助调节因子形成复合物[5],结合到靶基因的反应元件上,通过改变染色体结构调节基因转录[6-7]。 研究[8-9]发现,AR在PCa的发生发展中发挥着至关重要的作用,它通过调控AR下游PCa相关基因的转录,促进PCa的发生发展。迄今为止,研究发现大量的AR辅助调控因子,如 p68[10]、LSD1[11]、RNF6[12]、ARD1[13]、JARID1B[14]和 FLH2[15]等,在 PCa中过表达,并促进癌症细胞的增殖。因此,研究AR活性调控的分子机制对于PCa的治疗具有重要意义。
蛋白质精氨酸甲基转移酶(protein arginine methyltransferases,PRMTs)家族具有催化精氨酸甲基化的作用,其功能取决于底物特异性及其亚细胞定位[16]。PRMTs根据其催化甲基化的类型可以分为3类,蛋白质精氨酸甲基转移酶6(protein arginine methyltransferase 6,PRMT6)属于Ⅰ类,催化酶胍基氮的精氨酸残基甲基化[17-18]。研究[19]发现,PRMT6可以抑制肿瘤抑制基因p53的转录表达。细胞周期蛋白依赖性激酶(the cyclindependent kinase,CDK)的抑制基因 p21 是PRMT6重要的直接下游靶基因,通过抑制p21从而促进细胞增殖和抑制细胞衰老。PRMT6基因敲除可以使细胞周期停滞,提示PRMT6在细胞周期调控中也起重要作用[20]。p21是多种肿瘤抑制基因和癌基因的下游基因,它参与了乳腺癌[21-22]、骨肉瘤[18]和肝癌[23]等肿瘤的发生发展。
目前,PRMT6是AR的一种辅助激活因子,它不仅可以激活正常表达的AR,也可以显著激活突变的AR。PRMT6的类固醇受体基序可以与AR的AF-2相互作用,从而起到激活作用[24]。然而,PRMT6调控PCa发生发展的分子机制尚不清楚。因此,本研究旨在探讨PRMT6在PCa细胞中的作用及调控机制,为PCa的诊断及治疗提供新的靶点。
1 材料与方法
1.1 前列腺增生(BPH)和PCa的免疫组织化学分析
福尔马林固定石蜡包埋的BPH和PCa的病理切片来源于沈阳军区总医院。数据采集及组织应用研究通过人体伦理研究委员会批准。实验共有100例组织,其中BPH标本50例,PCa组织标本50例。对所有组织行免疫组织化学染色,检测标本PRMT6的表达水平。抗鼠的多克隆抗体PRMT6(santa,sc-271744,1∶100)、亲和素生物素标记的第2抗体及碱性磷酸酶标记的链霉素工作液孵育,DAB显色后,核用苏木精复染。
1.2 细胞培养
CWR22Rv1、LNCaP、DU145和 VCaP细胞(购自沈阳汇佰生物科技有限公司)维持在RPMI1640(GIBCO-BRL)培养基中。PC3细胞维持在F12培养基中。所有细胞培养基含有10%胎牛血清(FBS)、2mmol/L谷氨酰胺、100U/mL链霉素和青霉素。细胞于37℃,5%CO2培养箱培养。
1.3 质粒、siRNA转染
PRMT6(ID:55170)表达质粒及siRNA由沈阳汇佰生物科技有限公司制作,体外转染CWR22Rv1和LNCaP细胞利用LipofectamineTM 2000(Invitrogen)试剂盒,具体步骤请参照试剂说明书。
1.4 Real Time PCR
总RNA 提取应用Trizol试剂(Invitrogen)。反转录使用Super-ScriptⅡ(Invitrogen),cDNAs通过Real Time PCR量化使用SYBR Premix Ex Taq(TaKaRa)和 aMx3000Pinstrument(Agilent StrataGene)仪器。PSA和KLKZ基因表达分析采用Stratagene Mx3000P软件。
1.5 Western blot检测
实验蛋白样品加入相应比例的SDS凝胶上样缓冲液(6×Loading Buffer),煮沸变性5min,SDSPAGE电泳,转膜,然后将膜移至5% 的脱脂奶粉PBST缓冲液室温封闭1h,PBST洗膜3次。加入一抗 PRMT6(santa,sc-271744,1∶2 000)和 GAPDH(santa,sc-365062,1∶4 000),4 ℃ 孵育过夜。用PBST洗膜3次,加辣根过氧化物酶标记的抗鼠二抗,室温孵育1h。洗膜3次,ECL显影。
1.6 绘制细胞生长曲线和细胞增殖
分别接种22Rv1和LNCaP于12孔板中,每孔约5万个细胞分别转染siPRMT6及对照siRNA,DHT处理及不处理。于0、24、48、72、96、120h时进行细胞计数,绘制细胞生长曲线。分别接种22Rv1和LNCaP于6孔板中,每孔约5万个细胞分别转染siPRMT6及对照siRNA,DHT处理及不处理后5d,多聚甲醛固定,锥虫蓝染色,照相。
1.7 Transwell小室培养
22Rv1和LNCaP细胞分别转染siPRMT6及对照siRNA后,撤血清饥饿12~24h。接种5万个细胞于Transwell小室。加入500μL含FBS或趋化因子的培养基。培养48h后,95%乙醇固定10 min,锥虫蓝染色,棉签擦去小室上室内多余的细胞,照相。
1.8 流式细胞技术
22Rv1和LNCaP分别转染siPRMT6及对照siRNA,DHT处理及不处理24h后,胰酶消化,制成单细胞悬液,75%乙醇固定,IP染液染色,37℃孵育1h,上机检测。
1.9 统计学方法
采用SPSS 19.0统计学软件进行分析,根据资料的分布特征,分别选择χ2检验、mann-whitney U和方差分析方法进行比较,所有统计检验均为双侧概率检验。检验水准α设定为0.05。
2 结果
2.1 PRMT6在PCa中高表达
结果发现,PRMT6在PCa中高表达,而在BPH中表达较低,对PRMT6的表达情况评分并进行统计学分析,差异有统计学意义(P<0.05)。此外,采用Western blot检测PRMT6在5种PCa细胞系中的表达,结果发现,PRMT6均有表达(图1)。
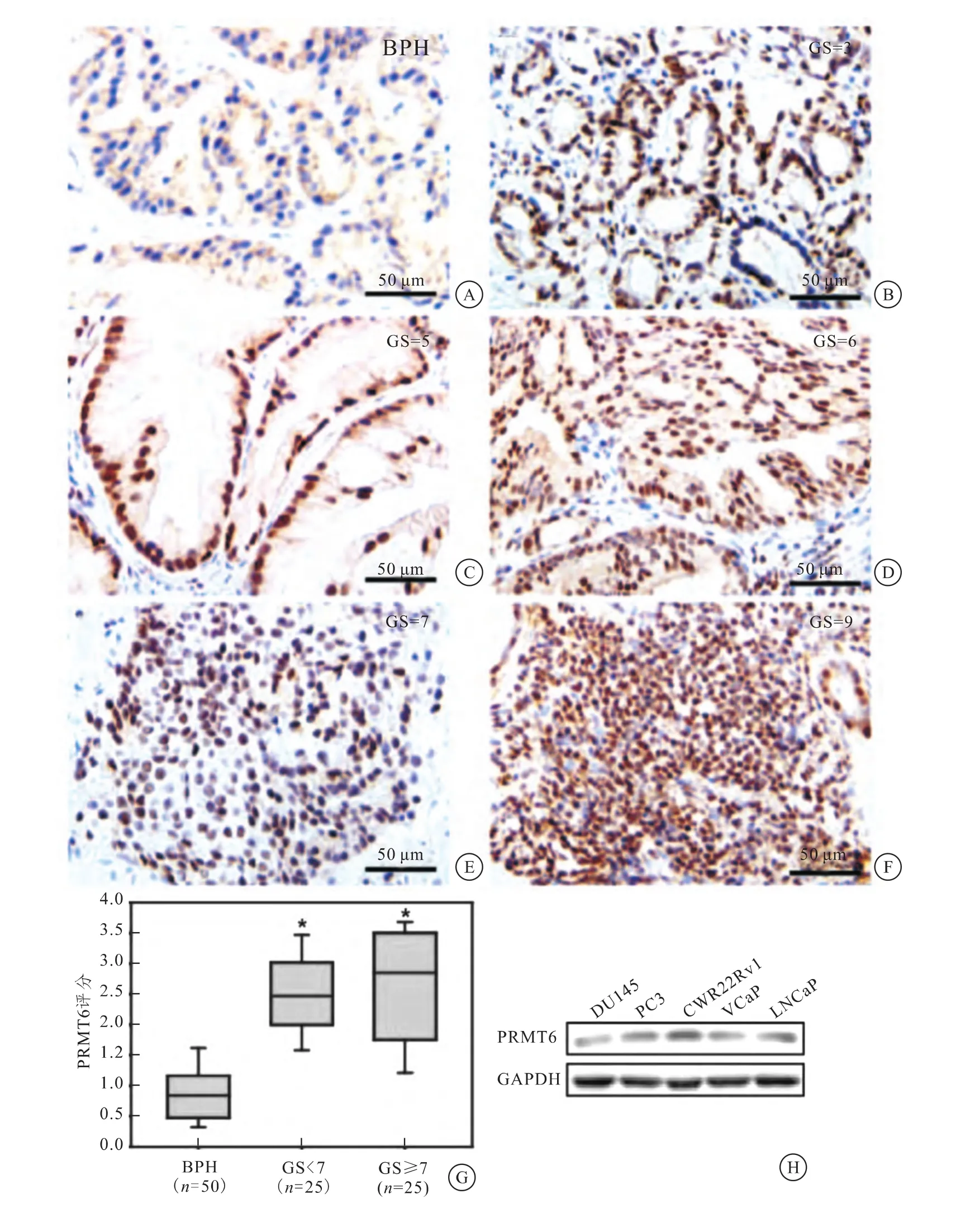
图1 PRMT6在PCa中高表达
2.2 PRMT6促进AR下游靶基因PSA和KLK2的转录
本研究定制了1种PRMT6的表达质粒及3种PRMT6的siRNA,结果发现,PRMT6过表达促进PSA和KLK2的转录,而敲除PRMT6后PSA和KLK2的转录水平降低(图2)。

图2 PRMT6促进AR下游靶基因PSA和KLK2的转录
2.3 PRMT6促进PCa细胞的增殖
结果发现,与对照组相比,PRMT6基因敲除可显著减少PCa22Rv1和LNCaP细胞增殖。同时,通过将PRMT6基因敲除后分别转染到22Rv1和LNCaP细胞后,发现PRMT6基因敲除明显抑制细胞的增殖(图3)。
2.4 PRMT6促进PCa细胞周期的进程
利用流式细胞技术研究PRMT6对PCa细胞周期的影响,结果显示,敲除PRMT6后22Rv1和LNCaP细胞停滞在G1期的细胞明显增多(图4)。
2.5 PRMT6促进PCa细胞的迁移
通过Transwell小室实验研究PRMT6对PCa细胞迁移的影响,结果发现,敲除PRMT6后,22Rv1和LNCaP细胞的迁移率降低(图5)。
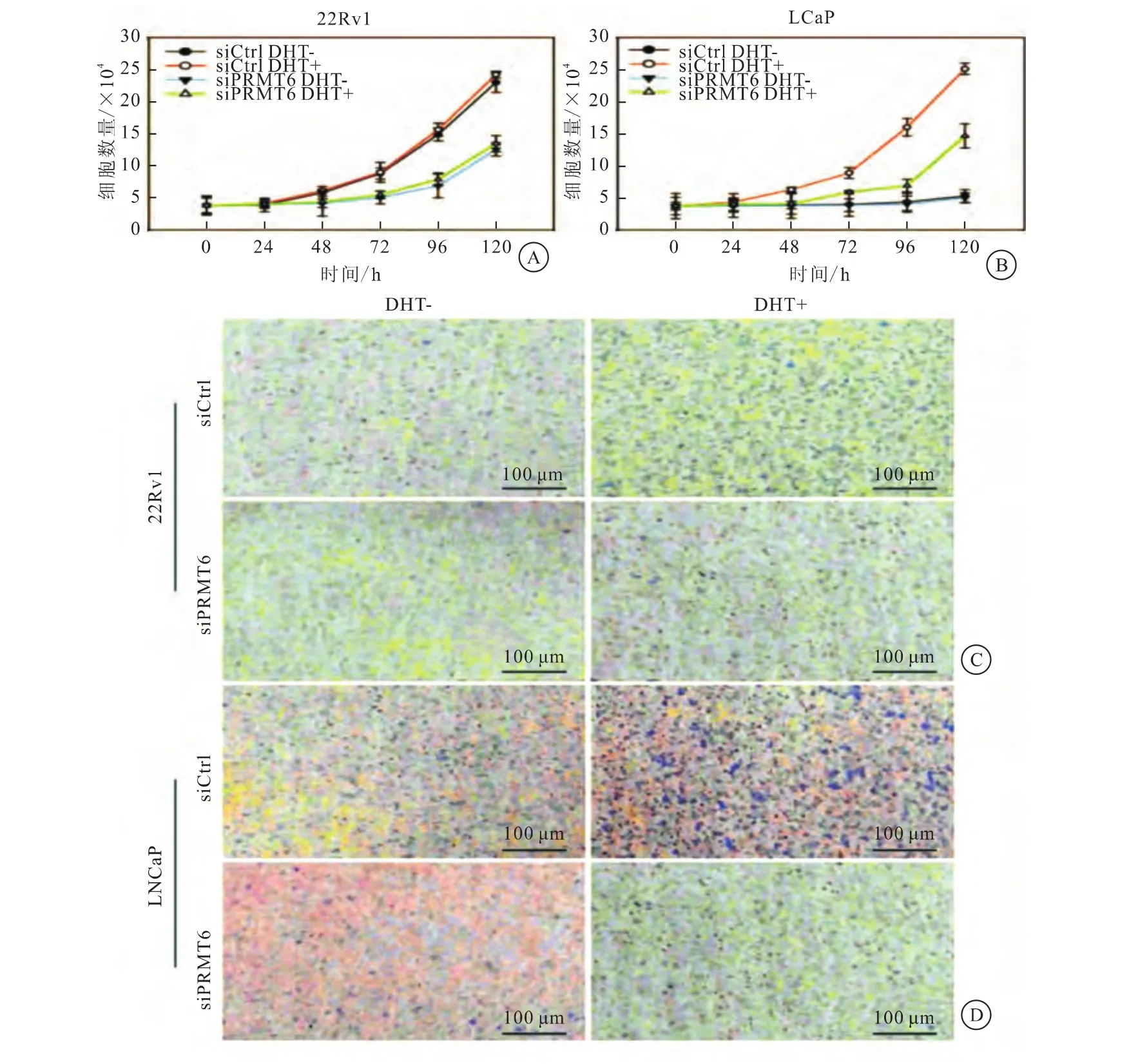
图3 PRMT6促进PCa细胞的增殖
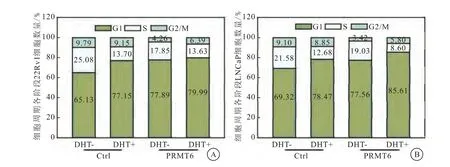
图4 PRMT6促进PCa细胞周期的进程
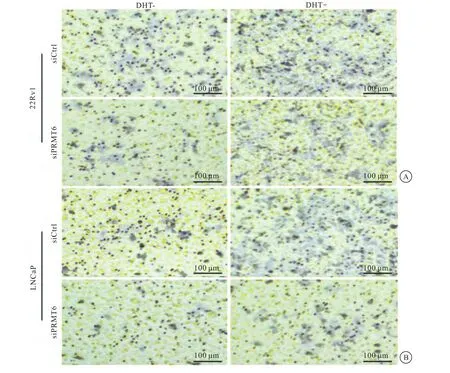
图5 PRMT6促进PCa细胞的迁移
3 讨论
PCa是欧美国家常见的恶性肿瘤之一,是男性致死的第2大癌症。中国PCa的发病率较低,但近年来有逐渐上升的趋势[25-26]。目前,PCa的治疗方法主要以内分泌治疗为主,但大多仅在早期有效,最终发展成趋势抵抗的PCa,难以治愈[27]。本研究发现,PRMT6在PCa中高表达,它通过促进AR下游靶基因PSA和KLK2的转录,调控PCa的进程。此外,PRMT6还促进PCa细胞增殖,加快细胞周期的进程和促进肿瘤细胞的迁移。
本研究通过免疫组织化学检测BPH和PCa患者的病理石蜡切片,发现PCa组织中PRMT6的表达水平明显高于BPH,同时通过Western blot技术检测5种PCa细胞系中PRMT6的表达情况,发现PRMT6在5种细胞系中均有表达,结果提示PRMT6在PCa中呈高表达。研究[24]证 实,PRMT6在多种癌症中具有生理功能,它是AR的一种辅助激活因子,可以与ARAF-2相互作用,激活AR。研究[28]发现,PCa组织中PRMT6表达水平显著高于正常的前列腺组织,它能较好地区分正常组织和肿瘤组织,本研究结果与其相似。结果提示,PRMT6作为AR的一种辅助激活因子,可能在PCa的发生发展进程中发挥着重要调控作用。然而,PRMT6调控PCa发生发展的分子机制,目前尚不清楚。
PCa发生发展与AR密切相关,AR是核受体超家族蛋白的成员之一,它在前列腺生长发育及生理功能方面起重要作用。AR表达和转录调控受其转录辅助调控因子的调节,一旦AR的转录辅助调控因子发生改变,会引起AR及其下游靶基因的表达异常,导致PCa和雄激素不敏感症等AR相关疾病。PRMT6是正常和突变AR的特异性辅助激活因子,其与AR相互作用在AR突变时显著增强,通过PRMT6类固醇受体相互作用区域LXXLL和AR激活功能2。AR的转录激活需要PRMT6的催化活性和Akt结构域精氨酸残基的甲基化参与[24]。本研究选取AR阳性激素非依赖的22Rv1细胞和AR阳性激素依赖的LNCaP细胞进行研究。通过将过表达及敲除PRMT6的siRNA转染至22Rv1和LNCaP细胞中,采用Real Time PCR研究PRMT6表达改变对AR下游促癌基因PSA和KLK2的转录影响,结果发现,PRMT6可以促进PSA和KLK2的转录,提示PRMT6可能通过调控AR下游靶基因的转录,从而促进PCa的发生发展。
本研究通过绘制细胞生长曲线、克隆实验、流式细胞技术和Transwell实验,研究PRMT6对22Rv1和LNCaP细胞增殖、细胞周期及迁移的影响,结果发现,PRMT6可以促进22Rv1和LNCaP的细胞增殖,调控细胞周期的进程,敲除PRMT6后细胞周期进程中主要作用于G1期,同时PRMT6可以促进22Rv1和LNCaP的迁移。研究[29]发现,p21是一种强效的细胞周期蛋白依赖性激酶抑制剂,在促进G1细胞周期阻滞和细胞衰老方面发挥重要作用。p21是多种肿瘤抑制基因和癌基因的下游靶基因,它在大多数的肿瘤包括乳腺癌中表达下调。PRMT6作为一种已知的转录辅助因子直接抑制p21启动子。PRMT6基因敲除导致乳腺癌细胞中p21抑制,同时导致细胞周期阻滞和细胞衰老。结果提示,PRMT6作为乳腺癌细胞中癌基因,因具有促进细胞生长和抑制衰老的特点,可以作为肿瘤治疗的潜在靶点。PELP1与PRMT6相互作用,并改变PRMT6的功能,抑制PRMT6,可以减轻PELP1介导的雌激素受体激活、细胞增殖和集落形成。PELP1与PRMT6被募集作为雌激素受体的靶基因,协同调节参与肿瘤形成的基因选择性剪接,结果提示,PELP1-PRMT6轴可能是乳腺癌治疗的潜在靶点。此外,研究[30]发现,PRMT6过表达抵消由野生型p16诱导的人肺腺癌细胞A549细胞周期阻滞在G1期,同时过表达的PRMT6能够与p16相互作用,导致p16-CDK4关联强度降低。此前文献[31]报道,在PRMT6过表达的乳腺癌 MCF7细胞系中,细胞生长率和集落形成能力明显滞后于正常对照组细胞,血小板反应蛋白-1(TSP-1)是一种有效天然的血管生成抑制剂,它在PRMT6过表达的乳腺癌细胞中明显上调,由PRMT6过表达导致的转移和侵袭的抑制可以通过特异性敲除TSP-1基因缓解,结果提示,PRMT6过表达与肿瘤细胞的运动和侵袭调节相关。
总之,PRMT6在PCa中高度表达并通过调节AR下游靶基因的表达促进PCa的发生发展,同时PRMT6可调控PCa细胞的细胞周期,促进细胞的增殖及迁移。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA:A cancer Journal for Clinicians,2011,61(2):69-90.
[2]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics[J].CA:A Cancer Journal for Clinicians,2015,65(2):87-108.
[3]Heinlein CA,Chang C. Androgen receptor(AR )coregulators:an overview[J].Endocrine Reviews,2002,23(2):175-200.
[4]Dehm SM,Tindall DJ.Molecular regulation of androgen action in prostate cancer[J].Journal of Cellular Biochemistry,2006,99(2):333-344.
[5]Perissi V,Aggarwal A,Glass CK,et al.A corepressor/coactivator exchange complex required for transcriptional activation by nuclear receptors and other regulated transcription factors[J].Cell,2004,116(4):511-526.
[6]Garcia-BI,Kwon YS,Telese F,et al.Histone methylationdependent mechanisms impose ligand dependency for gene activation by nuclear receptors[J].Cell,2007,128(3):505-518.
[7]Zhao Y,Lang G,Ito S,et al.A TFTC/STAGA module mediates histone H2Aand H2Bdeubiquitination,coactivates nuclear receptors,and counteracts heterochromatin silencing[J].Molecular Cell,2008,29(1):92-101.
[8]Xu K,Wu ZJ,Groner AC,et al.EZH2oncogenic activity in castration-resistant prostate cancer cells is Polycombindependent[J].Science,2012,338(6113):1465-1469.
[9]Yu J,Yu J,Mani RS,et al.An integrated network of androgen receptor,polycomb,and TMPRSS2-ERG gene fusions in prostate cancer progression[J].Cancer Cell,2010,17(5):443-454.
[10]Clark EL,Coulson A,Dalgliesh C,et al.The RNA helicase p68is a novel androgen receptor coactivator involved in splicing and is overexpressed in prostate cancer[J].Cancer Research,2008,68(19):7938-7946.
[11]Metzger E,Wissmann M,Yin N,et al.LSD1demethylates repressive histone marks to promote androgen-receptordependent transcription[J].Nature,2005,437(7057):436-439.
[12]Xu K,Shimelis H,Linn DE,et al.Regulation of androgen receptor transcriptional activity and specificity by RNF6-induced ubiquitination[J].Cancer Cell,2009,15(4):270-282.
[13]Wang Z,Guo J,Li Y,et al.Inactivation of androgen-induced regulator ARD1inhibits androgen receptor acetylation and prostate tumorigenesis[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(8):3053-3058.
[14]Xiang Y,Zhu Z,Han G,et al.JARID1Bis a histone H3lysine 4demethylase up-regulated in prostate cancer[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(49):19226-19231.
[15]Kahl P,Gullotti L,Heukamp LC,et al.Androgen receptor coactivators lysine-specific histone demethylase 1and four and a half LIM domain protein 2predict risk of prostate cancer recurrence[J].Cancer Research,2006,66(23):11341-11347.
[16]Di Lorenzo A,Bedford MT.Histone arginine methylation[J].FEBS Letters,2011,585(13):2024-2031.
[17]Di Lorenzo A,Yang Y,Macaluso M.A gain-of-function mouse model identifies PRMT6as a NF-kappaB coactivator[J].Nucleic Acids Research,2014,42(13):8297-8309.
[18]Kleinschmidt MA,de Graaf P,van Teeffelen HA.Cell cycle regulation by the PRMT6arginine methyltransferase through repression of cyclin-dependent kinase inhibitors[J].PloS One,2012,7(8):41446.
[19]Neault M,Mallette FA,Vogel G,et al.Ablation of PRMT6 reveals a role as a negative transcriptional regulator of the p53 tumor suppressor[J].Nucleic Acids Research,2012,40(19):9513-9521.
[20]Stein C,Riedl S,Ruthnick D,et al.The arginine methyltransferase PRMT6regulates cell proliferation and senescence through transcriptional repression of tumor suppressor genes[J].Nucleic Acids Research,2012,40(19):9522-9533.
[21]Sun Y,Chung HH,Woo AR,et al.Protein arginine methyltransferase 6enhances ligand-dependent and -independent activity of estrogen receptor alpha via distinct mechanisms[J].Biochimica Biophysica Acta,2014,1843(9):2067-2078.
[22]Mann M,Zou Y,Chen Y,et al.PELP1oncogenic functions involve alternative splicing via PRMT6 [J].Molecular Oncology,2014,8(2):389-400.
[23]Meerzaman DM,Yan C,Chen QR,et al.Genome-wide transcriptional sequencing identifies novel mutations in metabolic genes in human hepatocellular carcinoma[J].Cancer Genomics &Proteomics,2014,11(1):1-12.
[24]Scaramuzzino C,Casci I,Parodi S,et al.Protein arginine methyltransferase 6enhances polyglutamine-expanded androgen receptor function and toxicity in spinal and bulbar muscular atrophy[J].Neuron,2015,85(1):88-100.
[25]Lee MM,Wang RT,Hsing AW,et al.Case-control study of diet and prostate cancer in China[J].Cancer Causes &Control,1998,9(6):545-52.
[26]Li XM,Li J,Tsuji I,et al.Mass screening-based case-control study of diet and prostate cancer in Changchun,China[J].Asian Journal of Andrology,2008,10(4):551-560.
[27]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA:A Cancer Journal for Clinicians,2011,61(4):212-236.
[28]Vieira FQ,Costa-PP,Pereira A,et al.Deregulated expression of selected histone methylases and demethylases in prostate carcinoma[J].Endocrine-Related Cancer,2014,21(1):51-61.
[29]Phalke S,Mzoughi S,Bezzi M,et al.p53-Independent regulation of p21Waf1/Cip1expression and senescence by PRMT6[J].Nucleic Acids Research,2012,40(19):9534-9542.
[30]Wang X,Huang Y,Zhao J,et al.Suppression of PRMT6-mediated arginine methylation of p16protein potentiates its ability to arrest A549cell proliferation[J].The International Journal of Biochemistry & Cell Biology,2012,44(12):2333-2341.
[31]Kim NH,Kim SN,Seo DW,et al.PRMT6overexpression upregulates TSP-1and downregulates MMPs:its implication in motility and invasion[J].Biochemical and Biophysical Research Communications,2013,432(1):60-65.

