GLI1和MMP9在胰腺癌中的表达及其临床意义的研究
大连医科大学第二临床学院(116044)陈文政 刘国才 臧 辉 迟海波
辽宁省人民医院普外科 柳青峰*
中国医科大学附属第一医院胃肠外科 盛伟伟
近年来胰腺癌的发病率逐年上升,美国癌症协会在2014年发布的癌症统计数据显示,2014年全美新增46 420例罹患胰腺癌,其中有39 590例当年死于该疾病,病死率高达85.29%。其发病率在恶性肿瘤中位居第10位,病死率列第4位[1]。根据全国肿瘤防治研究办公室发表的统计数据,我国胰腺癌发病率和病死率均比世界平均水平要高[2]。胰腺癌的发病机制极其复杂,并且缺乏特异性的临床症状和早期诊断试验,容易发生胰周侵袭和远处脏器转移,进展迅速,恶性程度高,预后差,5年生存率不足5.00%。
胶质瘤相关癌基因1(GLI1)是Hedgehog信号通路中最关键的信号分子,是Shh信号通路激活的标记基因[3],能够激活下游基因转录和翻译[4]。近年来相关研究表明,多种恶性肿瘤的发生、发展都和Hedgehog信号传导通路的突变和异常活化有关。在胰腺癌发病过程中,基质金属蛋白酶-9(MMP9)既能降解基底膜和细胞外基质,又能使组织结构发生重塑并且能够诱导肿瘤新生血管形成而导致胰腺癌的发生、发展、侵袭和转移[5]。本研究采用免疫组织化学SP法检测48例原发性胰腺癌和11例正常胰腺组织中GLI1和MMP9的表达,探讨两者的表达与胰腺癌临床病理特征及预后的关系。
1 资料与方法
1.1 临床资料 选取辽宁省人民医院和中国医科大学附属第一医院2009年12月至2012年11月行根治性手术切除的石蜡包埋胰腺癌组织标本48例。其中辽宁省人民医院17例,中国医科大学附属第一医院31例。男26例,女22例。年龄37~76岁,平均(58.6±6.1)岁。这些病例均经组织病理学诊断为原发性胰腺导管腺癌,其中高分化腺癌26例、中分化腺癌17例、低分化腺癌5例。同时选取正常胰腺组织标本11例。所有病例均无其他严重内科疾病或恶性肿瘤,术前均未行放化疗和细胞免疫治疗。收集时均获得患者的知情和同意并且留有确切的联系电话进行电话随访。依据国际抗癌联盟(UICC)第6版标准[6]进行TNM分期。
1.2 免疫组化检测 标本常规石蜡包埋,连续4μm厚度常规切片。除做常规HE染色外,余做免疫组化染色。步骤严格按照SP试剂盒的说明书操作。将已知GLI1、MMP9阳性切片作阳性对照,用磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.3 染色结果判定
1.3.1 GLI1染色结果判定 l)染色强度:(+)弱阳性,记为1分;)中等强度,记为2分;)强阳性,记为3分。2)阳性细胞百分比:比例<5%,记为0分;比例5%~25%,记为1分;比例26%~50%,记为2分;比例51%~75%,记为3分;比例>75%,记为4分。3)将染色强度和阳性细胞百分比两者得分相乘,如果乘积<6为低表达,介于7~12为高表达。
1.3.2 MMP9染色结果判定 在10×20高倍视野下,从每一张组织切片中随机选取10个视野,单个视野计数100个细胞,10个视野总计数1000个细胞。按阳性表达细胞占所有计数细胞的比例计算百分率,<5%细胞着色标为(-),5%~25%细胞着色标为(+),25%~50%细胞着色标为),>50%细胞着色标为)。
1.4 统计学处理 采用SPSS21.0软件进行统计分析。采用卡方检验及Fisher确切概率法评估GLI1、MMP9与临床病理因素之间的关系,采用Spearman分析对GLI和MMP9进行相关性分析,采用Kaplan-Meier法描绘生存曲线,组间生存率比较用Log-Rank检验,不同影响因素与胰腺癌预后采用Cox多因素分析,P<0.05为差异有显著性。
2 结果
2.1 随访结果 采用电话对48例患者进行随访,时间2年在此期间死于胰腺癌相关疾病者为完全数据,生存和失访病例按删失数据处理。生存时间按月计算,以手术日至末次随访所得的时间为准。失访1例,3例术后意外死亡计入失访,失访率为8.3%,4例依然存活(8.3%)。
2.2 免疫组化结果 GLI1在48例胰腺癌组织中共有32例呈高表达,染色着色位于细胞浆和细胞核;MMP9在48例胰腺癌组织中共有30例呈阳性表达,染色颗粒着色位于细胞浆;两者在11例正常胰腺组织中各有1例表达;GLI1、MMP9在胰腺癌组织和正常组织中的表达差异具有显著性,P<0.05。GLI1的高表达和MMP9的阳性表达与患者的性别、年龄、肿瘤部位和切缘状况无关,P>0.05,差异无显著性;与肿瘤大小、分化程度、T分期、淋巴结转移、TNM分期、局部浸润和有无神经侵犯有关,P<0.05,差异具有显著性,见表1。
2.3 GLI1、MMP9的表达与胰腺癌患者预后的关系GLI1高表达患者中位生存时间为11.5个月,1年累计生存率为50.4%,GLI低表达患者中位生存时间16.9个月,1年累计生存率为78.6%。生存曲线结果(见图1)表明,GLI1高表达者生存时间明显低于低表达者(Log-rank检验,Χ2=12.230,P=0.000)。MMP9阳性表达患者中位生存时间为12.8个月,1年累计生存率为53.3%,MMP9阴性表达患者中位生存时间16.6个月,1年累计生存率为83.3%。生存曲线结果(见图2)表明,MMP9阳性表达者生存时间明显低于阴性表达者(Log-rank检验,Χ2=4.077,P=0.043)。
2.4 胰腺癌中GLI1与MMP9表达的相关关系 将GLI1和MMP9的染色性质作为变量,使用Spearman分析两者的相关性。结果表明,GLI1与MMP9的表达呈正相关(r=0.548,P=0.000),见表2。
2.5 不同影响因素与胰腺癌预后的Cox多因素分析将肿瘤部位、切缘状况、肿瘤大小、肿瘤分化、T分期、TNM分期、周围神经侵犯、血管侵犯、淋巴结转移、MMP9阳性表达、GLI1高表达等可能影响患者预后的因素强制引入Cox比例风险模型,进行多因素分析(回归模型的Χ2=52.496,P=0.018,模型具有意义)。结果表明,切缘状况(P=0.027)、TNM分期(P=0.023)、周围神经侵犯(P=0.016)、血管侵犯(P=0.019)、淋巴结转移(P=0.025)、MMP9阳性表达(P=0.038)、GLI1高表达(P=0.041)为影响胰腺癌预后的独立因素,见表3。

图1 GLI 1生存曲线

表1 GLI1和MMP9的表达与胰腺癌患者临床病理参数间的关系

图2 MMP9生存曲线
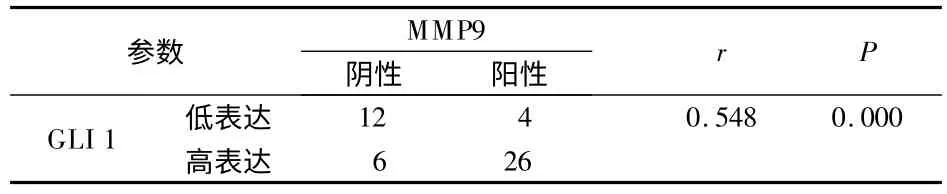
表2 胰腺癌中GLI1与MMP9表达的相关关系

表3 不同影响因素与胰腺癌预后的Cox多因素分析
3 讨论
Hedgehog(Hh)信号传导通路异常会导致肿瘤的发生,诸多研究表明,在多种肿瘤(如肝癌、胃癌、胰腺癌、皮肤基底细胞癌等)的发生和发展过程中,Hh信号传导通路也有重要的作用[6-10]。Hh信号传导通路在胰腺癌中主要是以Hh-GLI1通路的形式存在,其过度激活将导致胰腺癌的发生、发展。Xuanfu Xu[11]等研究发现,GLI1基因能够基因调控TGFβ、Ras、Wnt、生长因子、PI3K/AKT、整合素、TMS4和S100A4等因子,当GLI1基因表达升高时,E钙蛋白表达下降,以此介导EMT(上皮间质转化),促进胰腺癌的肝转移和脾内微小转移。王锋[12]等通过干扰胰腺癌细胞GLI1基因表达的研究发现,随着GLI1 mRNA和蛋白表达水平的下调,bcl-2 mRNA和蛋白的表达也下调,表明干扰GLI1基因的表达可能通过下调bcl-2的表达抑制人胰腺癌PANC-1细胞的增殖。
本研究采用免疫组织化学方法检测GLI1在胰腺癌中的表达,从组织学角度来阐明GLI1和胰腺癌的关系。结果GLI1在48例胰腺癌组织中共有32例呈高表达,并且和肿瘤大小、分化程度、T分期、淋巴结转移、TNM分期、局部浸润和有无神经侵犯有关,说明GLI1和胰腺癌的发生和发展具有重要关系,并且能够促进胰腺癌组织的侵袭和转移。
MMP9能够促进肿瘤细胞和组织的生长、侵袭、转移、血管生成[13-14]。MMP9通过降解主要成分为IV型胶原的基底膜,使基底膜的连续性和完整性受到破坏,从而有利于肿瘤细胞的侵袭和转移[15]。MMP9和胰腺癌的发生及发展具有重要关系。尚培中[16]等应用免疫组织化学法检测MMP9在70例原发性胰腺癌行根治性手术切除的组织标本和15例癌旁正常胰腺组织中的表达,结果表明,MMP9在原发性胰腺癌组织中的表达和在癌旁正常胰腺组织中的表达差异有显著性(P<0.05);MMP9表达与患者的性别、年龄及肿瘤部位无关而与肿瘤大小、分化程度、TNM分期、是否发生淋巴结转移有显著关系。本研究也表明,MMP9与肿瘤大小、分化程度、T分期、淋巴结转移、TNM分期、局部浸润和有无神经侵犯有关。
GLI1能否调节MMP9来调控肿瘤细胞和组织的发生、发展和侵袭转移。欧阳小波[17]等采用免疫组织化学方法检测Shh、GLI1和MMP9蛋白在胃癌组织中的表达来研究它们与胃癌的侵袭和转移的关系。结果表明,胃癌组织中Shh、GLI1和MMP9的阳性表达率明显高于癌旁组织和正常组织,并且三者的表达均与胃癌患者的性别、年龄、部位无关,而与分化程度、浸润程度以及淋巴结转移相关。在这项研究中,Shh、GLI1都和MMP9三者的表达呈正相关关系,说明Hh信号传导通路可能通过上调MMP9在胃癌中的表达提高胃癌细胞的侵袭和转移能力。Nagai[18]等应用Hh信号传导通路抑制剂环靶明降低MMP9表达,胰腺癌细胞的侵袭能力降低;相反,当增强Hh信号传导通路活性时,MMP9的表达增高而胰腺癌细胞的侵袭能力也随之增强。用小干扰RNA技术下调GLI1表达后发现,MMP9的表达受到抑制而胰腺癌的侵袭性下降。用GLI1转染胰腺癌细胞后,MMP9的表达上调同时胰腺癌的侵袭能力也增强。说明GLI1可通过调控MMP9的表达调控胰腺癌细胞的侵袭和转移能力。应用Cox多因素分析肿瘤部位、切缘状况、肿瘤大小、肿瘤分化、T分期、TNM分期、周围神经侵犯、血管侵犯、淋巴结转移、MMP9阳性表达、GLI1高表达与胰腺癌患者的生存时间的关系,更进一步证明,MMP9阳性表达和GLI1高表达可以作为预测胰腺癌预后的一项指标。
综上所述,GLI1、MMP9的过表达在胰腺癌的发生、发展、侵袭和转移中发挥重要作用,过表达提示预后不良,对GI1、MMP9的检测可有效地评估胰腺癌患者的预后并且有望成为胰腺癌治疗的新靶点。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer JClin,2013,63:11
[2]Long J,Luo GP,Xiao ZW,et a1.Cancer statistics:Current china[J].Cancer Lett,2014,346(2):273
[3]Osterlund T,Kogerman P.Hedgehog signalling:how to get from smo to ci and Gli[J].Trends Cell Biol,2006,16(4):176
[4]Buttitta L,Mo R,Hui CC,et al.Interplays of Gli2 and Gli3 and their requirement in mediating shh-dependent sclerotome induction[J].Development,2003,130(25):62332
[5]Yao J,Xiong S,Klosk,et al.Mutiple signling pathways involved inactivation of matrix metalloproteinase-9(MMP-9)by heregulin betal in human breast cancer cells[J].Oncogene,2001,20:8066
[6]MinS,XiaoyanX,FanghuiP,et al.The glioma-associated oncogene homolog 1promotes epithelial--mesenchymal transition in human esophageal squamous cell cancer by inhibiting E-cadherin via snail[J].Cancer Gene Ther,2013,20(7):379
[7]Zhanshan Wang,Yang Shen,Xu Li,et al.The glioma-associated oncogene homolog 1 promotes epithelial-mesenchymal transition in human esophageal squamous cell cancer by inhibiting E-cadherin via Snail[J].Cancer?Gene Ther,2013,20(7):379
[8]Sun XD,Liu XE,Huang DS.Curcumin reverses the epithelial mesenchymal transition of pancreatic cancer cells by inhibiting the Hedgehog signaling pathway[J].2013,29(6):2401
[9]GaiX,Lu Z,Tu K,et al.Caveolin-1 is up-regulated by GLI1 and contributes to GLI1driven EMT in hepatocellular carcinoma[J].2014,13,9(1):84551
[10]Ingham PW.Transuding Hedgehog:the story so far[J].EMBO J,1998,17(13):3505
[11]Xu X,Zhou Y,Xie C,et al.Genome-wide screening reveals an EMT molecular network mediated by Sonic hedgehog-Gli1 signaling in pancreatic cancercells[J].PLOSOne,2012,7(8):43119
[12]王锋,徐凌,郭传勇,等.脑胶质瘤相关癌基因1对人胰腺癌PANC-1细胞增殖的影响[J].肿瘤,2011,31:5
[13]Groblewska M,Siewko M,Mroczko B,et al.The role of matrix metalloproteinases(MMPs)and their inhibitors(TIMPs)in the development of esophageal cancer[J].Folia Histochem Cytobiol,2012,50,12
[14]巫静娴,赵涌,贾世军,等.CD147与基质金属蛋白酶-2,3,9在卵巢癌中的表达及临床病理意义[J].重庆医科大学学报,2007,32(11):1166
[15]尚培中,李晓武,蔡大伟,等.基质金属蛋白酶9在胰腺癌组织中的表达及其临床意义[J].Chin Arch Gen Surg(Electronic Edition),December,2013,7:6
[16]欧阳小波,郝亚琴,王立.Shh、Gli1和MMP-9在胃癌组织中的表达及临床意义[J].中国现代医学杂志,2011,21(9):
[17]Nagai S1,Nakamura M,Yanai K,et al.Gli1 contributes to the invasiveness of pancreatic cancer through matrix metallo-proteinase-9 activation[J].Cancer Sci,2008,99(7):1377

