荔枝皮磁性微球对水中Pb2+、Cd2+、Zn2+、Ni2+的吸附机理研究
宋学东,高雁,齐金秋
山东农业大学水利土木工程学院,山东泰安271018
荔枝皮磁性微球对水中Pb2+、Cd2+、Zn2+、Ni2+的吸附机理研究
宋学东,高雁,齐金秋
山东农业大学水利土木工程学院,山东泰安271018
利用荔枝皮与Fe3O4合成了磁性微球吸附材料(MLP),并对MLP吸附溶液中Pb2+、Cd2+、Zn2+、Ni2+的影响因素、吸附等温线、动力学、热力学等进行了研究。结果表明:pH和吸附剂投加量对Pb2+去除率的影响较大,而对Cd2+、Zn2+、Ni2+的影响较小;Pb2+和Ni2+的吸附平衡时间分别为100和60 min。MLP对Pb2+、Cd2+、Zn2+、Ni2+的吸附过程均可以用Langmuir等温线模型进行较好的拟合,其最大吸附容量的大小顺序为:Pb2+>Zn2+>Cd2+>Ni2+。MLP吸附Pb2+属于自发放热过程,而对Cd2+、Zn2+、Ni2+的吸附属于非自发放热过程。MLP对4种金属离子的吸附过程遵循准二次反应机理。
荔枝皮;磁性改性;吸附;重金属离子;机理
目前,随着重金属在社会生产、生活中越来越广泛地应用,重金属的污染问题也日益严重。由于重金属离子具有难以生物降解,且在环境中易于累积等特性,它往往会对生态系统和人体健康造成直接或间接的严重危害。因此,含重金属的废水必须经过处理后才能排放至水体。吸附法作为一种常用的污水中重金属离子的处理方法,具有处理效率高和价格低廉等优势,已经广泛用于处理含重金属废水。活性炭[1,2]、沸石[3]等作为目前被广泛采用吸附剂,已经广泛应用于水中重金属离子的去除实践中;但是这些吸附剂也存在成本高、难于回收利用、需要再生系统等弊端。因此,寻找价廉高效的新型生物吸附材料已成目前处理含重金属废水研究的一个重要方向。
近年来,国内外学者已对基于农业废弃物再利用的生物吸附材料的开发和研制方面开展了大量研究,如冯宁川[4]利用橘子皮吸附Pb2+、Cd2+、Zn2+、Ni2+、Cu2+,陈再明[5]利用水稻秸秆吸附Pb2+,陈云嫩[6]利用谷壳吸附Cd2+等均取得了较好的去除效果。但是,综合分析国内外已有的研究,多数研究均基于单个离子去除方面,对多种重金属离子的同时去除仍有待于进一步研究。因此,本文以荔枝皮为原料制备了具有磁性的吸附材料,探讨其在静态条件下对Pb2+、Cd2+、Zn2+、Ni2+的吸附影响因素,并通过研究其吸附等温线、吸附过程中的热力学和动力学等探讨了其对重金属离子的吸附机理。
1 材料与方法
1.1实验试剂与仪器
试剂:配制重金属Pb2+、Cd2+、Zn2+、Ni2+溶液的Pb(NO3)2、Cd(NO3)2·4H2O、Zn(NO3)2、NiCl2·6H2O,改性所用试剂为FeSO4·7H2O、FeCl3·6H2O、三聚磷酸钠(TPP)、氨水及调节pH的HCl和NaOH。所有试剂均为分析纯,均购自天津市巴斯夫化工有限公司。
仪器:TAS-990型原子吸收分光光度计(北京普析通用仪器有限公司)、868型pH计(Thermo Electron Corporation)、HZQ-Z型全温立式振荡培养箱(金坛仪器有限公司)、TDL-5-A型离心机(上海安亭科学仪器厂)。
1.2荔枝皮磁性吸附材料的制备
Fe3O4的制备:称取FeCl3·6H2O(10.8116 g),FeSO4·7H2O(5.5604 g)溶于200 mL去离子水;超声30 min,使其充分溶解和混合;用氨水(w%25~28)调节pH≈9.2;继续超声1 h;使用磁铁(离心)分离,去离子水洗涤3~4次至中性,然后在70℃下烘干至恒重,至于干燥皿中储存备用。
荔枝皮的处理:所用荔枝皮来自当地农贸市场,经自来水和超纯水洗净后于烘箱中在70℃下烘干至恒重,研磨,过60目筛,置于干燥皿中储存备用。
荔枝皮磁性吸附材料的制备:称取30 g处理后的荔枝皮与400 mL去离子水,800 rpm机械搅拌30 min,混匀;然后称取Fe3O4(15 g)加入,800 rpm机械搅拌30 min,混匀;再称取7.5 g TPP加入,800 rpm机械搅拌60 min,混匀;使用磁铁(离心)分离,去离子水洗涤2~3次,无水乙醇洗涤1~2次,再用去离子水洗涤2~3次;使用磁铁(离心)分离,40℃真空烘干,得到实验所用的荔枝皮磁性微球(记为MLP)。
1.3实验方法
1.3.1吸附影响因素实验取50 mL Pb2+、Cd2+、Zn2+、Ni2+(200 mg/L)溶液置于100 mL聚乙烯塑料瓶中,加入一定量(1、2、4、10和20 g/L)的荔枝皮磁性微球,调节溶液的pH(3.0、4.0、5.0、6.0、7.0和8.0),于25℃下恒温振荡一段时间(10、30、45、60、80、100、120、150和180 min)后离心,经微孔滤膜过滤后,用原子吸收分光光度计法测定Pb2+、Cd2+、Zn2+、Ni2+的含量变化。
考察某一参数对吸附的影响时,其他参数为固定值。
1.3.2吸附等温线的测定设定四种重金属溶液浓度分别为25、50、100、120和150 mg/L,取50 mL置于100 mL聚乙烯塑料瓶中,加入4 g/L荔枝皮磁性微球,调节溶液的pH为6.0,于25℃下恒温振荡2.0 h后离心,经微孔滤膜过滤后,测定金属的含量变化。
1.3.3吸附热力学实验取50 mL四种重金属(100 mg/L)溶液置于100 mL聚乙烯塑料瓶中,加入4 g/L荔枝皮磁性微球,调节溶液的pH为6.0,在不同温度(25、35、45和55℃)下恒温振荡2.0 h后离心,经微孔滤膜过滤后,测定金属的含量变化。
1.3.4吸附动力学实验取50 mL四种重金属(200 mg/L)溶液置于100 mL聚乙烯塑料瓶中,加入4 g/L荔枝皮磁性微球,调节溶液的pH为6.0,于25℃下恒温振荡10、30、45、60、80、100、120、150和180 min后取样,离心经微孔滤膜过滤后,测定金属的含量变化。
2 结果与分析
2.1pH的影响
溶液pH值的大小是生物吸附过程中的重要因素,溶液pH值对荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的影响如图1所示。
由图1中可以看出,对于200 mg/L的金属溶液,当吸附剂量为4 g/L,吸附时间为2 h,温度为25℃时,在pH=3.0~8.0范围内,Pb2+的去除受溶液pH值的影响最大,当溶液pH值由3.0增大到7.0时,其去除率由43.86%增加到98%;而在此pH范围内,pH对Cd2+、Zn2+、Ni2+的去除并未发生显著变化,去除率分别维持在74%、78%、50%左右。当溶液pH值进一步增大到8.0时,Cd2+、Zn2+、Ni2+的去除率分别迅速增加到99.6%、99.1%、99.7%,而Pb2+去除率则无显著增大。分析其原因可能在于:溶液pH较低时,H+的浓度和活动性较高,与重金属离子形成了竞争吸附,吸附剂表面的吸附点位被大量的H+占据,活性点位质子化严重,不利于重金属离子与吸附点位的结合;随着pH的增大,H+的浓度降低,活性点位质子化作用减弱,有利于金属离子与活性位点的结合[7]。同时pH影响金属离子在溶液中的赋存状态[8,9],已有研究表明[4],Zn2+和Ni2+在pH小于7.0时,Cd2+在pH小于8.0时,均主要以游离金属离子和羟合配离子的形式存在;而当pH分别大于7.0和8.0时,Zn2+、Ni2+和Cd2+则主要以重金属氢氧化物沉淀形式存在,因此,导致Zn2+、Ni2+和Cd2+金属离子去除率迅速增加。
2.2吸附时间的影响
金属离子去除率随吸附时间变化的结果如图2。从图2中可以看出,在金属溶液浓度为200 mg/L、pH=6.0、吸附剂量为4 g/L、25℃条件下,Pb2+和Ni2+的去除率均随吸附时间延长而增大,分别由10 min时的69%、47%逐渐增加到77%、51%,在100 min、60 min达到吸附平衡;荔枝皮磁性微球对Cd2+、Zn2+吸附迅速,Cd2+、Zn2+的去除率基本不随时间延长而变化,分别维持在73%、78%左右,对Cd2+、Zn2+的吸附平衡时间在10 min以内。

图1 pH值对荔枝皮磁性微球吸附金属离子的影响Fig.1 Effect of pH on the adsorption of metal ions onto magnetic micro-spheres of litchi pericarps
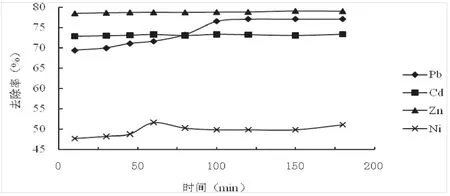
图2 吸附时间对荔枝皮磁性微球吸附金属离子的影响Fig.2 Effect of time on the adsorption of metal ions onto magnetic micro-spheres of litchi pericarps
2.3吸附剂投加量的影响
不同吸附剂投加量对重金属离子去除率的影响见图3。由图3可以看出,在金属溶液浓度为200 mg/L、pH=6.0、接触时间为2 h、25℃条件下,随着荔枝皮磁性微球投加量由1 g/L逐渐增加到20 g/L,Pb2+的去除率由58%逐渐增加到91%直至达到平衡;而Cd2+、Zn2+、Ni2+的去除率基本不变,分别维持在73%、78%、50%左右。因此吸附剂投加量对Pb2+去除率影响较显著,而对Cd2+、Zn2+、Ni2+去除率影响不是很明显。

图3 吸附剂投加量对荔枝皮磁性微球吸附金属离子的影响Fig.3 Effect of MLP dosage on the adsorption of metal ions onto magnetic micro-spheres of litchi pericarps
2.4吸附等温线
本实验采用Langmuir和Freundlich线性方程对实验数据进行拟合,方程式如下:

其中,Ce为金属离子的平衡浓度(mg·L-1);Qe和qm分别为吸附剂对金属离子的平衡吸附量和最大吸附量(mg·g-1);b为Langmuir吸附常数(L·mg-1);Kf、n为Freundlich方程经验常数。以1/Ce对1/qe作图,绘制Langmuir等温线;以lnCe对lnQe作图,绘制Freundlich等温线,结果如图4、5所示:

图4 Langmuir等温线Fig.4 Simulated plot of Langmuir isothermal equation

图5 Freundlich等温线Fig.5 Simulated plot of Freundlich isothermal equation
由图4、5可以看出,荔枝皮磁性微球对Pb2+、Cd2+、Zn2+、Ni2+的吸附过程均可以用Langmuir和Freundlich等温线模型进行较好地拟合,两种吸附等温线的参数见表1。由表1可以看出,Langmuir等温线模型的决定系数(R2)均大于Freundlich等温线模型的R2,说明荔枝皮磁性微球对Pb2+、Cd2+、Zn2+、Ni2+的吸附过程可能更符合单层表面吸附过程[10]。此外,通过Langmuir等温线模型可以得出荔枝皮磁性微球对Pb2+、Cd2+、Zn2+、Ni2+的饱和吸附量分别为:78.12、45.65、67.11和27.03 mg·g-1,即荔枝皮磁性微球对几种重金属离子的吸附能力大小顺序为:Pb2+>Zn2+>Cd2+>Ni2+。

表1 荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的Langmuir及Freundlich方程参数与相关系数Table 1 The conform parameters of Langmuir and Freundlich equation of Pb2+、Cd2+、Zn2+and Ni2+on MLP
此外,吸附过程是否趋向于有利吸附可由分离因子RL值来判断。RL计算公式:

b为Langmuir吸附常数,CO为溶液中金属离子初始浓度。RL>1为不利吸附,RL=1时为线性吸附,0<RL<1为有利吸附,RL=0为不可逆吸附。从表1中可以看出,RL值随着初始浓度增大而逐渐减小,说明提高浓度更有利于吸附过程进行,且0<RL<1说明该吸附过程为有利吸附。RL值随初始浓度增大先减小后平稳,说明随着初始浓度增大吸附过程驱动力先增大后平稳。RL值平衡后,限制吸附过程的因素可能是吸附剂表面活性点位不足。4种重金属离子在相同条件下被荔枝皮磁性微球吸附的RL值大小顺序为:Zn2+>Ni2+>Cd2+>Pb2+。
2.5吸附热力学
根据本实验测得的不同温度下的吸附量值,利用范特霍夫公式表示平衡常数KD和温度之间的关系:

△H(kJ·mol-1)为焓变,△S(J·(mol·K)-1)为熵变。△H和△S分别由lnKD对1/T回归直线的斜率和截距计算。由Saltal[11-13]等采用的热力学参数计算方法,△G的计算公式为:

式中,R为气体常数(8.314 J·(mol·K)-1),T为绝对温度(K),KD为分配系数,可由公式计算:

Qe为吸附剂吸附金属离子的平衡吸附量(mg·g-1),Ce为平衡时溶液中残留的金属离子浓度(mg/L)。
荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+过程的热力学参数见表2。由表2的结果可以看出,吸附吉布斯自由能△G是吸附驱动力和吸附优惠性的体现[4]。荔枝皮磁性微球吸附Pb2+的△G为负值,说明MLP吸附Pb2+的过程是自发进行的,而荔枝皮磁性微球吸附Cd2+、Zn2+、Ni2+的△G为正值,这就说明MLP吸附Cd2+、Zn2+、Ni2+的过程是非自发进行的。随着温度升高,荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的△G增大,说明该反应在低温条件下更易于进行[14]。荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的△H均为负值,说明该吸附反应均为放热反应。熵变△S是整个体系熵变代数和,反应体系内部存在状态的混乱程度的变化。熵值小,体系处于比较有序的状态;熵值大,体系处于比较无序的状态[4]。荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的△S均为负值,说明在该吸附过程中,整个溶液体系的有序度得到了提高,有可能发生了离子交换反应。
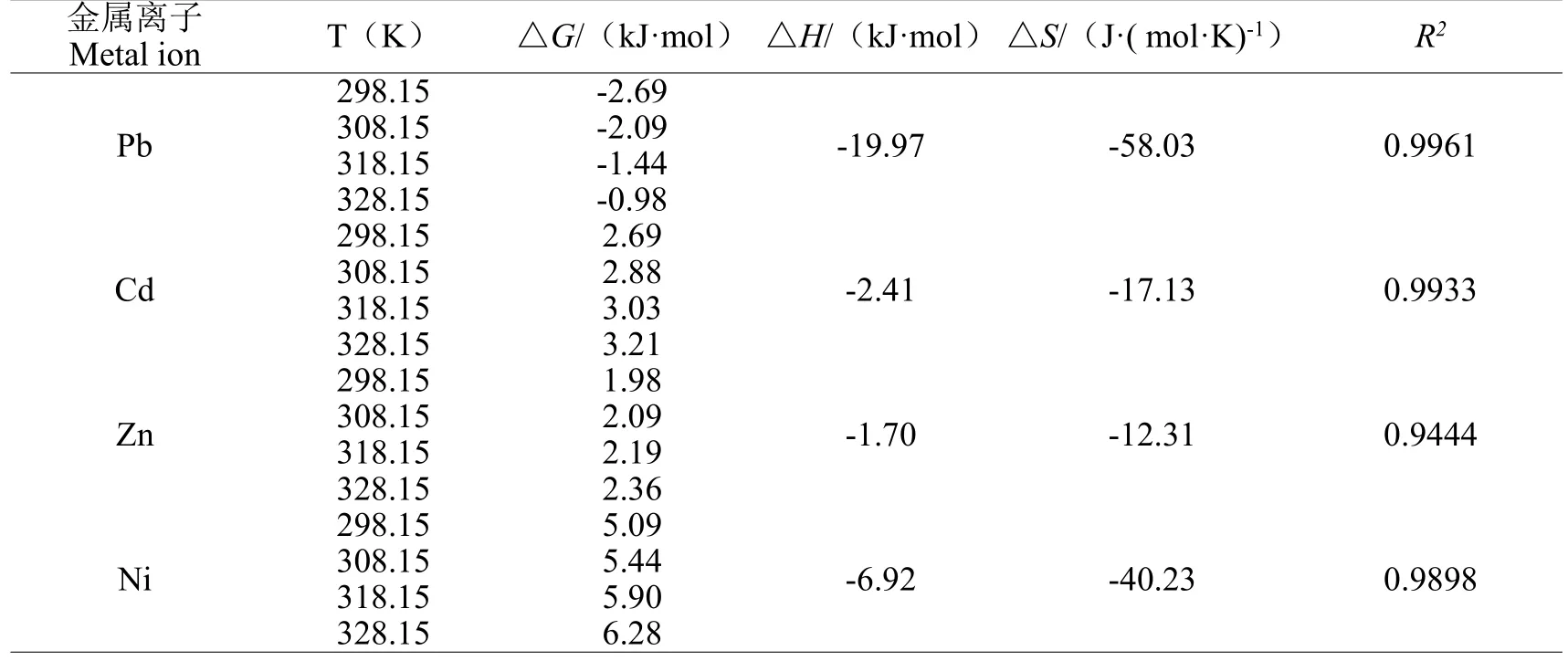
表2 热力学参数Table 2 Thermodynamics parameters
2.6吸附动力学
本研究分别采用准一次动力学模型和准二次动力学模型对实验数据进行拟合,相应的方程式如下:

其中,qe和qt分别为平衡和t时刻吸附剂对金属离子的吸附量(mg·g-1);k1和k2分别为准一次和准二次动力学模型速率常数(g·(mg·min)-1)。磁性荔枝皮吸附金属离子的动力学模型结果见表3和图6、7。

表3 准一次和准二次反应动力学参数Table 3 Kinetic parameters of the pseudo-first order and pseudo-second order equation
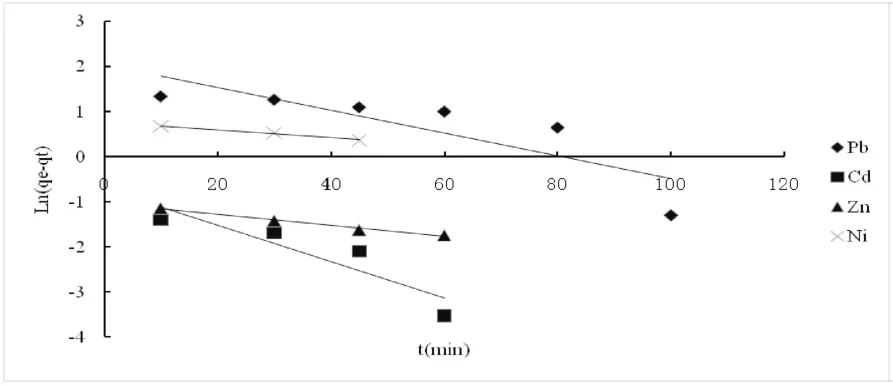
图6 准一次动力学方程Fig.6 Quasi a kinetic equation

图7 准二次动力学方程Fig.7 Quasi qudratic kinetic equation
从表3及图6、7中可以看出,与准一次动力学相比,准二次动力学模型能够更准确的反映磁性荔枝皮对所研究的4种金属离子的吸附过程。已有研究结果也表明,生物吸附剂对于二价金属离子的吸附过程通常适用于准二次动力学模型[4]。此外,从表3也可以看出,通过准一次动力学方程得到的qe.cal值远远小于实验值qe.exp,而通过准二次动力学方程得到的qe.cal与实验值qe.exp之间差距并不显著,这也进一步说明磁性荔枝皮吸附Pb2+、Cd2+、Zn2+、Ni2+过程更符合准二次动力学模型。由于准二次动力学是建立在化学吸附的基础上,因此,磁性荔枝皮对Pb2+、Cd2+、Zn2+、Ni2+的吸附过程的限速步骤为化学吸附过程[15]。这是因为荔枝皮表面含有大量的羧基、羟基等基团,这些基团能够与重金属离子(M2+)发生离子交换反应,有效的捕捉水中的重金属离子。反应式如下所示:

3 结论
(1)在磁性荔枝皮吸附金属离子的过程中,pH和吸附剂投加量对Pb2+的去除率具有显著影响,而对Cd2+、Zn2+、Ni2+等的影响较小。Pb2+和Ni2+的吸附平衡时间分别为100 min和60 min;而吸附时间对Cd2+、Zn2+的去除率影响较小。
(2)荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的过程均可用Langmuir等温线进行较好的拟合,且吸附过程主要是单层表面吸附;对几种重金属离子的吸附能力大小顺序为:Pb2+>Zn2+>Cd2+>Ni2+。
(3)荔枝皮磁性微球吸附Pb2+的过程是自发放热过程,而吸附Cd2+、Zn2+、Ni2+的过程是非自发放热过程;荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+过程中,整个溶液体系的有序度得到了提高。
(4)荔枝皮磁性微球吸附Pb2+、Cd2+、Zn2+、Ni2+的过程遵循准二次反应机理,限速步骤为化学吸附过程。
[1]雒和敏,曹国璞.活性炭对含铅废水吸附特性研究[J].环境工程学报,2010,4(2):373-376
[2]李子龙,马双枫,王栋,等.活性炭吸附水中金属离子和有机物吸附模式和机理的研究[J].环境科学与管理,2009,34(10):88-92
[3]单宝田,张爱滨,胡立阁,等.沸石对重金属废水中Cu(NH3)42+的吸附性能研究[J].水处理技术,2002,28(4):207-209
[4]冯宁川.橘子皮化学改性及其对重金属离子吸附行为的研究[D].湖南:中南大学冶金科学与工程学院,2009
[5]陈再明,方远,徐义亮,等.水稻秸秆生物碳对重金属Pb2+的吸附作用及影响因素[J].环境科学学报,2012,32(4):769-776
[6]陈云嫩,丁元春.谷壳对水中隔离子的吸附动力学及热力学研究[J].安徽农业科学,2009,37(7):3190-3192
[7]AKsa Z.Equilibrium and kinetic modelling of Cadmium(II)biosorption by C.vulgaris in a batch system:effect of temperature[J].Separations and Purifications Technology,2001,21:285-294
[8]Yang J,Volesky B.Biosorption of uranium on sargassum biomass[J].Water Research,1999,33(15):3357-3363
[9]Asmal M,Khan A H,Ahamd S,et a1.Role of sawdust in the removal of Copper(II)from industrial wastes[J].Water Research,1998,32:3085-3091
[10]冯川宁,郭学益,梁莎,等.橘子皮化学改性及其对Cu(II)离子的吸附性能[J].中国有色金属学报,2008,18(1):149-154
[11]Saltah K,San A,Aydin M.Removal of ammonium ion from aqueous solution by natural Turkish(Yfldmeli)zeolite for environmental quality[J].Journal of Hazardous Materials,2007,B141:258-263
[12]Borah D,Satokawa S,Kato S,et a1.Surface-modified carbon black for As(V)removal[J].Journal of Colloid and Interface Science,2008,319(1):53-62
[13]San A,Tuzen M,UluOzlti 0 D,et a1.Biosorption of Pb(II)and Ni(II)from aqueous solution by lichen(Cladonia furcata)Biomass[J].Biochemical Engineering Journal,2007,37:151-158
[14]徐春霞,钟开龙.无机及分析化学[M].北京:科学出版社,2010:44-49
[15]Ozacar M,Sengil I A.Adsorption of reactive dyes on calcined alunite from aqueous solutions[J].Journal of Hazardous Material,2003,98:211-224
Study on the Mechanism of Adsorption towards Pb2+、Cd2+、Zn2+、Ni2+by Magnetic Micro-sphere of Litchi Pericarp
SONG Xue-dong,GAO Yan,QI Jin-qiu
College of Water Conservancy and Civil Engineering,Shandong Agricultural University,Tai’an 271018,China
Magnetic microspheres of litchi pericarp(MLP)were synthesized by the composite materials of litchi pericarps and Fe3O4as new adsorbents,and the influencing factors,adsorption isotherm models,kinetics and thermodynamics that Pb2+、Cd2+、Zn2+、Ni2+were adsorbed by MLP were investigated by means of using static experimental method.The results showed that pH and adsorbent dosage exhibited a significant impact on the removal rate of Pb2+.However,There was a little effect on that of Cd2+、Zn2+、Ni2+.The equilibrium time of Pb2+and Ni2+adsorption were 100 and 60 min, respectively.The adsorption processes of Pb2+、Cd2+、Zn2+、Ni2+onto MLP could be well described by Langmuir isotherms models,and the order of maximum adsorption capacity was Pb2+>Zn2+>Cd2+>Ni2+.Additionally,the adsorption process was spontaneous and exothermic for Pb2+by MLP,while non-spontaneous and exothermic for Cd2+,Zn2+,and Ni2+. The adsorption kinetics of Pb2+、Cd2+、Zn2+、Ni2+were all well conformed to the pseudo-second-order model.
Litchi pericarp;magnetic modification;adsorption;heavy metal ion;mechanism
X52文献标示码:A
1000-2324(2015)02-0259-06
2013-05-04
2013-05-24
宋学东(1962-),男,教授,主要从事实验室管理工作.E-mail:slsy@sdau.edu.cn

