CXCR7在CXCL12生物学功能中的研究进展*
邹 杰,戴小珍,朱 力
1.成都医学院 基础医学院(成都 610500);2.成都医学院第一附属医院 耳鼻咽喉-头颈外科(成都 610500);3.成都医学院 生物医学系(成都 610500)
1 CXCR7的发现及其配体CXCL12
CXCR7又名RDC1,是G蛋白偶联的七次跨膜蛋 白 受 体(seven-transmembrane receptors,7-TMRs),基因定位于人类染色体2q37,它最初是从狗的甲状腺cDNA序列中分离出来的[1]。通常认为,CXCR7有2个趋化因子配体CXCL12和CXCL11。CXCL12又称基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)或前 B细胞刺激因子,具有七次跨膜α螺旋结构,属于CXC类趋化因子亚家族成员,编码基因位于人类染色体10q11.1,主要在淋巴结、肺、肝和骨髓中高表达,而在小肠、肾、皮肤、脑和骨骼肌中表达量较少[2]。在一些病理性疾病如炎症、缺血和缺氧,以及在促血管生成的环境下如肿瘤和自身免疫疾病中,CXCL12表达量升高[3-4]。CXCL12作为未成熟和成熟造血细胞的高效趋化因子,在包括心脏和神经元的发育、新生血管形成、干细胞迁移、肿瘤发生、炎症和免疫监督方面发挥了重要作用[5]。而CXCL12也可以与CXCR4受体结合,但其与CXCR7的亲和性远高于 CXCR4[6-7]。
2 CXCR7的表达
CXCR7在不同的组织器官和病理生理状态下表达量是不同的。对正常组织CXCR7蛋白和核酸水平分析表明,心脏、脑、脾、肾、肺、睾丸、卵巢、甲状腺[1,6-8]和人胎盘中,CXCR7是高表达的,而肝以及胸腺中表达量却很少[6]。有研究证明,在免疫系统、胚胎发育、雌激素和疾病的调节过程中,CXCR7的表达也会有所变化。在人类骨髓中,CXCR7表达在淋巴细胞和粒细胞上;在外周血中,CXCR7却表达在单核细胞、粒细胞和血小板中[9];在免疫系统的分化和成熟过程中,例如树突状细胞体外用不同诱导剂来刺激活化细胞,也可能会影响CXCR7的表达量:脂多糖诱导成熟的人类树突状细胞检测到了CXCR7的表达[10],然而肿瘤坏死因子 TNF-α诱导的细胞CXCR7却不表达[11]。在胚胎发育过程中,CXCR7的表达也会有所不同,如在鼠的肝脏发育过程中,CXCR7在发育阶段E11~E13是高表达的,而在E15~E17阶段表达量却下降[6],用CXCR7缺陷的小鼠来做相关实验,也证明了CXCR7在血管系统形成过程的重要作用[12]。从雌激素调节的相关报道得出,在哺乳动物中,根据CXCR7的功能,可以把它分为CXCR7a和CXCR7b,而雌激素可以调节CXCR7b的表达。在人类乳腺癌细胞中,雌激素也已经被证明可以上调CXCL12和CXCR4的表达,但抑制了CXCR7的表达[13]。最后,在疾病相关研究中总结出,炎症、感染、缺血和肿瘤形成中,CXCL12是高表达的,相应地上调了CXCR7表达。例如,在有肠炎症的病人外周血淋巴细胞中,CXCR7表达是上升的[14];另外,在许多恶性细胞包括乳腺、肺、颈部、胰脏、骨髓、神经胶质和前列腺等癌细胞中,都检测到了 CXCR7的表达[6,9,15]。各种类型的肿瘤组织做免疫组化表明,与正常组织相比,CXCR7表达是明显升高的[16-17]。另外,有研究者[17]也发现,人类微血管内皮细胞在缺氧和酸性环境下,CXCR7表达是上升的。由此可见,CXCR7的表达存在一定的组织特异性,它在不同的细胞系及发育阶段、激素调节和疾病等相关生理病理过程中,表达量明显不同。
3 CXCR7对CXCL12生物学功能的影响
7-TMRs通常作为治疗疾病的靶点受体,然而对CXCR7在作为独立受体和HIV共受体方面的功能研究明显晚于CXCR4[18]。随着许多实验方法的发展与完善,CXCR7在CXCL12诱导细胞迁移和黏附、促进细胞增殖及存活、促进血管新生和调节细胞分化等方面的功能已得到大量证实。
3.1 CXCR7对CXCL12诱导细胞迁移和黏附的影响
有大量研究表明,CXCR7对CXCL12诱导的细胞黏附与迁移主要发生在胚胎发育、骨髓象、肿瘤转移和免疫疾病中。大部分淋巴细胞CXCR4/CXCR7异二聚体的形成,可以促进CXCL12的趋化性,但CXCR7促进迁移的效果取决于配体的表达量[19]。而在胚胎发育过程中,集体迁移是重要的标志之一[20]。斑马鱼的有关实验中,原始干细胞的迁移主要是通过趋化因子CXCL12活化两个独立的受体 CXCR4b[21]和 CXCR7[22]来诱导的,而CXCR7的沉默表达则是通过Wnt/β-抑制蛋白信号通路来调节[20]。同时,有研究者[23]发现,在中间神经元迁移形成外皮质板的过程中,CXCR7是短暂表达的,并且CXCR7比CXCR4的作用更明显。有报道[24]指出,虽然在CXCL12刺激的整联蛋白活化或CD34+祖细胞和T淋巴细胞的活性方面,CXCR7并没有起到作用,但它可以维持B细胞在骨髓中的量保持不变,并且CXCL12与CXCR7的结合可以减少骨髓中趋化因子的水平,从而促进干细胞再生。而在有严重肾脏损害的小鼠模型里可以看到,CXCL12诱导的迁移过程中,CXCR7在肾祖细胞黏附到内皮细胞上起到了关键作用[25]。对肿瘤的研究[15,26]发现,CXCR7在前列腺肿瘤细胞的侵袭和转移中起到了重要作用;而在乳腺癌细胞中,CXCR7的过表达也增强了肿瘤细胞与内皮脐静脉细胞的黏附[6]。另外,有研究者[27]发现,自身免疫疾病内皮中,CXCR7的过表达对炎症的浸润起到了关键作用。在病理过程中,内皮细胞CXCR7的过表达对于增强细胞黏附也是至关重要的。
3.2 CXCR7对CXCL12促进细胞增殖及存活的影响
有学者研究发现,CXCL12/CXCR7这一信号轴在不同的病理进程尤其是肿瘤发展过程中,可促进细胞的增殖和存活。在正常的人类造血干/祖细胞上,只观察到了极低水平的CXCR7表达,并且这个受体在细胞的增殖过程中没有起到直接作用[9],表明在疾病发生时,CXCR7的误调节可能促进了细胞增殖。例如,CXCR7是促进被EB病毒感染的淋巴细胞增殖的重要因素,敲除CXCR7则抑制了这些细胞的存活和扩增[28]。另外,在急性肾功能衰竭下的肾祖细胞和在低氧环境下的神经祖细胞,也是通过CXCR7受体来激活CXCL12诱导的存活信号转导[25,29]。有报道[30]指出,CXCR7信号促进肿瘤细胞增殖及存活,在前列腺癌细胞系中,CXCR7通过促进CXCL12介导的细胞存活、黏附和趋化作用调节细胞增殖;在结肠癌和胰腺癌细胞株中,CXCL12/CXCR7轴也显著促进了细胞增殖;在乳腺癌中,CXCL12/CXCR7通过抗凋亡作用间接地促进了细胞增殖[31]。经CXCR7转染的人乳腺癌或肺癌细胞株,在免疫缺陷小鼠体内能长成较大的肿瘤,而采用siRNA下调CXCR7的表达则体内生长的肿瘤较小,这也证明CXCR7促进了肿瘤细胞的增殖和存活[32]。
3.3 CXCR7对CXCL12促进血管新生的影响
CXCR7对CXCL12促进血管新生主要表现在胚胎发育中的血管发生,以及肿瘤生长和转移过程中的新生血管形成。例如,CXCR7缺陷小鼠由于严重的心脏损害,在24h内超过95%的围产期死亡率,而这种致命的表型就是由于内皮细胞CXCR7表达的严重缺乏而导致的。通过对CXCR7表达阴性的小鼠基因分析表明,该受体的表达对瓣膜形成、血管保护或内皮细胞的生长及存活是至关重要的[12]。CXCR7和CXCR4在CXCL12介导的大鼠骨髓来源内皮祖细胞(endothelial progenitor cell,EPC)参与血管生成的过程中,发挥着缺一不可的作用。在调节EPCs黏附、掺入基质、跨内膜转移和形成血管样结构的过程中,CXCR7和CXCR4共同参与调节;而CXCL12调节EPCs在应激条件下的存活能力,是通过受体CXCR7而不是CXCR4相互作用而实现的[33]。进一步考察了CXCR7在人脐带血来源EPCs中的作用,结果[34]发现,CXCR7在人脐带血来源EPCs中的作用与大鼠骨髓源EPCs中的作用大体一致,表明CXCR7在EPCs归巢和参与血管生成的过程中发挥着重要作用,可能是血管生成相关疾病治疗的又一新靶点。另外,通过对斑马鱼CXCR7基因的敲除,间接证明了CXCR7在血管发生与形成过程中的关键作用[15]。而在鼠的乳腺癌细胞中,CXCR7的过表达通过增强血管形成来促进肿瘤生长。Kollmar等[32]将CXCR7抗体注入皮下种植肿瘤的小鼠腹腔后,能显著减少其成瘤组织的新生血管密度,从而减缓小鼠皮下肿瘤生长速度。另有研究者发现,在人类乳腺癌、肺癌和黑色素瘤中,与肿瘤相关的血管中CXCR7是高表达的,而在正常的血管中并不表达。刘臻等[35]发现,肝癌组织中有CXCL12及CXCR7蛋白的表达,同正常肝组织相比,表达量明显升高,并且CXCL12表达与门静脉癌栓有关,CXCR7表达与肝内病灶数目和门静脉癌栓有关,提示CXCL12/CXCR7生物学轴通过促进新生血管生成,参与肝细胞癌的侵袭和转移。另外,在人类前列腺癌和膀胱癌细胞中,CXCR7也调节了促血管生长因子IL-8和VEGF的表达和分泌,从而进一步促进了肿瘤血管的形成[26,30]。这些结果表明,在阻止肿瘤血管形成方面,CXCR7可能会成为好的靶点。
3.4 CXCR7对CXCL12细胞分化的影响
既往研究[10,36]表明,CXCL12是通过CXCR4来调节细胞分化,如今越来越多的证据证明,CXCR7在细胞分化中也起到了调节作用。例如,CXCR7和CXCR4受体被证明都参与了肌细胞和单核-巨噬细胞的分化作用[36]。在单核细胞和T细胞中,CXCL12通过与CXCR4和CXCR7相结合,下调转录因子RUNX3的水平,以沉默CD4表达,促进细胞向CD8+胸腺细胞分化[37]。另外,CD8+T细胞CXCR7表达的减少,证明了CXCL12/CXCR7信号通路在阻止CD4沉默表达方面起关键作用,且血液中记忆B细胞CXCR7的表达量也与其分化到浆细胞的能力密切相关[10]。
4 CXCL12/CXCR7的作用机制研究
一般认为,趋化因子是通过7-TMRs来传递信号。有报道[38-39]指出,7-TMRs具有共同的催化作用机制,并且这个机制不依赖与之结合的配体结构,配体与受体的细胞外部分结合触发了它们在TM区域的重组和细胞内部分的构象变化,允许蛋白质的结合,从而初始化下游信号通路。但对于有关CXCR7作用机制的研究尚存在很大争议,与传统的趋化因子受体表达经典的DRYLAIV(Asp-Arg-Tyr-Leu-Ala-Ile-Val)模式不同[12],CXCR7表达DRYLSIT(Asp-Arg-Tyr-Leu-Ser-Ile-Thr)模式,并且脱离了G蛋白调节的信号通路,因此,它被归为非典型趋化因子受体群[40]。有研究者[41]发现,CXCL12或CXCL11与CXCR7结合可以稳定CXCR7与β-抑制蛋白之间的作用。而CXCR7通过与β-抑制蛋白-2信号通路的结合来实现趋化因子的细胞内吞作用也已经被证实[7,42]。CXCR7被普遍接受作为一个清道夫受体来发挥作用,从而使CXCL12从细胞外环境移除。CXCL12通过与CXCR7结合导致细胞内吞,使CXCL12转移到溶酶体,并且使 CXCR7重新回到细胞膜上[7,42]。虽然,其他研究者并没有观察到细胞表达内源性CXCR7的浓度达到饱和,但仍有人提出,在CXCR7转染细胞内高浓度配体阻止了CXCR7的重复再利用,并且这一结果与它作为CXCL12和CXCL11的清道夫受体作用相一致[42]。相关报道[12]证明,CXCR7对G蛋白信号通路的调节是由于它与CXCR4形成的异二聚体的作用,这些异二聚体可增强CXCL12诱导的钙信号转导和延迟ERK的活化,但越来越多的报道支持CXCR7是完全独立于G蛋白的信号受体(图1)。
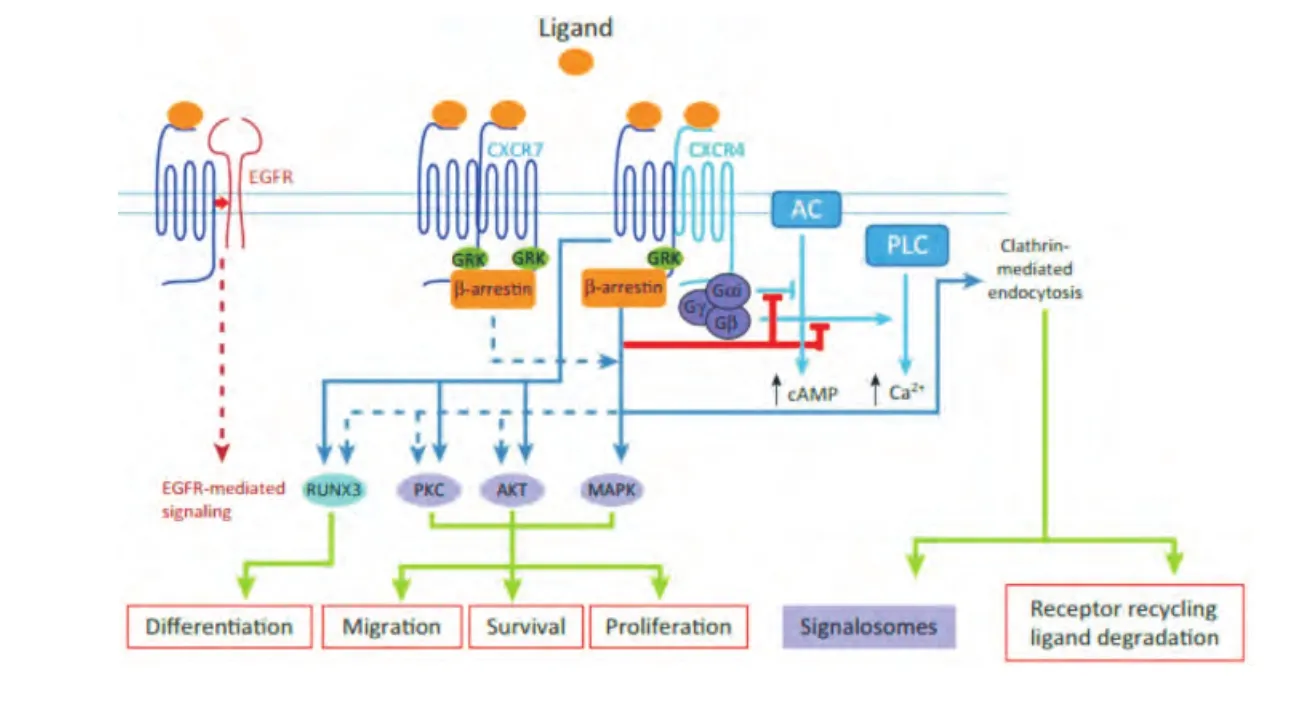
图1 CXCR7独立于G蛋白作用机制示意图
在前列腺癌、神经胶质瘤、横纹肌肉瘤、星型细胞和施万细胞中,观察到CXCL12通过与CXCR7结合直接活化 Akt途径[16,26]。Rajagopal等[43]证实CXCR7以独立于配体和G蛋白的方式,通过募集β-抑制蛋白-2进行信号传导。而与这些结果相一致的是,CXCR7/CXCR4的共表达导致了β-抑制蛋白的募集,从而促进了CXCL12介导的、依赖β-抑制蛋白的下游信号转导,包括ERK1/2、p38MAPK和SAPK等路径,同时也提出,CXCR7通过β-抑制蛋白路径来诱导细胞迁移[44]。并且,与传统G蛋白介导的信号通路相比,β-抑制蛋白介导的信号转导可以维持更长的时间。
综上所述,CXCR7的表达和功能均存在一定的组织和细胞特异性,在许多病理过程如炎症和肿瘤发生发展过程中,CXCR7的表达显著上调,因此,CXCR7受体可能是这些疾病治疗的重要靶点。但是,CXCR7的作用机制尚存在很大争议。有研究者认为,CXCR7是一个清道夫受体,通过调节环境中CXCL12的水平,参与CXCR4信号的调节;另有研究者认为,CXCR7是通过与CXCR4形成异二聚体,参与CXCL12作用的调节;还有研究者认为,CXCR7是独立于G蛋白的信号受体。因此,CXCR7受体作为治疗的靶点及其作用机制将是下一步的研究重点,尤其CXCR7拮抗剂/抑制剂在抗癌、抗转移和抗炎治疗中的研究,将会引起越来越多的重视及关注。
[1]Libert F,Parmentier M,Lefort A,etal.Selective amplification and cloning of four new members of the G protein-coupled receptor family[J].Science,1989,244(4904):569-572.
[2]Muller A,Homey B,Soto H,etal.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
[3]Li M,Ransohoff RM.The roles of chemokine CXCL12in embryonic and brain tumor angiogenesis[J].Semin Cancer Biol,2009,19(2):111-115.
[4]Karin N.The multiple faces of CXCL12(SDF-1α)in the regulation of immunity during health and disease[J].J Leukoc Biol,2010,88(3):463-473.
[5]Kucia M,Jankowski K,Reca R,etal.CXCR4-SDF-1 signalling,locomotion,chemotaxis and adhesion[J].J Mol Histol,2004,35(3):233-245.
[6]Burns JM,Summers BC,Wang Y,etal.A novel chemokine receptor for SDF-1and I-TAC involved in cell survival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[7]Balabanian K,Lagane B,Infantino S,etal.The chemokine SDF-1/CXCL12binds to and signals through the orphan receptor RDC1in T lymphocytes[J].J Biol Chem,2005,280(42):35760-35766.
[8]Eva C,Sprengel R.A novel putative G protein-coupled receptor highly expressed in lung and testis[J].DNA Cell Biol,1993,12(5):393-399.
[9]Tarnowski M,Liu R,Wysoczynski M,etal.CXCR7:a new SDF-1-binding receptor in contrast to normal CD34(+ )progenitors is functional and is expressed at higher level in human malignant hematopoietic cells[J].Eur J Haematol,2010,85(6):472-483.
[10]Infantino S,Moepps B,Thelen M.Expression and regulation of the orphan receptor RDC1and its putative ligand in human dendritic and B cells[J].J Immunol,2006,176(4):2197-2207.
[11]Delgado-Martin C,Escribano C,Pablos JL,etal.Chemokine CXCL12uses CXCR4and a signaling core formed by bifunctional Akt,extracellular signal-regulated kinase(ERK)1/2,and mammalian target of rapamycin complex 1(mTORC1)proteins to control chemotaxis and survival simultaneously in mature dendritic cells[J].J Biol Chem,2011,286(43):37222-37236.
[12]Sierro F,Biben C,Martinez-Munoz L,etal.Disrupted cardiac development but normal hematopoiesis in mice deficient in the second CXCL12/SDF-1receptor,CXCR7[J].Proc Natl Acad Sci U S A,2007,104(37):14759-14764.
[13]Boudot A,Kerdivel G,Habauzit D,etal.Differential estrogen-regulation of CXCL12chemokine receptors,CXCR4 and CXCR7,contributes to the growth effect of estrogens in breast cancer cells[J].PLoS One,2011,6(6):20898.
[14]Werner L,Elad H,Brazowski E,etal.Reciprocal regulation of CXCR4and CXCR7in intestinal mucosal homeostasis and inflammatory bowel disease[J].J Leukoc Biol,2011,90(3):583-590.
[15]Miao Z,Luker KE,Summers BC,etal.CXCR7(RDC1)promotes breast and lung tumor growth in vivo and is expressed on tumor-associated vasculature[J].Proc Natl Acad Sci U S A,2007,104(40):15735-15740.
[16]Hattermann K,Held-Feindt J,Lucius R,etal.The chemokine receptor CXCR7is highly expressed in human glioma cells and mediates antiapoptotic effects[J].Cancer Res,2010,70(8):3299-3308.
[17]Monnier J,Boissan M,L'Helgoualc'h A,etal.CXCR7is upregulated in human and murine hepatocellular carcinoma and is specifically expressed by endothelial cells[J].Eur J Cancer,2012,48(1):138-148.
[18]Shimizu N,Soda Y,Kanbe K,etal.A putative G proteincoupled receptor,RDC1,is a novel coreceptor for human and simian immunodeficiency viruses[J].J Virol,2000,74(2):619-626.
[19]Levoye A,Balabanian K,Baleux F,etal.CXCR7 heterodimerizes with CXCR4and regulates CXCL12-mediated G protein signaling[J].Blood,2009,113(24):6085-6093.
[20]Aman A,Piotrowski T.Wnt/β-catenin and Fgf signaling control collective cell migration by restricting chemokine receptor expression[J].Dev Cell,2008,15(5):749-761.
[21]Haas P,Gilmour D.Chemokine signaling mediates selforganizing tissue migration in the zebrafish lateral line[J].Dev Cell,2006,10(5):673-680.
[22]Dambly-Chaudiere C,Cubedo N,Ghysen A.Control of cell migration in the development of the posterior lateral line:antagonistic interactions between the chemokine receptors CXCR4and CXCR7/RDC1[J].BMC Dev Biol,2007,7:23.
[23]Wang Y,Li G,Stanco A,etal.CXCR4and CXCR7have distinct functions in regulating interneuron migration[J].Neuron,2011,69(1):61-76.
[24]Hartmann TN,Grabovsky V,Pasvolsky R,etal.A crosstalk between intracellular CXCR7and CXCR4involved in rapid CXCL12-triggered integrin activation but not in chemokinetriggered motility of human T lymphocytes and CD34+cells[J].J Leukoc Biol,2008,84(4):1130-1140.
[25]Mazzinghi B,Ronconi E,Lazzeri E,etal.Essential but differential role for CXCR4and CXCR7in the therapeutic homing of human renal progenitor cells[J].J Exp Med,2008,205(2):479-490.
[26]Wang J,Shiozawa Y,Wang J,etal.The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1in prostate cancer[J].J Biol Chem,2008,283(7):4283-4294.
[27]Cruz-Orengo L,Holman DW,Dorsey D,etal.CXCR7 influences leukocyte entry into the CNS parenchyma by controlling abluminal CXCL12abundance during autoimmunity[J].J Exp Med,2011,208(2):327-339.
[28]Lucchesi W,Brady G,Dittrich-Breiholz O,etal.Differential gene regulation by Epstein-Barr virus type 1and type 2 EBNA2[J].J Virol,2008,82(15):7456-7466.
[29]Bakondi B,Shimada IS,Peterson BM,etal.SDF-1αsecreted by human CD133-derived multipotent stromal cells promotes neural progenitor cell survival through CXCR7[J].Stem Cells Dev,2011,20(6):1021-1029.
[30]Hao M,Zheng J,Hou K,etal.Role of chemokine receptor CXCR7in bladder cancer progression [J].Biochem Pharmacol,2012,84(2):204-214.
[31]Meijer J,Ogink J,Roos E.Effect of the chemokine receptor CXCR7on proliferation of carcinoma cells in vitro and in vivo[J].Br J Cancer,2008,99(9):1493-1501.
[32]Kollmar O,Rupertus K,Scheuer C,etal.CXCR4and CXCR7 regulate angiogenesis and CT26.WT tumor growth independent from SDF-1[J].Int J Cancer,2010,126(6):1302-1315.
[33]Dai X,Tan Y,Cai S,etal.The role of CXCR7on the adhesion,proliferation and angiogenesis of endothelial progenitor cells[J].J Cell Mol Med,2011,15(6):1299-1309.
[34]Yan X,Cai S,Xiong X,etal.Chemokine receptor CXCR7 mediates human endothelial progenitor cells survival,angiogenesis,but not proliferation[J].J Cell Biochem,2012,113(4):1437-1446.
[35]刘臻,孙达欣,孟祥鹏,等.SDF-1/CXCR7在肝细胞癌中的表达及临床意义[J].现代肿瘤医学,2012,20(4):762-764.
[36]Melchionna R,Di Carlo A,De Mori R,etal.Induction of myogenic differentiation by SDF-1via CXCR4and CXCR7 receptors[J].Muscle Nerve,2010,41(6):828-835.
[37]Collins A,Littman DR,Taniuchi I.RUNX proteins in transcription factor networks that regulate T cell lineage choice[J].Nat Rev Immunol,2009,9(2):106-115.
[38]Xu F,Wu H,Katritch V,etal.Structure of an agonist-bound human A2Aadenosine receptor[J].Science,2011,332(6027):322-327.
[39]Rasmussen SG,DeVree BT,Zou Y,etal.Crystal structure of theβ2adrenergic receptor-Gs protein complex[J].Nature,2011,477(7366):549-555.
[40]Graham GJ,Locati M,Mantovani A,etal.The biochemistry and biology of the atypical chemokine receptors[J].Immunol Lett,2012,145(1-2):30-38.
[41]Luker KE,Gupta M,Steele JM,etal.Imaging liganddependent activation of CXCR7[J].Neoplasia,2009,11(10):1022-1035.
[42]Luker KE,Steele JM,Mihalko LA,etal.Constitutive and chemokine-dependent internalization and recycling of CXCR7 in breast cancer cells to degrade chemokine ligands[J].Oncogene,2010,29(32):4599-4610.
[43]Rajagopal S,Kim J,Ahn S,etal.Beta-arrestin-but not G protein-mediated signaling by the"decoy"receptor CXCR7[J].Proc Natl Acad Sci U S A,2010,107(2):628-632.
[44]Decaillot FM,Kazmi MA,Lin Y,etal.CXCR7/CXCR4 heterodimer constitutively recruitsβ-arrestin to enhance cell migration[J].J Biol Chem,2011,286(37):32188-32197.

