DC—CIK技术联合奥沙利铂、吉西他滨化疗治疗进展期中央型非小细胞肺癌的临床研究
宿濛 秦宝丽
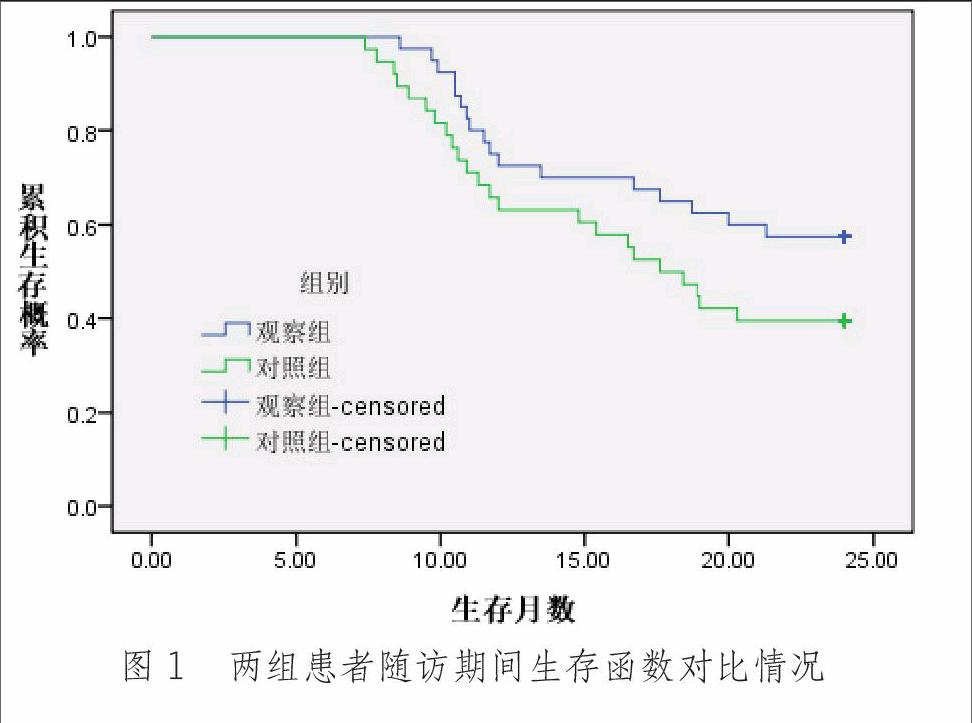

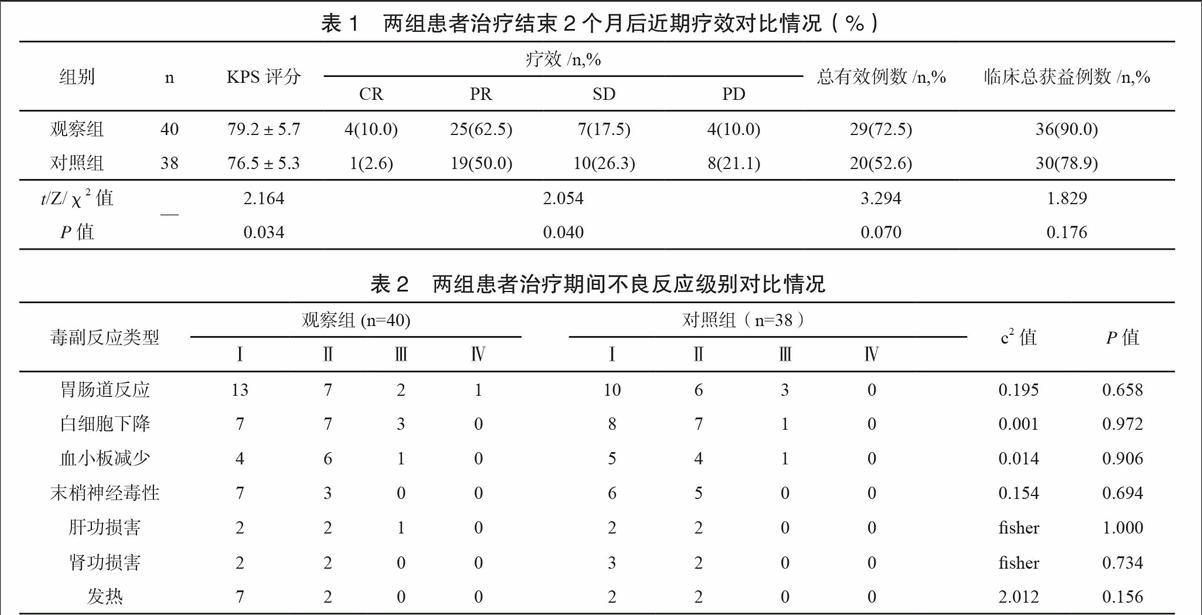
[摘 要] 目的:探讨树突状细胞(dendritic cells,DC)并细胞因子诱导的杀伤细胞(cytokine induced killers,CIK)联合培养体内回输技术联合奥沙利铂(L-OHP)、吉西他滨(GEM)化疗治疗进展期中央型非小细胞癌肺癌(non-small cell lung cancer,NSCLC)的近远期临床疗效。方法:研究入选2010年7月-2011年12月间收治的78例进展期中央型NSCLC患者为研究对象,据随机数字分为观察组(40例)和对照组(38例),对照组给予L-OHP+GEM 4周期化疗方案,观察组在此基础上于化疗间隙给予DC-CIK细胞回输治疗,对比两组近期疗效、毒副反应并2年生存率。结果:治疗结束2个月后,观察组KPS评分(79.2±5.7)明显高于对照组(76.5±5.3) (t=2.164 P=0.034)。观察组近期总有效率(72.5%)、临床总获益率(90.0%)均高于对照组水平(52.6%、78.9%),但差异无统计学意义(χ2=3.294 P=0.070、χ2=1.829 P=0.176)。两组毒副反应类型及发生率相近,差异均无统计学意义(P>0.05)。治疗结束后随访24个月,观察组平均生存时间(19.4±0.9)月 vs.(17.2±1.0)月、2年生存率(57.5%vs.39.5%)均高于对照组,平均生存时间差异有统计学意义(t=10.223 P<0.001)。Log-rank检验显示两组生存时间分布差异无统计学意义(χ2=2.810 P=0.094)。结论:DC-CIK技术联合化疗较之姑息性化疗治疗进展期中央型NSCLC能在不增加毒副反应基础上,提高患者生活质量与疗效,并有延长患者生存时间,提高远期生存率趋势。
[关键词] 非小细胞肺癌;中心型肺癌;树突状细胞;细胞因子诱导的杀伤细胞;生存率
中图分类号:R734.2 文献标识码:A 文章编号:2095-5200(2015)02-031-04
DOI:10.11876/mimt201502011
非小细胞癌(non-small cell lung cancer,NSCLC)占肺癌发病率的70%-80%,进展期中央型肺癌因解剖因素很少有切除可能,主要依赖姑息性化疗或放疗治疗。而放疗可增加化疗药物毒性,化疗又可加重放疗带来的放射性损伤,无论是化疗还是放疗临床有效率仍不尽如人意[1]。癌症发生与发展与机体免疫功能密切相关,机体免疫监视功能受损则无法识别和清除恶变[2]。近年过继免疫生物疗法逐步应用于癌症治疗,该疗法通过将细胞因子诱导杀伤细胞(cytokine induced killer cell,CIK)回输患者体内 来增强机体细胞免疫功能,杀伤肿瘤细胞。其中,以树突状细胞(dendritic cell,DC)、CIK细胞联合培养回输体内抗肿瘤活性最强[3]。笔者近年来采用DC-CIK技术联合化疗治疗进展期中央型NSCLC,并进行了随机对照随访研究,结果报道如下。
1 资料与方法
1.1 资料来源
本院2010年7月-2011年12月间收治78例进展期中央型NSCLC患者为研究对象。入组标准:经穿刺病理检查确诊为中心型肺癌,国际抗癌联盟TNM分级Ⅲ期或以上,Karnofsky(KPS)评分60分以上,既往未接受放化疗治疗者且预计生存期6个月以上者。排除标准:治疗前凝血功能、肝肾功能异常者,治疗方案不耐受者,失访病例。78例患者中男42例,女36例,年龄4469岁,平均(57.2±5.5)岁;腺癌33例、鳞癌22例、鳞腺癌15例、肉瘤样癌8例。78例患者据入组顺序按照电脑产生随机数字分为观察组(40例)、对照组(38例),两组患者入组基础信息对比组间差异无统计学意义。
1.2 治疗方案
患者治疗方案均获得本人知情同意,并争得医院医学伦理委员会批准。两组化疗方案为L-OPH(5mg/支,赛诺菲(杭州)制药有限公司生产,批准文号:国药准字J20130004)130mg/m2加5% GS 500mL静脉3h内滴注,第1d。GEM(200mg/支,法国礼来有限公司生产,注册证号H20100300) 1200mg/m2 加0.9% NS 150mL静滴30min第1d,第8d。每28d为1化疗周期,连续化疗4个周期。观察组在此基础上给予DC-CIK生物免疫疗法[4]。具体为:化疗前1d通过细胞分离机与淋巴细胞分离液获取患者本人外周血单个核细胞。DC细胞培养:经淋巴细胞分离液密度梯度离心获得外周血单个核细胞,经RPMI1640培养液洗涤,置于BTN 无血清培养基中混悬,在 37℃、5% CO2培养箱中培养 4 h后加入GM-CSF(1000 U/mL)和I L-4 ( 5000 U/mL) 继续培养,每隔2d换液1 次,第5 d加入TNF-α (500U/mL)诱导成熟DC。CIK细胞培养:分离后淋巴细胞加入重组人IFN-γ(1 000 U/mL)和10%AB 型人血清RPMI1640培养液,24 h后加入小鼠抗人CD3单抗(100 ng/mL)、IL-2(1000 U/mL),以后隔天半量换液维持培养。DC-CIK 细胞联合培养:收获第7dDC 细胞及CIK 细胞按按1∶5计数混合培养3d,隔天补加IL-2(1000 U/mL)培养液。在化疗周期间隔第2、4、6、8、10d,将DC-CIK细胞用100mL0.9% NS液回输体内,每次回输细胞4~5×109个,5次为1疗程,使用4个疗程。治疗过程中出现胃肠道反应、骨髓抑制、肝肾功损害等对症处理。
1.3 观察指标
近期临床疗效判定[5]:治疗结束2个月后复查胸部CT据WHO实体瘤客观疗效标准判定近期化疗效果。总有效例数=CR数+PR数,临床获益例数=CR数+PR数+SD数。
毒副反应:每个治疗周期常规监测临床生化指标并记录药物毒性反应,参照NCI-CTCAE(National Cancer Institute Common Terminology Criteria for Adverse Events) 3.0版标准评价治疗期间药物毒副反应。
生存率:自治疗结束后随访24个月,计算生存期、生存率,生存期以到死亡或随访结束为止。
1.4 统计学方法
数据由Epidata软件建立数据库并用SPSS19.0软件进行统计学分析,组间定量资料平均数用x±s表示,定量数据比较采用t检验,构成比数据比较采用χ2检验或fisher精确概率法,等级数据比较采用Wilcoxon-W秩和检验,生存时间计算采用Kaplan-Meier法,α取双侧检验,P<0.05视为差别有统计学意义。
2 结果
2.1 近期疗效
治疗结束2个月后,患者胸痛、胸闷症状不同程度好转;观察组生活质量得分(KPS评分)明显高于对照组(P<0.05),两组近期疗效构成不同(P<0.05),观察组总有效率、临床总获益率均高于对照组水平,差异无统计学意义(P>0.05)。见表1。
2.2 毒副反应
两组治疗期间毒副反应见表2。经对症支持,两组均无因毒副反应退出病例;两组毒副反应类型及发生率相近,差异均无统计学意义(P>0.05)。
2.3 生存率分析
治疗结束后随访24个月,观察组平均生存时间、中位生存时间、1年及2年生存率均高于对照组,其中平均生存时间差异有统计学意义(P<0.05),见表3;Log-rank检验显示两组总体生存时间分布差异无统计学意义(χ2=2.810 P=0.094),见图1。
3 讨论
Ⅲ期中心性NSCLC治疗主要依赖于化疗或放疗。以铂类药物为核心,联合吉西他滨、长春瑞滨、多西他赛、足叶乙甙等药物组合方案是治疗进展期NSCLC一线方案[6]。笔者选用O-LHP+GEM中,O-LHP是第三代铂类化合物,通过与DNA结合形成铂化加合物,抑制肿瘤细胞DNA合成及修复。GEM为核苷酸还原酶抑制剂,主要作用于细胞周期中DNA合成期,促进DNA链断裂,抑制DNA合成及通过细胞毒作用促进癌细胞凋亡[7]。文献报道O-LHP+GEM姑息性化疗治疗晚期NSCLC有效率也仅为46.2-57.2%[8],本研究为52.6%。近年研究表明T淋巴细胞、NK细胞在免疫监视、杀伤肿瘤细胞方面具有关键作用,恶性肿瘤患者普遍免疫功能低下,加之放化疗带来骨髓抑制会加重患者免疫抑制,因此机体主动免疫抗肿瘤作用严重减弱[9]。因此,一种新治疗手段—过继性细胞免疫治疗 (adoptive cell Immunotherapy,ACI) 逐步成为临床继手术、放疗、化疗后第4种治疗手段。ACI是指将自身或同种异体免疫细胞在体外通过其他细胞因子激活并扩增,将达到一定数量免疫细胞回输患者体内,在不损伤机体免疫系统结构和功能前提下,增强细胞免疫功能,杀伤肿瘤细胞[10]。本研究即通过随机对照研究,探讨过继免疫生物疗法对肺癌疗效。
ACI疗法中,CIK 细胞是迄今为止已知最具肿瘤杀伤活性细胞毒性T细胞。CIK细胞是人外周血单个核细胞在体外经多种细胞因子刺激后获得一群异质性细胞,该细胞表面可以表达 CD3 和 CD56 这2种膜蛋白分子,兼有T淋巴细胞溶瘤活性和NK细胞非MHC限制性杀瘤特点。CIK细胞体外培养细胞表型发生变化,其细胞毒活性与增值能力大为增强,且对人体骨髓干细胞和造血祖细胞几乎没有毒性,因而在肿瘤生物治疗上表现出强大优势。CIK细胞进人体内活化后可以分泌IL-2、IL-6、TNF-a等多种细胞因子,此类因子可直接发挥细胞毒作用,并可诱导癌细胞表达Fas和FasL细胞表面分子,加速细胞凋亡。体外实验表明CIK细胞能诱导并加速人肺癌细胞株A549早期凋亡[11]。CIK细胞在体内受到其他因子刺激后,可以将胞浆颗粒释放到胞外,而促进癌细胞裂解[12]。DC细胞是目前功能最强专职抗原提呈细胞,成熟DC可通过Ⅱ型组织相容性抗原等途径呈递肿瘤抗原,诱导特异性免疫反应,抵制肿瘤细胞免疫逃逸。它既可有效诱导静止T细胞增殖,也可促进细胞毒性T淋巴细胞和辅助性T淋巴细胞生成[13]。将具有肿瘤抗原提呈能力DC细胞与细胞毒效应CIK细胞联合培养,理论上可明显提高CIK细胞毒活性。体外抗肿瘤研究表明DC-CIK细胞联合培养较CIK细胞表达更高水平CD3+/CD56+、CD3+/CD8+比例,患者免疫水平显著提高[14]。
刘芳等[15]报道CIK细胞回输联合培美曲塞二钠两周期化疗方案治疗晚期NSCLC,总体有效率(69.7% vs.32.1%)远高于单药培美曲塞二钠化疗组。郑林静等[16]通过DC-CIK培养回输联合酪氨酸激酶抑制剂治疗晚期肺癌,总体有效率达86.9%(40/46)。本研究中笔者在L-OHP+GEM姑息化疗基础上联合采用DC-CIK技术治疗中心型NSCLC,疗结束2个月后,观察组生活质量评分明显高于对照组,且临床总有效率、总获益率分别较之对照组提高了近20个、12个百分点,与上述结果相近;观察组平均生存时间较对照组延长了2个月,2年生存率提高了18个百分点,说明伴随患者体内免疫状态改善,化疗疗效与预后均有所改善。除发热外两组毒副反应类型及发生率相近,观察组发热发生率(22.5%)高于对照组(10.5%)水平,可能与细胞离心分离时清洗不彻底或与患者过敏有关,但发热症状多数较轻,均表现为一过性,未影响到序贯治疗。
综上所述,DC-CIK技术联合化疗较之姑息性化疗治疗进展期中央型NSCLC能在不增加毒副反应基础上,提高患者生活质量与疗效,并有延长患者生存时间,提高远期生存率趋势。
参 考 文 献
[1] Parashar B,Edwards A, Mehta R, et al. Chemotherapy significantly increases the risk of radiation pneumonitis in radiation therapy of advanced lung cancer[J]. Am J Chin Oncol, 2011,34(2):160-164.
[2] Li H,Yu JP, Cao S,et al.CD4 +CD25 + regulatory T cells decreased the antitumor activity of cytokine-induced killer (CIK) cells of lung cancer patients[J].J Clin Immunol,2007,27(3):317-326.
[3] 丛珊亭,时圣彬.DC/CIK在非小细胞肺癌中应用进展[J].实用癌症杂志,2012,27(3):315-317.
[4] 尤振宇,苏晓辉,刘洋. DC-CIK 生物治疗辅助介入化疗治疗中心型非小细胞肺癌临床疗效观察[J].肿瘤药学,2012,2(3):193-195.
[5] Schallier D,Neyns B,Fontaine C,et al.A novel triplet regimen with paclitaxel, carboplatin and gemcitabine (PACCAGE) as induction chemotherapy for locally advanced unresectable non small cell lung cancer (NSCLC)[J].Lung Cancer,2007,56(2):247-254.
[6] Bidoli P, Zilembo N, Cortinovis D,et al.Randomized phaseII three-arm trial with three platinum-based doublets in metastatic non-small-cell lung ancer.An ltanlian Trials n Medical Oneology study[J].Annals Oncology,2007,18(3):461-467.
[7] 卢进,尹序德,陈萍,等.吉西他滨联合奥沙利铂与联合顺铂治疗老年晚期非小细胞肺癌随机研究[J].现代预防医学,2008,35(13):2561-2563.
[8] 李红霞,彭丽娟,葛磊,等.细胞因子激活杀伤细胞治疗晚期肺癌研究[J].安徽医药,2012,16(12):1798-1799.
[9] Thore SH,Negrin RS,Contag CH. Synergistic antitumor effects of immune cell -viral biotherapy [J].Science.2006,311(5768):1780-1784.
[10] Kim HM,Kang JS,Lim J, et al. Inhibition of human ovarian tumor growth by cytokine-induced killer cells[J]. Arch Pharm Res, 2007,30(11):1464-1470.
[11] 师岩,张春晶,刘秀财.CIK细胞对人肺癌细胞A549凋亡作用影响[J].医学研究杂志,2010,39(5):61-63.
[12] Tuyaerts S,Meirvenne SV,Bonehill A,et al. Expression of human GITRL on myeloid dendritic cells enhances their immunostimulatory function but does not abrogate the suppressive effect of CD4+CD25+ regulatory T cells. [J].J L eukoc Biol,2007,82(1):1-13.
[13] Franceschetti M,Pievani A, Borleri G,et al. Cytokine-induced killer cells are terminally differentiated activated CD8 cytotoxic T-EMRA lymphocytes[J].Exp Hematol,2009,37(5):616-628.
[14] 邱辉,张俊萍,韩亚萍,等. DC-CIK与CIK体外抗肿瘤作用实验研究[J].当代医学,2013,19(30):21-23.
[15] 刘芳,于雁,张华.化疗联合CIK细胞回输治疗老年晚期非小细胞肺癌成本原效果分析[J].实用肿瘤药学,2011,25(4):336-338.
[16] 郑林静.生物细胞免疫治疗(DC+CIK)联合酪氨酸激酶抑制剂(易瑞沙)治疗肺癌疗效观察[J].中国医药指南,2012,10(25):129-130.

