同步辐射X线相衬成像技术在兔髌骨-髌腱连接点纤维软骨细胞的三维可视化应用研究
陈华斌 胡建中 周京泳 郑 成,3 王占稳 陈 灿 曹 勇 殷宪振 吕红斌
1(中南大学湘雅医院运动医学科 中南大学运动医学研究中心 长沙 410008)2(中南大学湘雅医院脊柱外科 长沙 410008)3(武汉体育学院医院 武汉 430079)4(中国科学院上海药物研究所 药物释放系统研究中心 上海 201203)
同步辐射X线相衬成像技术在兔髌骨-髌腱连接点纤维软骨细胞的三维可视化应用研究
陈华斌1胡建中2周京泳1郑 成1,3王占稳1陈 灿1曹 勇2殷宪振4吕红斌1
1(中南大学湘雅医院运动医学科 中南大学运动医学研究中心 长沙 410008)2(中南大学湘雅医院脊柱外科 长沙 410008)
3(武汉体育学院医院 武汉 430079)4(中国科学院上海药物研究所 药物释放系统研究中心 上海 201203)
利用同步辐射X射线相衬成像技术(Synchrotron Radiation-based X-ray Phase-contrast Computed Tomography, SR-XPCT)对兔髌骨-髌腱连接点(Patella-Patellar Tendon Junction, PPTJ)移行区的纤维软骨细胞进行三维可视化及量化表征。正常骨成熟的新西兰PPTJ经多聚甲醛固定、梯度酒精脱水后,于上海光源X射线成像与生物医学应用光束线站进行扫描;采集的原始图像经数字减影、相位恢复、切片重构、位数转换后进行三维重构分析;标本扫描后进行传统组织学验证。SR-XPCT能成功获取PPTJ及其移行区纤维软骨细胞的三维高清图像,并对移行区纤维软骨细胞进行了量化表征:平均直径为(10.139±1.265) μm;平均体积为(291.187±87.283)μm3,体积分布在200−400 μm3之间的占75.4%;平均球形度为0.711±0.079,球形度在0.605−0.805之间的纤维软骨细胞约占84.9%。SR-XPCT作为一种先进的、直观准确的可视化骨腱连接点的三维微观形态结构研究方法,为骨腱连接点损伤修复的三维形态学研究提供了新方法、新思路。
同步辐射,相位衬度成像,骨腱连接点,纤维软骨细胞,三维
骨腱连接点是肌腱、韧带等与骨相接合的部位,具有复杂的梯度解剖学结构,如兔髌骨-髌腱连接点(Patella-Patellar Tendon Junction, PPTJ)由髌骨、钙化的纤维软骨层、未钙化纤维软骨层和髌腱典型的4层结构构成[1]。这种独特的组织结构依靠纤维软骨层使骨与腱很好地锚定在一起,从而分散骨与腱之间的应力负荷,有利于骨与腱之间力学负荷的传导,从而维持骨肌系统联动过程中的稳定和平衡[2]。当骨腱连接点损伤时,移行区纤维软骨层被破坏,由于该部位血供差,再生能力弱,使得骨腱连接点的损伤修复十分缓慢而困难[1,3−4]。有研究显示,前交叉韧带重建术后两年仍未见移植腱与骨隧道界面很好的融合在一起[5],而肩袖修补术的失败率则高达20%−94%不等[6−7]。
骨腱连接点损伤后的愈合是三维形态的,组织形态学方法是评估骨腱连接点损伤修复有效直观的研究手段。传统组织形态学研究方法借助组织学切片染色技术从二维角度来观察组织的形态结构特点,无法提供其内部三维特征,并且在切片过程中会伴随着组织结构的损失。对此,迫切需要一种既能实现样本无损观察,又能清晰呈现样本三维形态结构的研究手段。
自1895年德国科学家伦琴首次发现X射线[8]以来,X射线随即被广泛应用于医学诊断及医学研究。然而,以记录吸收衬度为主的传统X射线成像方法因其空间分辨率低、对X射线弱吸收的物体成像质量不佳等缺点,已远不能满足研究学者们愈来愈高的成像需求。基于第三代同步辐射光源的X射线相衬CT成像(Synchrotron Radiation-based X-ray Phase-contrast Computed Tomography, SR-XPCT)技术利用X射线透过样品后携带的相位变化信息对样品内部结构进行无损成像,是近年来国内外用于生物医学领域的一种新的成像技术。它可获得X射线弱吸收样品内部结构的二维或三维图像,是研究X射线弱吸收样品内部结构的强有力的工具[9−10]。
上海同步辐射光源作为我国首台第三代中能同步辐射装置,得益于其高亮度、高光子通量、高准直性、高极化性、高相干性及宽频谱范围的特性,同时结合高分辨率的X射线成像CCD (Charge Coupled Device) 探测器,SR-XPCT技术突破了传统X射线吸收成像的瓶颈,成为迄今为止探测轻元素材料或生物组织的微米级甚至亚微米级结构最好的工具[11],使得对细胞水平的成像成为可能[12],现已成功运用于微脉管系统[13−16]、肺细支气管[17]、材料[18]以及化石考古[19]等领域的研究中。因此,我们试图利用该先进技术来研究PPTJ的三维形态结构,构建一种新的骨腱连接点三维微观形态评估方法。
1 材料和方法
1.1 样品准备
本实验已获得中南大学动物伦理委员会的批准。
健康骨成熟的新西兰兔3只(雌性,(3.0±0.1)kg,中南大学实验动物学部提供)。3%戊巴比妥麻醉过量致死,取右后肢髌骨-髌腱连接点,4%多聚甲醛固定24 h,蒸馏水冲洗2 h,分别置于浓度为75%、85%、95%、100%的酒精中梯度脱水,每个浓度梯度脱水4 h,自然风干,干燥环境下真空保存。
1.2 同步辐射成像
本实验在中国科学院上海应用物理研究所上海光源(Shanghai Synchrotron Radiation Facility, SSRF) X射线成像与生物医学应用光束线站(BL13W1,图1)完成。BL13W1提供了能量在8.0−72.5 keV的高相干单色光束,最大光斑尺寸48 mm(H)×5 mm(V),样品台固定于光源下游34 m处,CCD探头位于一个可调控的导轨上[20]。
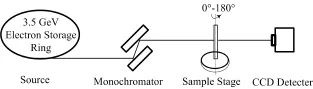
图1 上海光源BL13W1光束线实验站示意图Fig.1 Schematic of BL13W1 beamline experimental station at SSRF.
1.2.1 成像参数
为获得较高的图像分辨率和对比度,设定光子能量15 keV,样品距探测器10 cm,曝光时间1.0 s。将标本切割至满足扫描视场大小要求(标本宽度<1.3 mm),牢靠固定于连续旋转的载物台中央进行0°−180°显微CT成像,采用16 bit X射线探测器CCD采集原始投影图像(Tomo)、背景图像(Flat)及暗场图像(Dark),CCD的分辨率为0.65 μm。
1.2.2 数据处理
如图2所示,原始投影图像经Image-Pro Plus 6.0软件(National Institutes of Health,美国)行对比度调整、低通滤波、锐化增强和背景减影等优化处理,通过PITRE软件(BL13W1组编写)使用相位-吸收二重性Paganin算法(Phase-attenuation Duality Paganin Algorithm, PAD-PA)相位恢复算法[21−22]对原始投影图像进行相位恢复处理,再使用滤波反投影算法对相位恢复后的投影数据进行切片重构,获取的16位断层图像经位数转换后得到8位的断层图像。将8位断层图像导入VG Studio Max 2.1(Volume Graphics GmbH,德国)软件进行三维重构分析,获取PPTJ高清三维形态结构图像。通过基于灰度值的阈值分割及赋色渲染,获得纤维软骨层软骨细胞图像,测量其直径,利用软件获取纤维软骨细胞的体积和球形度等量化形态参数。

图2 成像及图像处理过程Fig.2 Scanning and image processing.
1.3 番红-快绿染色
标本扫描完成后,依次置于100%、95%、85%、75%梯度酒精入水(每个梯度2 h)。置于20% EDTA液脱钙中脱钙两个月,每三日更换一次脱钙液。经X线检测脱钙完全后行石蜡包埋、切片、番红-快绿(Sigma,美国)染色,置于光学显微镜(Olympus CX31,日本)下观察采图进行组织学验证。
1.4 统计学分析
所有定量数据使用SPSS 17.0进行统计学分析,结果用平均数±标准差(±SD)表示。
2 实验结果
将SR-XPCT技术获得的图像与组织学图像对比证实,该技术不仅能实现PPTJ的三维高清可视化,同时还能对其内部纤维软骨细胞进行量化描述。
2.1 投影图像及断层图像
SR-XPCT方式下的成像同时包含了X射线吸收像和相衬像。在投影图像上(图3(a)),髌骨-髌腱连接点标本与空气之间、标本内部各组织结构之间形成较明显的衬度信息,骨质(图3(a) ІΙІ)因对X射线吸收效应明显而呈现灰黑颜色,髌腱(图3(a) Ι)为X射线弱吸收组织,成像呈亮白颜色。髌骨区骨质排布紧密,髌骨与髌腱之间的移行区(图3(a) ІΙ)可见大量条索状、串珠样走形的结构,从髌骨侧到髌腱侧,呈现梯度渐变形态。
在横断层图上(图3(b)),髌骨与髌腱分界明显。髌骨骨质区(图3(b) ІΙІ)灰度值集中在110−255之间,其内散在分布大小、形状不一的腔隙结构,该结构可能为骨髓腔,腔隙内软组织的灰度值在65−100之间;髌腱区(图3(b) Ι)灰度值在40−90之间,区域内可见大量腱纤维样结构分布;髌骨与髌腱之间的移行区(图3(b) ІΙ)有近似圆形或椭圆形结构排布,该结构可能为移行区纤维软骨细胞或软骨陷窝,将其进行放大如图3(c)所示,结构内物质灰度值在70−135之间,测量其直径为11.315 μm;结构周围灰度值在100−235之间,提示其周围软骨基质钙化程度不一。在移行区的不同位置随机选取10个单个的圆形或椭圆形结构并测量其直径,其平均直径为(10.454±2.104) μm。

图3 同步辐射X射线投影图像(a)、图(a)的黑色方框位置的横断层图(b)和图(b)中的感兴趣区放大图(c) Ι:髌腱区,ІΙ:移行区,ІΙІ:髌骨区Fig.3 (a) X-ray projection image, (b) reconstructed tomography located in the black box of picture (a), (c) magnified image of the ROI in picture (b). Ι: Patellar tendon zone, ІΙ: Transition zone, ІΙІ: Patella zone
2.2 髌骨-髌腱连接点的三维高清图像
基于灰度值进行阈值分割和赋色渲染,获得兔髌骨-髌腱连接点的三维高清图像(图4(a))。图4(a)中左下角为灰度值较高的髌骨骨质区(图4(a) IV),右上角为灰度值较低髌腱区(图4(a) I),纤维软骨细胞、骨髓腔软组织等组织结构位于髌骨区和髌腱区之间的移行区(图4(a) II、III),其灰度值也介于髌骨和髌腱之间。
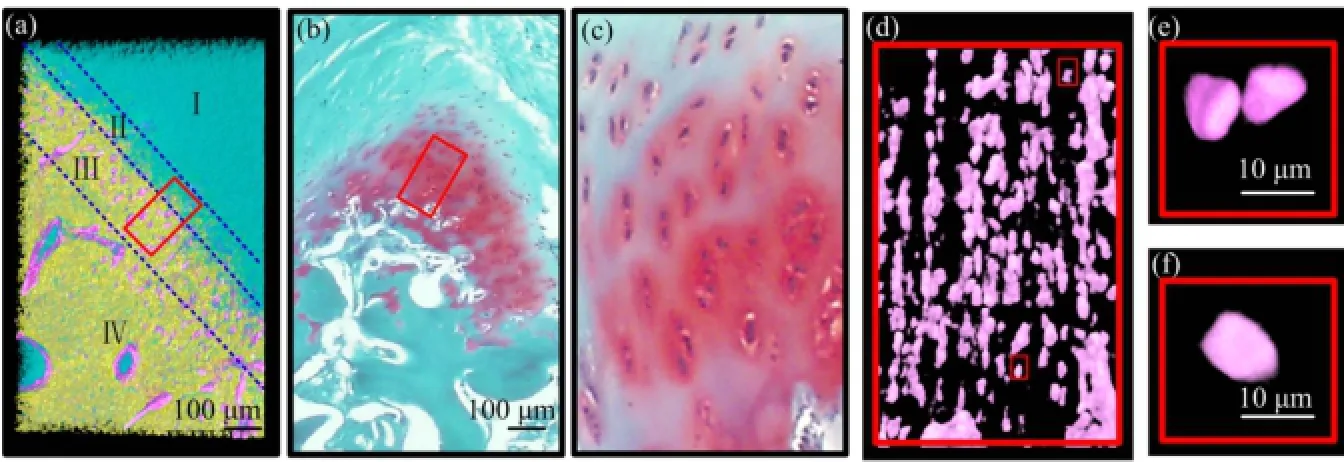
图4 PPTJ三维可视化图像(a)、组织学番红-快绿染色图(b)、图(b)感兴趣区放大图(c)、图(a)感兴趣区单独提取软骨细胞渲染后图像(d)以及图(d)感兴趣区放大的软骨细胞(e、f) I:髌腱区,II、III:移行区,IV:髌骨区Fig.4 (a) Rendered 3D image of rabbit PPTJ, (b) safranin O/Fast-green staining image, (c) magnified image of the ROI in picture (b), (d) rendered 3D image of extracted chondrocytes in the ROI of picture (a), (e, f) magnified 3D image of the ROI in picture (d). I: Patellar tendon zone, II and III: Transition zone, IV: Patella zone
在PPTJ三维高清图像中,髌骨显示区域(图4(a) IV)内可见大小、形状各异的空腔结构散在分布,其宽度与组织学图像(图4(b))中的骨髓腔相当。球形及椭球形结构密集分布于骨与肌腱之间的移行区(图4(a) ІΙ、ІΙІ),经测量得:该区域的平均厚度为(272.36±1.03) μm。此外,这些球形及椭球形结构大小不一,呈现单颗、成对、成群及串珠样排列。再者,这些球形及椭球形结构在图4(a) ІΙІ所示区域内,直径大小较在图4(a) ІΙ所示区域内大。经与原位组织学切片番红-快绿染色结果(图4(b))对比验证,发现这些球形及椭球形结构的形态、大小和排布与组织学图片中的纤维软骨细胞有一致性。将在移行区感兴趣内的纤维软骨细胞信息单独提取(图4(d)),可见移行区纤维软骨细胞的三维空间排布形态,其整体排布方向与组织学染色结果(图4(c))一致;选取其中的纤维软骨细胞进一步放大,得到单个(图4(f))及成对(图4(e))的纤维软骨细胞的三维形态。
2.3 量化描述纤维软骨细胞的三维微观形态
利用软件测量工具,可以测得单个纤维软骨细胞的直径。如图5(a)所示,测得该纤维软骨细胞的最短径L1=9.521 μm,最长径L2=11.291 μm,则该细胞的平均直径d=1/2(L1+L2)=10.406 μm。在移行区不同位置随机选取20个单个纤维软骨细胞,测量每个细胞的最长径和最短径,计算其平均直径,并将结果进行统计分析,得兔髌骨髌腱移行区单个纤维软骨细胞平均直径为(10.139±1.265) μm。利用软件获取移行区感兴趣内纤维软骨细胞的形态学量化参数,对不同体积及球形度的纤维软骨细胞进行计数。统计结果(图5(b)、(c))显示:移行区纤维软骨细胞的平均体积为(291.187±87.283) μm3,有75.4%的纤维软骨细胞体积分布在200−400 μm3之间,体积表征高者可能提示软骨细胞以二连体、三连体等多连体的形式存在。移行区软骨细胞的平均球形度为0.711±0.079,球形度在0.605−0.805之间的纤维软骨细胞约占84.9%,提示大部分纤维软骨细胞形态比较规则,为近似球形或椭球形。

图5 纤维软骨细胞直径测量图(a)、纤维软骨细胞体积(b)和细胞球形度(c)的频数统计图Fig.5 Image of diameter measurement (a), frequency statistics figure of the chondrocytes' volume (b) and sphericity (c).
3 讨论
骨腱连接点损伤是骨科和运动医学领域十分常见的损伤之一,常发生于前后交叉韧带、肩袖、跟腱、髌腱等与骨相连接的部位[23−26]。在美国,每年有超过10万例前交叉韧带损伤[27]和27万例肩袖损伤[28]需手术修复,由于骨腱连接点独特的解剖结构,使得其损伤后愈合十分缓慢低效。研究正常骨腱连接点的三维形态结构有助于我们进一步了解骨腱连接点损伤愈合过程中纤维软骨细胞等微观结构的三维形态学变化,为其生物功能学研究提供形态学理论基础。
研究骨腱连接点形态学的方法有很多,如:苏木精-伊红(Hematoxylin-eosin, H&E)染色法、番红-快绿染色法(Safranin O/Fast-green staining)、甲苯胺蓝染色法(Toluidine blue staining)、戈德纳三色染色(Goldner's trichrome staining)、偏振光显微镜分析(Polarizing microscope analyse)、免疫组织化学技术(Immunohistochemistry)等。其中,番红-快绿是软骨组织的常用染色方法之一,它能使骨-腱连接点纤维
软骨层中的蛋白多糖着色呈现橙红色,从而较好地提示骨腱连接点中纤维软骨细胞的排布和蛋白多糖含量[29]。本研究将同步辐射扫描后的样本脱钙后原位组织切片行番红-快绿染色,以验证利用SR-XPCT技术成像的三维可视化结果,二者一致。二者不能完全匹配的原因可能是脱钙、切片、染色过程中样本细节信息的丢失,以及二维的组织学切片与三维重建图片在比较过程中存在空间上的不对应。
随着影像学和软件处理技术的进步,越来越多的新技术已经被应用到骨腱连接点的三维形态研究中。高分辨率外周骨定量CT (High-resolution peripheral quantitative computed tomography, HR-pQCT)能对肢体末端的骨组织进行三维可视化,通过软件可进一步获取其骨矿化度、骨体积分数、骨小梁数目、骨小梁厚度及骨小梁间隙等量化信息,然而其空间分辨率只有80 μm级[30]。后来发展起来的微计算机断层扫描(Micro-CT)不仅可通过软件获取骨小梁的定量参数,还将成像分辨率提至10 μm级[31],并已广泛应用于骨和骨腱连接点的研究中[32],但micro-CT也是基于传统的X射线成像,其对肌腱等软组织的成像效果不佳。高分辨核磁共振成像(High-resolution Magnetic Resonance Imaging, HR-MRI)通过记录检测样本中水分子的氢元素在强磁场中的共振信息来实现成像[33],Benjamin等[34]利用磁共振成像UTE脉冲序列实现了骨腱连接点不同层次结构的成像,这种成像技术对骨髓等软组织能达到相对良好的衬度成像效果,然而其分辨率却远未达到细胞级。本研究利用SR-XPCT技术,结合高分辨(0.65 μm)的CCD探测器,利用相关图形处理软件,成功对骨腱连接点纤维软骨细胞进行三维可视化及量化表征,将骨腱连接点的研究提升至细胞级水平。
本实验研究对象PPTJ标本,既包括对X射线有强吸收效应的髌骨,也包括髌腱和纤维软骨等X射线弱吸收组织,传统的成像技术难以同时获得吸收系数相差较大的物质的高质量成像图像。实验前期,我们尝试了在不同能量、不同曝光时间及不同探测距离等条件下骨腱连接点成像效果,以期获得最佳实验参数。能量过高、曝光时间过长均会导致成像曝光过度,严重影响后续的轴心校准;反之,则导致曝光不足,样本成像显像不充分。SR-XPCT技术的成像既包括相衬成像,也包含有吸收成像,有研究表明,样品与探测器之间的距离对相衬成像质量的影响巨大,当距离过小时,成像以吸收像为主,达不到理想的相衬衬度;随着距离的增大,相衬信息逐渐变得丰富;当距离超过某个临界值时,相衬度反而下降,由于边缘展宽效应而使得成像边界变得模糊[35]。对于同时包含强、弱X射线吸收的骨腱连接点标本的成像,我们在尝试不同成像距离后,反复比照成像质量,认为样本与探测器距离为10 cm时,可获得最佳的相衬成像衬度,从而将骨腱连接点标本内部的细微结构进行高分辨的三维可视化,并将成像直达细胞级,同时对移行区的纤维软骨细胞进行三维形态学量化表征,得到单个纤维软骨细胞的平均直径,以及移行区纤维软骨细胞的体积分布和球形度分布。
虽然本方法有上述诸多优点,但是仍存在着一定的局限性。首先,高耀度、高相干性的同步辐射光源的产生需要一个庞大的造价昂贵的设备,因此这些都极大的限制了普通实验室的广泛应用以及在临床诊疗中的推广;其次,本研究采用的是分辨率为0.65 μm CCD探测器,其视场范围最大宽度为1.3mm,这给样本准备带来困难,也限制了大样本的成像需求;再者,扫描过程中水份蒸发导致样本组织形变,进而影响后续图形轴心校准及三维重建,故本研究采用严格的梯度酒精脱水来消除该组织形变,但也因此不能还原样本的自然状态,该问题将在我们的后续实验中探讨。随着影像学技术和图形软件技术的不断发展,上述问题也将会得到很好的解决。
4 结语
同步辐射X射线相衬成像技术可用于骨腱连接点三维微观结构的高清成像,并可进一步实现其三维形态学量化表征,丰富了骨腱连接点的三维微观解剖学认识,为骨腱连接点损伤修复的三维形态学研究提供了新的方法及思路。
致谢 感谢上海光源BL13W1 光束线站提供的科学实验平台;感谢上海光源肖体乔、彭冠云、付亚楠、杜国浩、陈荣昌、和友、王玉丹等老师在实验过程中提供的帮助。
1 Qin L, Leung K S, Chan C W, et al. Enlargement of remaining patella after partial patellectomy in rabbits[J]. Medicine and Science in Sports and Exercise, 1999, 31(4):
502−506
2 Bemjamin M, Ralph J R. Fibrocartilage in tendons and ligaments-an adaptation to compressive load[J]. Journal of Anatomy, 1998, 193: 481−494
3 Lu H, Qin L, Lee K, et al. Healing compared between bone to tendon and cartilage to tendon in a partial inferior patellectomy model in rabbits[J]. Clinical Journal of Sport Medicine, 2008, 18(1): 62−69. DOI: 10.1097/JSM. 0b013e31815c24ba
4 Wang L, Qin L, Cheung W H, et al. A delayed bone-tendon junction healing model established for potential treatment of related sports injuries[J]. British Journal of Sports Medicine, 2010, 44(2): 114−120. DOI: 10.1136/bjsm.2008.048041
5 Malinin T I, Levitt R L, Bashore C, et al. A study of retrieved allografts used to replace anterior cruciate ligaments[J]. Arthroscopy, 2002, 18(2): 163−170
6 Galatz L M, Ball C M, Teefey S A, et al. The outcome and repair integrity of completely arthroscopically repaired large and massive rotator cuff tears[J]. Journal of Bone and Joint Surgery-American Volume, 2004, 86A(2): 219−224
7 Harryman D T, Mack L A, Wang K Y, et al. Repairs of the rotator cuff. Correlation of functional results with integrity of the cuff[J]. Journal of Bone and Joint Surgery-American Volume, 1991, 73(7): 982−989
8 Arnadottir E. Radiology in one hundred years[J]. Laeknabladid, 1995, 81(11): 776−782
9 陈志华, 潘琳, 李红艳, 等. X射线相位衬度显微成像的原理与进展[J]. CT理论与应用研究, 2005, 14(1): 52−56 CHEN Zhihua, PAN Lin, LI Hongyan, et al. Principle and advancements of X-ray phase contrast micro-imaging[J]. CT Theory and Applications, 2005, 14(1): 52−56
10 陈绍亮, 张汐, 彭屹峰, 等. 同步辐射相位衬度成像医学应用初探[J]. 物理, 2010, 39(11): 765−769 CHEN Shaoliang, ZHANG Xi, PENG Yifeng, et al. Initial studies of synchrotron radiation phase-contrast imaging in the field of medicine[J]. Physics, 2010, 39(11): 765−769
11 肖体乔, 徐洪杰, 陈敏, 等. 一种新型X射线相衬成像实验室系统[J]. 核技术, 2003, 26(10): 743−747 XIAO Tiqiao, XU Hongjie, CHEN Min, et al. A new type of laboratory system for X-ray phase-contrast imaging[J]. Nuclear Techniques, 2003, 26(10): 743−747
12 Zhu Y, Earnest T, Huang Q, et al. Synchrotron-based X-ray-sensitive nanoprobes for cellular imaging[J]. Advanced Materials, 2014, 26(46): 7889−7895. DOI: 10.1002/adma.201304281
13 Hu J, Cao Y, Wu T, et al. 3D angioarchitecture changes after spinal cord injury in rats using synchrotron radiation phase-contrast tomography[J]. Spinal Cord, 2015, 53(8): 585−590. DOI: 10.1038/sc.2015.49
14 Zhang M Q, Su D N, Xie Y Y, et al. Three-dimensional visualization of rat brain microvasculature following permanent focal ischaemia by synchrotron radiation[J]. British Journal of Radiology, 2014, 87(1038): 20130670. DOI: 10.1259/bjr. 20130670
15 Li B L, Xu M, Wu W Z, et al. In-line X-ray phase-contrast imaging of murine liver microvasculature ex vivo[J]. Nuclear Science and Techniques, 2012, 23(1): 10−14
16 吴天定, 胡建中, 曾磊, 等. 同步辐射成像应用于大鼠脊髓微循环研究的方法学初探[J]. 核技术, 2011, 34(10): 726−730 WU Tianding, HU Jianzhong, ZENG Lei, et al. A preliminary study of spinal cord microvasculature using synchrotron radiation imaging[J]. Nuclear Techniques, 2011, 34(10): 726−730
17 Hwang J, Kim M, Kim S, et al. Quantifying morphological parameters of the terminal branching units in a mouse lung by phase contrast synchrotron radiation computed tomography[J]. Public Library of Science One, 2013, 8(5): e63552. DOI: 10.1371/journal.pone.0063552
18 彭冠云, 王玉荣, 任海青, 等. 基于同步辐射X射线相衬显微CT技术的竹木复合材料胶合界面特征研究[J].光谱学与光谱分析, 2013, 33(3): 829−833 PENG Guanyun, WANG Yurong, REN Haiqing, et al. Investigation of characteristic microstructures of adhesive interface in wood/bamboo composite material by synchrotron radiation X-ray phase contrast microscopy[J]. Spectroscopy and Spectral Analysis, 2013, 33(3): 829−833
19 Sanchez S, Ahlberg P E, Trinajstic K M, et al. Three-dimensional synchrotron virtual paleohistology: a new insight into the world of fossil bone microstructures[J]. Microscopy and Microanalysis, 2012, 18(5): 1095−1105. DOI: 10.1017/S1431927612001079
20 Xie H L, Deng B, Du G H, et al. Latest advances of X-ray imaging and biomedical applications beamline at SSRF[J]. Nuclear Science and Techniques, 2015, 26(2): 020102. DOI: 10.13538/j.1001-8042/nst.26.020102
21 Chen R C, Rigon L, Longo R. Comparison of single distance phase retrieval algorithms by considering different object composition and the effect of statistical and structural noise[J]. Optics Express, 2013, 21(6): 7384−7399. DOI: 10.1364/OE.21.007384
22 Groso A, Abela R, Stampanoni M. Implementation of a fast method for high resolution phase contrast tomography[J]. Optics Express, 2006, 14(18): 8103−8110
23 Musahl V, Abramowitch S D, Gabriel M T, et al. Tensile properties of an anterior cruciate ligament graft after bone-patellar tendon-bone press-fit fixation[J]. Knee Surgery Sports Traumatology Arthroscopy, 2003, 11(2): 68−74
24 Nebelung W, Becker R, Urbach D, et al. Histological findings of tendon-bone healing following anterior cruciate ligament reconstruction with hamstring grafts[J]. Archives of Orthopaedic and Trauma Surgery, 2003, 123(4): 158−163
25 Cheung E V, Silverio L, Sperling J W. Strategies in biologic augmentation of rotator cuff repair: a review[J]. Clinical Orthopaedics and Related Research, 2010, 468(6): 1476−1484. DOI: 10.1007/s11999-010-1323-7
26 Witt B L, Hyer C F. Achilles tendon reattachment after surgical treatment of insertional tendinosis using the suture bridge technique: a case series[J]. Journal of Foot and Ankle Surgery, 2012, 51(4): 487−493. DOI: 10.1053/j.jfas.2012.03.006
27 Brown T D, Johnston R C, Saltzman C L, et al. Posttraumatic osteoarthritis: a first estimate of incidence, prevalence, and burden of disease[J]. Journal of Orthopaedic Trauma, 2006, 20(10): 739−744
28 Colvin A C, Egorova N, Harrison A K, et al. National trends in rotator cuff repair[J]. Journal of Bone and Joint Surgery-American Volume, 2012, 94(3): 227−233. DOI: 10.2106/JBJS.J.00739
29 Lui P, Zhang P, Chan K, et al. Biology and augmentation of tendon-bone insertion repair[J]. Journal of Orthopaedic Surgery and Research, 2010, 5: 59−59. DOI: 10.1186/1749-799X-5-59
30 Boutroy S, Bouxsein M L, Munoz F, et al. In vivo assessment of trabecular bone microarchitecture by high-resolution peripheral quantitative computed tomography[J]. Journal of Clinical Endocrinology and Metabolism, 2005, 90(12): 6508−6515. DOI: 10.1210/jc.2005-1258
31 Muller R, Ruegsegger P. Micro-tomographic imaging for the nondestructive evaluation of trabecular bone architecture[J]. Studies in Health Technology and Informatics, 1997, 40: 61−79
32 Hu J, Zhang T, Xu D, et al. Combined magnetic fields accelerate bone-tendon junction injury healing through osteogenesis[J]. Scandinavian Journal of Medicine and Science in Sports, 2015, 25(3): 398−405. DOI: 10.1111/sms.12251
33 Carballido-Gamio J, Majumdar S. Clinical utility of microarchitecture measurements of trabecular bone[J]. Current Osteoporosis Reports, 2006, 4(2): 64−70
34 Benjamin M, Bydder G M. Magnetic resonance imaging of entheses using ultrashort TE (UTE) pulse sequences[J]. Journal of Magnetic Resonance Imaging, 2007, 25(2): 381−389
35 刘丽想, 杜国浩, 胡雯, 等. X射线同轴轮廓成像中影响成像质量的若干因素研究[J]. 物理学报, 2007, 56(8): 4556−4564 LIU Lixiang, DU Guohao, HU Wen, et al. Effect of some factors on imaging quality of X-ray in-line outline imaging[J]. Acta Physica Sinica, 2007, 56(8): 4556−4564
Three-dimensional visualization of fibrochondrocytes in rabbit patella-patellar tendon junction using synchrotron radiation-based X-ray phase contrast tomography
CHEN Huabin1HU Jianzhong2ZHOU Jingyong1ZHENG Cheng1,3WANG Zhanwen1CHEN Can1CAO Yong2YIN Xianzhen4LYU Hongbin1
1(Department of Sports Medicine and Research Center of Sports Medicine, Xiangya Hospital, Central South University, Changsha 410008, China) 2(Department of Spine Surgery, Xiangya Hospital, Central South University, Changsha 410008, China)
3(Hospital of Wuhan Sports University, Wuhan 430079, China) 4(Center for Drug Delivery System, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China)
Background: Synchrotron radiation-based X-ray phase-contrast computed tomography (SR-XPCT) is an advanced tool for nondestructive analysis of three dimensional inner microstructure of samples, and plays an important part in the researches such as spinal cord microvasculature and lung bronchium. Purpose: This study was to investigate the three-dimensional morphology of fibrochondrocytes in rabbit patella-patellar tendon junction (PPTJ) using SR-XPCT, and develop an advanced imaging method. Methods: Three PPTJs were harvested from healthy mature female New Zealand rabbits. The specimens were scanned by SR-XPCT at BL13W1 of Shanghai Synchrotron Radiation Facility (SSRF) in China. The tomographic image was captured by Charge Coupled Device (CCD) detector with a 0.65-μm resolution. The three-dimensional visualization images of PPTJ were reconstructed by VG Studio Max. After that, the specimens were embedded by paraffin for Safranin O/Fast-green staining. Results: High-resolution three-dimensional visualization images of PPTJ and the parameters of the chondrocytes in fibrocartilage zone were successfully obtained via the SR-XPCT. With spherical and ellipsoidal morphologic features and its configuration characteristics in three dimension, the fibrochondrocytes revealed by SR-XPCT were consistent with the results of traditional histological staining. The parameters of chondrocytes showed that the mean diameter of chondrocyte was (10.139±1.265) μm, the mean volume was (291.187±87.283) μm3and 75.4% of the chondrocytes' volume ranged from 200 μm3to 400 μm3, the mean sphericity degree was 0.711±0.079, and 84.9% of chondrocytes' sphericity degree ranged from 0.605 to 0.805. Conclusion: The three-dimensional microstructure of the PPTJ was intuitively, accurately and undistortedly realized by the SR-XPCT, which may act as a novel instrument to access the three-dimensional microstructure changes during the PPTJ healing process.
Synchrotron radiation, Phase contrast imaging, Bone-to-tendon junction, Fibrochondrocytes, Three-dimensional
TL99
10.11889/j.0253-3219.2015.hjs.38.110101
国家自然科学基金(No.8117169、No.84172072)资助
陈华斌,男,1990年出生,2013年毕业于华中科技大学,现为硕士研究生,研究方向为骨腱连接点的损伤与修复
吕红斌,E-mail: hongbinlu@hotmail.com
2015-09-01,
2015-10-14
CLC TL99

