稀土氟化物在硝酸中溶解性质的研究
仇婷婷 彭 佳 何淑华 郑小北 刘玉侠 周 伟 张 岚
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)2(中国科学院大学 北京 100049)
稀土氟化物在硝酸中溶解性质的研究
仇婷婷1,2彭 佳1,2何淑华1郑小北1刘玉侠1周 伟1张 岚1
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)2(中国科学院大学 北京 100049)
采用微波消解-电感耦合等离子体原子发射光谱(Inductively Coupled Plasma Atomic Emission Spectroscopy, ICP-AES),系统研究了钍铀燃料循环后处理中4种典型稀土氟化物(NdF3、EuF3、GdF3、CeF3)在硝酸中的溶解性质。结果表明,在10 mL、浓度为16 mol·L−1的硝酸中,微波消解2 h,190 ºC下,4种稀土氟化物的最大溶解量可达2.5−3.9 g·L−1,均比文献报道的数值高2−3个数量级;采用ICP-AES测试溶解液,线性范围0.999 47−0.999 96,标准偏差SD≤4.2% (n=3),该溶解方法旨在为核燃料后处理流程中含有难溶稀土氟化物的熔盐固溶体样品分析前处理提供参考。
微波消解,电感耦合等离子体原子发射光谱,稀土氟化物,硝酸,溶解
钍基熔盐堆(Thorium Molten Salt Reactor, TMSR)核燃料由钍、铀、锂和铍等的氟化物组成,液态氟化锂-氟化铍既用作熔盐堆的冷却剂,也用作核燃料的载体[1]。随着反应堆的运行,堆内生成多种裂变产物、超铀元素以及金属材料的腐蚀产物。稀土元素作为裂变产物的重要组成部分,是典型的中子毒物,即使含量很低时,对反应堆体系中子经济也会造成很大影响[2],因此需要严格控制稀土元素的含量。在后处理流程中,稀土元素的分离是核燃料重构的重要环节之一,通过稀土元素的化学定量分析结果计算相应的稀土分离系数,为改进工艺提供数据支撑。由于目前尚无混合氟化物熔盐固溶体的固体标准物质,无法对固体中某些元素的含量直接进行定量分析,因此需要将样品转化为溶液状态后再进行测试。但在后处理流程中样品分析时发现,含有大量稀土氟化物样品的测试结果不理想往往是源于试样溶解不完全。
文献调研发现[3],稀土氟化物在常见的溶解体系(如水、无机酸溶液)中的溶解率很低。Manchery等[4]研究表明镧系氟化物(NdF3、EuF3、GdF3、CeF3)在水中的溶解度仅为(3.14−13.33)×10−3g·L−1。在核化学和放射化学领域,稀土氟化物在硝酸体系中溶解性质的研究较多,日本学者Osamu等[5]在FLUOREX循环体系中研究了LaF3、CeF3、NdF3在硝酸体系中的溶解度,结果表明,三种稀土氟化物在浓度为6 mol·L−1硝酸中的溶解度仅为(2.74−62.38)×10−3g·L−1。稀土氟化物的难溶性、溶解度数据缺乏、溶解方法有限等因素为含有大量稀土氟化物样品分析的前处理带来了挑战。因此,采用合适的溶解手段,选取合适的溶解体系将试样完全转化成溶液,且保证溶解过程待测元素不挥发损失、不引入被测组分和干扰组分,对目前核燃料后处理的分析具有重要意义。
传统的敞口溶解方法,所需溶剂量大,易引入杂质;熔融法、半熔法需要高温条件,操作步骤复杂;干式灰化、湿式灰化主要用于有机试样的分解;微波消解技术是近年发展起来的一种样品处理方法,利用试样和适当的溶剂吸收微波能产生热量加热试样,同时微波产生的交变磁场使介质分子极化,极化分子在高频磁场交替排列导致分子高速振荡,使分子获得高能量。由于这两种作用,试样表层不断被搅动和破裂,因而迅速溶解,具有样品溶解完全、快速、溶剂用量少、空白值低及回收率高等优点。自1975年Abu-Sarma等[6]率先将微波加热用于生物样品湿法处理以来,微波消解技术在元素分析中的应用得到快速发展,使用微波消解处理样品,大大提高了分析测试速度。此外,微波消解与电感耦合等离子体原子发射光谱 (Inductively Coupled Plasma Atomic Emission Spectroscopy, ICP-AES)配套使用,提高了光谱仪的使用效率。例如钟林生[7]
采用微波消解与ICP-AES联用测定了土壤中10种稀土元素,检出限在0.2−38.2 μg·L−1,相对标准偏差(n=5)在0.8%−3.2%,但至今还未见将微波消解与ICP-AES联合用于研究稀土氟化物溶解性质研究的报道。
本文考虑现阶段后处理流程中的分析需求以及稀土氟化物的难溶性,利用微波消解溶样迅速和ICP-AES测样快速准确、精密度高等优点,采用施加微波的方式溶解几种单一稀土氟化物,并采取ICP-AES测试,以得出稀土氟化物在一定量硝酸中的溶解规律,为后续复杂组分样品的分析前处理提供基础参考数据。
1 实验部分
1.1 仪器和试剂
主要仪器:Mars6 Easyprep Plus微波消解仪,美国CEM公司;BHW-09C-12型石墨加热器,上海博通化学科技有限公司;Optima 8000型等离子体电感耦合原子发射光谱仪,美国Perkin Elmer公司;电子天平,0.01 mg,德国Sartorius集团;Thermo Scientific nanopure超纯水系统,美国Thermo Fisher Scientific公司。
实验试剂:去离子水;硝酸(质量分数:69.0%−72.0%),超纯,苏州晶瑞化学有限公司;硫酸(质量分数:98%),优级纯,国药集团化学试剂有限公司;NdF3、EuF3、GdF3、CeF3,纯度99.99%,无水,美国Aladdin公司;钕、铕、钆、铈标准溶液:1 000 mg·L−1,(2%−5%) HNO3,美国SPEX公司。
1.2 仪器参数
1.2.1 微波消解仪参数
最高压力:5.5 MPa;最高使用温度:220 ºC;微波频率:2 450 MHz;整机功率:3 150 W;微波输出功率:1 800 W;内罐材质:聚四氟乙烯;外罐材质:宇航复合材料;批处理量:12个样品/批次。
1.2.2 ICP-AES仪器参数
发射功率1 300 W;雾化器流量0.55 L·min−1;辅助气流量0.2 L·min−1;等离子体气体流量15.0L·min−1;样品提升量1.5 mL·min−1;射频发生器频率40.68 Hz;样品冲洗时间30 s;重复测3次;矩管观测位置:水平观测。
2 结果与讨论
本文稀土氟化物溶解率的定义:在一定的温度下,稀土氟化物在一定量的溶剂中,经微波消解后溶解在溶剂中的质量m2与原始质量m1的比值,即溶解率=(m2/m1)×100%,利用溶解率来衡量稀土氟化物在一定温度下特定溶剂中的溶解程度。
2.1 溶剂的影响
稀土氟化物的溶解率很低,若想增加其溶解率,溶剂的选择一般从三方面出发:(1) 在溶液中引入一些含有CO32−、SO42−、CH3COO−及C2O42−等阴离子的盐类,这些阴离子易与REM3+(Rare Earth Metal)形成配合物,促进稀土氟化物的溶解;(2) 在溶液中加入一些易溶的氟化物,形成类似于pREMF3·qMF·rH2O(M一般为碱金属;p、q、r为化学量系数)的三元复合盐以增加稀土氟化物的溶解率;(3) 通过加入一些无机酸,如HClO4、HNO3、H2SO4及H3PO4等,这些酸的加入易将F‒质子化形成HF,促进溶解[8‒9]。前两种方法操作复杂,实验步骤繁琐且易引入杂质而影响测试,所以本文通过称取约10 mg稀土氟化物,溶解在约10 mL溶剂中,每个样取三个平行样,重点考察了不同单一稀土氟化物在实验室常用的两种强酸体系中的溶解性质,如图1所示。
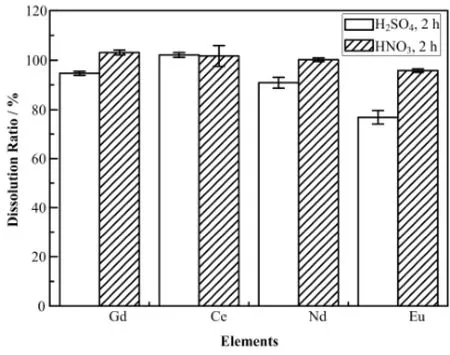
图1 几种稀土氟化物在不同溶剂中的溶解率Fig.1 Dissolution ratio of several rare earth fluorides in different acids.
由图1可见,CeF3在两种酸中的溶解率较接近,其余三种稀土氟化物在浓HNO3溶解率均比浓H2SO4大,这可能是由于H2SO4对ICP-AES谱线的影响大于HNO3,酸效应较强,影响了测试时样品的提升量,所以在后续的ICP-AES测试方法中尽量避免H2SO4作为试剂。此外,由于微波消解属于高压密闭消解,实验中溶剂的加入量不可过多,一般在8−15 mL,故本实验中优选10 mL的HNO3作为溶解体系。
2.2 微波消解程序的选择
微波消解程序的选择主要是通过调节消解的温度和时间来进一步提高样品的溶解率。表1为本实验中所采用的微波消解程序,其中稀土的取样量约10 mg,硝酸用量约10 mL,图2为4种稀土氟化物在两种不同消解程序下的溶解率的柱状图,从图2中可以看出,采用程序2时,稀土氟化物的溶解率明显高于程序1。
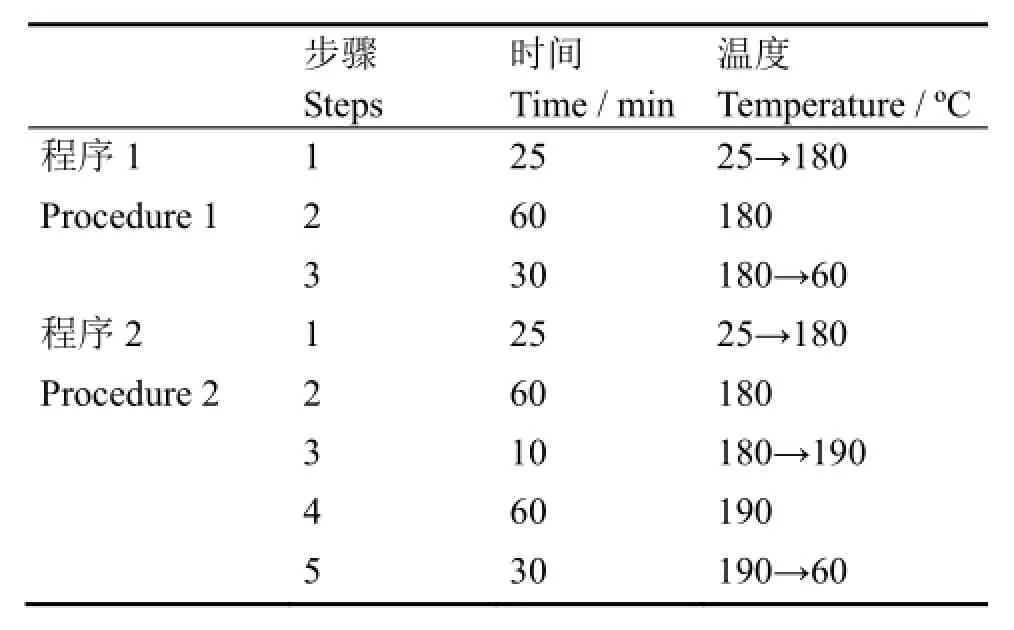
表1 不同微波消解程序Table 1 Different microwave digestion procedures.

图2 稀土氟化物不同消解程序下的溶解率Fig.2 Dissolution ratio of rare earth fluorides under different digestion procedures.
当溶解时间由1 h延长至2 h,且温度提高至190ºC时,4种稀土氟化物的溶解率明显提高。推测主要由于稀土氟化物的溶解反应为吸热反应(溶解热均大于零),溶解温度越高,溶解率越高。此外,延长加热时间即增加溶剂与溶质的作用时间,可以提供更多能量有助于稀土氟化物的溶解。
2.3 ICP-AES测试波长及工作曲线
本文中的稀土元素(Rare Earth Element, REE)测试,主要采用标准曲线法。为提高检测结果的可靠性,ICP-AES测试前首先要选取背景值低、信号强度较强的波长作为检测波长,主要通过雾化空白溶液和标准溶液的方法优选出待测元素的波长,通过一系列的筛选,最终选取钕、铕、钆、铈各自的测试波长,分别为406.109 nm、381.967 nm、376.839 nm、413.764 nm。在选定的测试波长下绘制标准曲线(图3)。

图3 稀土元素的在特征波长下的标准曲线图Fig.3 Standard curves of rare earth elements at their characteristic emission lines.
通过最小二乘法线性拟合各元素发射强度与标准溶液的浓度,得出各元素的标准曲线,将待测元素的信号值带入即可计算得出待测元素的浓度。对线性方程的评价,是计算线性回归系数R2,分别为:Nd 0.999 69、Eu 0.999 96、Gd 0.999 93、Ce 0.999 47,线性均大于0.999 47,各元素线性关系良好。
2.4 稀土氟化物的溶解率
在上述确定的溶剂、微波消解程序及测试条件下,考察一定量的硝酸中稀土氟化物(Rare Earth Element Fluoride, REEF3)的溶解率,主要通过称取不同质量梯度的稀土氟化物,每个质量点取三个平行样,测试其在实验体系中的溶解率(以百分数形式表示),并计算得出各元素的标准偏差,如表2所示。

表2 稀土氟化物在不同质量点的溶解率(%)及误差范围(n=3)Table 2 Dissolution ratio (%) and error range for rare earth fluorides at different mass (n=3).
本文将10 mL硝酸溶剂中所能溶解的最多稀土氟化物的质量定义为最大溶解量,从表2中的数据可以看出,当CeF3、NdF3取样量增加至30 mg时,溶解率明显下降,由此得出,CeF3、NdF3的最大溶解量为2.0−3.0 g·L−1,以此类比,EuF3、GdF3的最大溶解量为3.0−4.0 g·L−1,图4为溶解量曲线。

图4 稀土氟化物溶解量曲线图Fig.4 Dissolution curves for rare earth fluorides.
考虑到实验中样品的称量、溶解、定容、稀释和测试等环节均不可避免的会引入一些误差,参考《测量不确定度评定与表示(JJF 1059.1−2012)》及《微波消解-ICP法测定土壤中重金属元素的不确定度评定》[10],以及稀土元素溶解率值出现大幅下降的点,粗略估计当样品的溶解率为92%−108%可近似认为其完全溶解。从曲线中得出溶解率开始低于92%的质量点,即为最大溶解量,约为GdF3:3.9 g·L−1;EuF3:3.1 g·L−1;NdF3:2.6 g·L−1;CeF3:2.5 g·L−1,其数值均比文献[4−5]中报道的溶解数据高2−3个数量级。
2.5 溶解规律的讨论
据上述的实验结果还可以看出,随着原子序数增大,金属离子半径减小溶解度逐渐提高,这与经验规律相符,即阴离子半径比较小时,盐类的溶解度常随金属元素原子序数而增大;盐中阴阳离子半径相差较大时,其溶解度较大。
从热力学角度考察盐的溶解性质,需考虑溶解热和熵变两个因素[11]。一般来说溶解过程的熵变数值的变化较小,因此溶解过程所涉及的热焓变化常成为影响盐类溶解度大小的主要因素。溶解热主要通过是克服晶格能吸收的能量与溶剂化放出的能量加和计算,根据表3中溶解热数据可看出,上述几种稀土氟化物的溶解难易程度理论上应该是:随着原子序数增大溶解度逐渐提高,与实验结果相符。
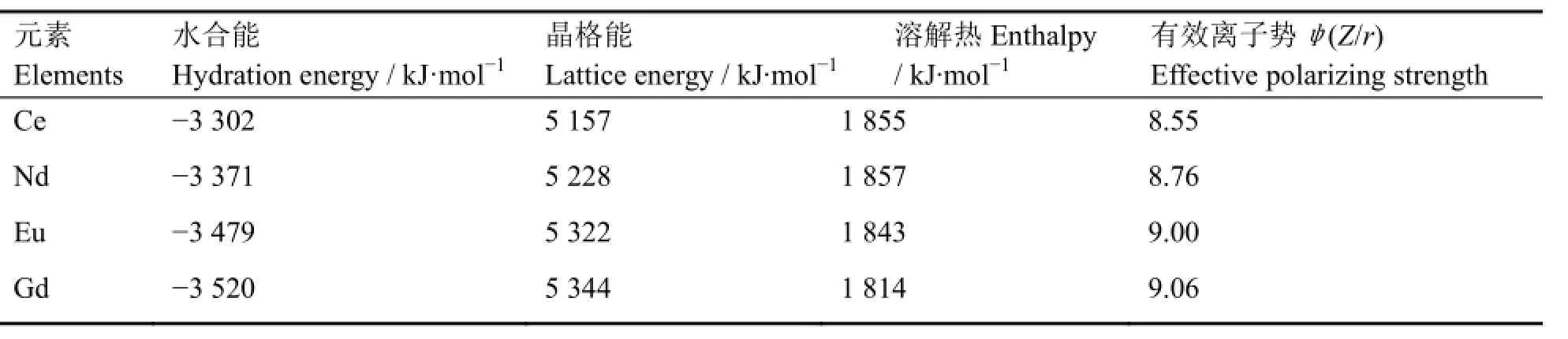
表3 4种稀土氟化物的部分物性参数[12]Table 3 Part of the physical parameters of four kinds of rare earth fluorides[12].
晶格能数据根据Капусинский半经验公式计算所得:

式中,U0为晶格能;Σn为分子式中的离子数;Z+、Z−是正负离子的电荷;r+、r−是正负离子半径,pm。
此外,文献[13]报道,氟化物的溶解度(C)与晶格能(U)、离子势(Z/r)有关,三者之间满足关系式:logC=7.70log(Z/r)−7.36logU+16.75,本文对溶解度与晶格能、极化程度的关系进行讨论,如图5所示。
虽然镧系稀土元素的晶格能、离子势数值相近,但细微的差别也会导致溶解度略有不同。由图5可见,随离子势变大、晶格能增加,两因素共同影响下,稀土氟化物的溶解度变大,且经多项式拟合,满足logC=10.08log(Z/r)−8.84logU+21.50,整体趋势与文献[13]中规律一致。
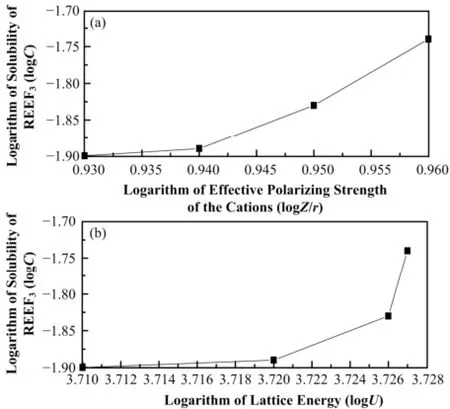
图5 离子势(a)、晶格能(b)与溶解度的极化程度关系Fig.5 Diagram of effective polarizing strength of the cations (a), lattice energy (b) and solubility.
2.6 溶解产物形态的推测
Migdisov等[14−15]的研究结果表明,稀土氟化物(REEF3)加热至200 ºC,在含氟溶液即(HFaq+F−)为0.002−0.23 mol·L−1时,稀土元素主要以REE3+、REEF2+形态存在,本文根据文献[14]给出的溶度积值对REEF3在浓硝酸中稀土元素可能存在的离子形态简要计算推测。以NdF3为例,在200 ºC时,NdF3的溶度积Ksp=1.58×10−23,NdF2+的形成常数β=1.58×106,若NdF3溶于硝酸中,完全以Nd3+、F−的形式存在,此时,CNd3+=1.29×10−2mol·L−1,CF‒=3.21×10−2mol·L−1,即使考虑活度系数的影响,也显然不满足的关系式,推测溶液中可能含有NdF2+,通过计算表明Nd元素绝大部分以是NdF2+形式存在,但是否同时存在NdF2+,文献[14]中氟含量更高却未见报道存在NdF2+,故而推测主要是存在大量NdF2+和极少量的Nd3+。
3 结语
针对钍铀燃料循环后处理流程中难溶稀土氟化物样品分析时存在的前处理难题,通过施加微波的方式对几种稀土氟化物的溶解性质进行研究,并采取ICP-AES分析溶解样品。优选溶解条件后,得出4种稀土氟化物在浓度为16 mol·L−1的硝酸中最大溶解量可达2.5−3.9 g·L−1,均比文献[4−5]报道的溶解数据高2−3个数量级,其溶解难易程度符合热力学及经验规律,该溶解方法有效解决了含有难溶稀土氟化物(NdF3、EuF3、GdF3、CeF3)的熔盐固溶体样品分析前处理难题。
1 江绵恒, 徐洪杰, 戴志敏. 未来先进核裂变能-TMSR核能系统[J]. 中国科学院院刊, 2012, 27(3): 366−374. DOI: 10.3969/j.issn.1000-3045.2012.03.016 JIANG Mianheng, XU Hongjie, DAI Zhimin. Advanced fission energy program-TMSR nuclear energy system[J]. Bulletin of Chinese Academy of Sciences, 2012, 27(3): 366−374. DOI: 10.3969/j.issn.1000-3045.2012.03.016
2 Zhang L N, Wang Y Q, Sun G X, et al. Synthesis of N,N' dimethyl-N,N'-didecyl-3-oxa-diglycolamide for extraction of lanthanides[J]. Nuclear Science and Techniques, 2014, 25(4): 040301. DOI: 10.13538/j.1001-8042/nst.25.040301
3 Lokshin E P, Tareeva O A. Solubility of YF3, CeF3, PrF3, NdF3, and DyF3in solutions containing sulfuric and phosphoric acids[J]. Russian Journal of Inorganic Chemistry, 2007, 52(12): 1830–1834. DOI: 10.1134/ S0036023607120042
4 Manchery P M, Jeffrey J. Solubilities, solubility products and solution chemistry of lanthanon trifluoride-water systems[J]. Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, 1989, 85(9): 2683−2694. DOI: 10.1039/F19898502683
5 Osamu A, Akira S, Yuko K, et al. Solubility of lanthanide fluorides in nitric acid solution in the dissolution process of FLUOREX reprocessing system[J]. Journal of Nuclear Science and Technology, 2004, 41(1): 55−60. DOI: 10.3327/jnst.41.55
6 Abu-Samra A, Morris J S, Koirtyohann S R. Wet sshing of some biological samples in a microwave oven[J]. Analytical Chemistry, 1975, 47(8): 1475−1477. DOI: 10.1021/ac60358a013
7 钟林生. 赣南脐橙果园土壤中稀土元素的分布特征研究[D]. 江西: 赣南师范学院, 2012 ZHONG Linsheng. Contents of soil rare earth elements in Gannan navel orange orchard[D]. Jiangxi: Gannan Normal University, 2012
8 Mioduski T, Gumiński C, Zeng D. IUPAC-NIST solubility data series 100 rare earth metal fluorides in water and aqueous systems Part 2: light lanthanides (Ce−Eu)[J]. Journal of Physical and Chemical Reference Data, 2015, 44(1): 1−55. DOI: 10.1063/1.4903362
9 Mioduski T, Gumiński C, Zeng D. IUPAC-NIST solubility data Series 100 rare earth metal fluorides in water and
aqueous systems Part 1: scandium group (Sc, Y, La)[J]. Journal of Physical and Chemical Reference Data, 2014, 43(1): 1−55. DOI: 10.1063/1.4866773
10 陈建宁, 王延花, 毛富仁. 微波消解-ICP法测定土壤中重金属元素的不确定度评定[J]. 中国环境监测, 2014, 30(2): 129−134 CHEN Jianning, WANG Yanhua, MAO Furen. Evaluation on uncertainty of heavy metal in the soil determined by ICP with microwave digestion[J]. Environment Monitoring in China, 2014, 30(2): 129−134
11 曹锡章, 宋天佑, 王杏乔. 无机化学[M]. 第三版. 北京:高等教育出版社, 1992: 811−813 CAO Xizhang, SONG Tianyou, WANG Xingqiao. Inorganic chemistry[M]. 3rdEd. Beijing: Higher Education Press, 1992: 811−813
12 David R L. CRC handbook of chemistry and physics[G]. 86thEd. CRC Press, 2005: 807. DOI: 10.1205/cherd.br. 0605
13 Niko N S, Sadikova A T. Solubility of fluorides of certain elements in liquid uranium hexafluoride[J]. Sovient Atomic Energy, 1975, 39(5): 982−987. DOI: 10.1007/ BF01126362
14 Migdisov A A, Williams-Jones A E. An experimental study of the solubility and speciation of neodymium (III) fluoride in F-bearing aqueous solutions[J]. Geochimica et Cosmochimica Acta, 2007, 71(12): 3056−3069. DOI: 10.1016/j.gca.2007.04.004
15 Migdisov A A, Williams-Jones A E, Wagner T. An experimental study of the solubility and speciation of the rare earth elements (III) in fluoride- and chloride-bearing aqueous solutions at temperatures up to 300°C[J]. Cosmochimica Acta, 2009, 73(23): 7087−7109.DOI: 10.1016/j.gca.2009.08.023
Solubility of rare earth fluorides in nitric acid
QIU Tingting1,2PENG Jia1,2HE Shuhua1ZHENG Xiaobei1
LIU Yuxia1ZHOU Wei1ZHANG Lan1
1(Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Jiading Campus, Shanghai 201800, China) 2(University of Chinese Academy of Sciences, Beijing 100049, China)
Background: A varity of rare-earth fluorides can be produced with thorium uranium fuel circulating post-processing. These fluorides need to be dissolubled in solvent for seperation and contents measurement. Purpose: This paper aims to develop a fast and efficient pretreatment method to dissolve slightly soluble rare earth fluorides in nitric acid. Methods: Rare earth fluorides related to the thorium molten salt reactor (TMSR) fuel circulating post-processing including NdF3, EuF3, GdF3and CeF3were studied by using Inductively Coupled Plasma Atomic Emission Spectrometry (ICP-AES). After 2-h microwave digestion at temperature of 190 ºC, the maximum solubility of these fluorides in 10 mL nitric acid (16 mol·L−1) is determined by ICP-AES. Results: The saturated concentration varies from 2.5 g·L−1to 3.9 g·L−1, which are two or three orders of magnitude higher than their solubility reported in previous literature. The standard deviation (n=3) of measurement by ICP-AES is under 4.2% and the linear correlation coefficient (r) is in the range of 0.999 47−0.999 96. Conclusion: An efficient chemical procedure for dissolving some rare earth fluorides has been developed. It provides a reference for pretreatment of insoluble rare earth fluorides in the solid molten salt samples of thorium uranium fuel circulating post-processing.
Microwave digestion, ICP-AES, Rare earth fluorides, Nitric acid, Dissolved
TL12,TL27
10.11889/j.0253-3219.2015.hjs.38.110304
中国科学院战略性先导科技专项项目(No.XDA02030000)资助
仇婷婷,女,1991年出生,2013年毕业于扬州大学,现为硕士研究生,研究领域为无机化学
周伟,E-mail: zhouwei@sinap.ac.cn
2015-08-27,
2015-10-15
CLC TL12, TL27

