99mTc-BAT-AV-45标记的化学动力学研究
曹国宪 周杏琴 毛师师 张建康 钦晓峰
(江苏省原子医学研究所 卫生部核医学重点实验室 江苏省分子核医学重点实验室 无锡 214063)
99mTc-BAT-AV-45标记的化学动力学研究
曹国宪 周杏琴 毛师师 张建康 钦晓峰
(江苏省原子医学研究所 卫生部核医学重点实验室 江苏省分子核医学重点实验室 无锡 214063)
18F-AV-45是近年来研制的一种新型淀粉样多肽(amyloid-β-peptide, Aβ)蛋白显像剂,能用以诊断阿尔茨海默病(Alzheimer's Disease, AD)。考虑到我国目前单光子发射计算机断层成像术(Single-Photon Emission Computed Tomography, SPECT)在临床使用的广泛程度,我们在该分子末端引入BAT双功能螯合基团,成功合成出了BAT-AV-45,用直接法和葡庚糖酸钠(glucoheptonate, GH)配体交换法进行标记以获得高的标记率。使用三种方式进行:(1) 同时加BAT-AV-45、GH、99mTc;(2) 加BAT-AV-45、99mTc,不加GH;(3) 加GH、99mTc,不加BAT-AV-45。分别于4 °C、25 °C、100 °C下反应,并于2min、5min、10min、15min、20min、30min用毛细管取样,用薄层色谱法(Thin Layer Chromatography, TLC)测定标记率。反应级数 n、速率常数k、平均反应活化能Ea、半衰期t1/2用自编的化学动力学软件进行计算。结果表明,99mTc-BAT-AV-45的直接和配体交换法的标记率与反应温度和反应时间成正比,但直接法的最高标记率仅为3.45%±0.05%,而配体交换法的最高标记率为93.81%±0.91%。计算所得化学动力学参数如下:反应级数 n 均为 1;速率常数 k在反应温度4 °C、25 °C和100 °C时,直接法分别为2.00×10−4min−1、3.00×10−4min−1和1.40×10−3min−1;配体交换法分别为0.108 min−1、0.115 min−1和0.265 min−1。平均反应活化能Ea,直接法为17.11 kJ·mol−1,配体交换法为6.84 kJ·mol−1。半衰期 t1/2在4 °C、25 °C和100 °C时,直接法分别为3 890.60 min、2779.51 min和481.39min;配体交换法分别为6.43 min、6.00 min和2.62 min。研究结果表明,利用配体交换法以减低标记反应的活化能,使标记反应易于快速进行,有利于获得高标记率的99mTc-BAT-AV-45。
99mTc-BAT-AV-45,标记,阿尔茨海默病,显像剂,化学动力学
随着我国人口的老龄化,阿尔茨海默病(Alzheimer's Disease, AD)发病率日趋增高,65岁以上人群发病率约5%,85岁以上人群发病率超过50%。目前,AD患病人数已逾600万人,给社会、家庭带来了沉重的精神和经济负担[1]。
在AD早期,脑电图、电子计算机断层扫描(Computed Tomography, CT)、磁共振成像(Magnetic Resonance Imaging, MRI)、心理学不显特异性,无法进行早期诊断[2]。到AD中晚期,诊断主要根据临床症状并排除其他疾病,缺乏准确性和量化指标。
因此,AD诊断成为近十年来神经核医学的热点研究方向之一。鉴于AD的发生与脑神经元外内出现由淀粉样多肽(amyloid-β-peptide, Aβ)沉积而成的老年斑有关,Aβ沉积是导致AD疾病的早期主要原因[3-7]。进行β-淀粉样蛋白显像能直观、特异、灵敏地反应AD的早期特征性病理改变,达到早期诊断AD的目的。
靶向Aβ蛋白的显像剂18F-AV-45((E)-4-(2-(6-(2-(2-(2-18F-fluoroethoxy)ethoxy)ethoxy)pyridine-3-yl)vinyl)-N-methyl benzenamine)的分子结构见图1(a)。18F-AV-45能特异地与Aβ蛋白结合,是近年来研制的一种新的Aβ蛋白显像剂[8-9]。在所有已有报导的Aβ蛋白显像剂中,AV类性能最优。18F-AV-45即将通过美国食品药物管理局(FDA)审批走向临床。考虑到我国目前SPECT在临床使用的广泛程度,我们在该分子末端引入BAT双功能螯合基团,成功合成出BAT-AV-45[10]((E)-2-(2-(2-(2-(N-mercaptoethyl)-(N-(N-mercaptoethylaminoethyl)) aminoethoxy)ethoxy)ethoxy)-5-(4-methylaminostyryl) pyridin),并用99mTc标记制备得到99mTc-BAT-AV-45 (图1(b)),以期作为供单光子发射计算机断层成像术(Single-Photon Emission Computed Tomography, SPECT)使用的Aβ斑块显像剂,为更大范围内的AD患者提供“物美价廉”的早期诊断、鉴别诊断和疗效监测的手段。本文采用直接标记法和配体交换法报告99mTc-BAT-AV-45标记的化学动力学研究。目前国内外放射性药物的99mTc标记主要用直接标记法和配体交换法,直接标记法指被标记物直接和99mTc结合的标记反应,其优点是简洁,但在好多情况下标记率低,甚至标记不上99mTc。为解决这一难题,提出了配体交换法,即在体系中还加入过渡配体,使99mTc先与过渡配体络合,再由被标记物将过渡配体置换下来,以使标记反应易于进行和获得高的标记率,缺点则是多加进了一种反应物,并且要求被标记物与99mTc络合物的稳定性必须大于过渡配体与99mTc络合物的稳定性。
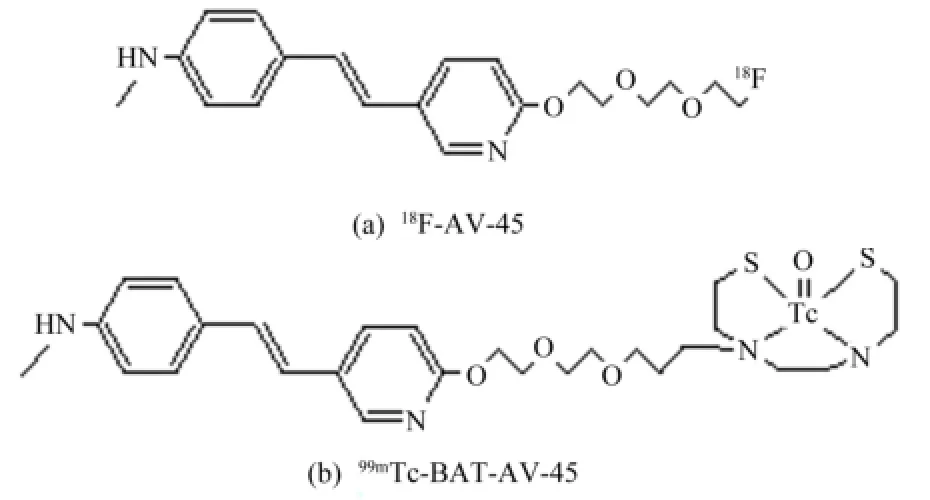
图1 18F-AV-45 (a)和99mTc-BAT-AV-45 (b)的分子结构Fig.1 Structures of 18F-AV-45 (a) and 99mTc-BAT-AV-45 (b).
1 材料与方法
1.1 主要试剂
标记前体:BAT-AV-45,课题组自行设计、合成;氯化亚锡:北京百灵威公司;乙二胺四乙酸二钠(EDTA-2Na):国药集团化学试剂公司;葡庚糖酸钠(glucoheptonate, GH):江原制药厂;其它试剂为国产分析纯。聚酰胺薄膜:浙江省台州市路桥四甲生化塑料厂。
1.2 仪器
钼-锝发生器(Na99mTcO4):中核高通公司;Wizard 1470γ-Counter:美国Perkin Elmer仪器公司;C-2105型分析天平:德国Sartorius公司;pH300型pH计:上海天达仪器有限公司;AXW-80A型涡旋混合器:上海医科大学仪器厂;玻璃点样毛细管:华西医科大学仪器厂。
1.3 化学动力学实验
1.3.1 反应设计原理
首先是99mTcO4−的还原。鉴于99mTc属过渡金属,存在多种价态,如99mTc2+、99mTc3+、99mTc4+、99mTc5+、99mTc6+等,在四配位的情况下(BAT-AV-45和GH与99mTc络合均为四配位),99mTc稳定还原为+5价,生成99mTcO3+。即99mTc还原为:
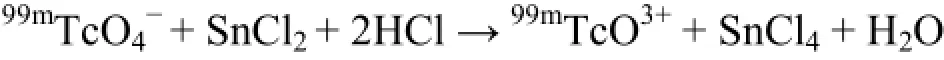
然后分别进行以下反应:
直接标记法反应式简单表示为:
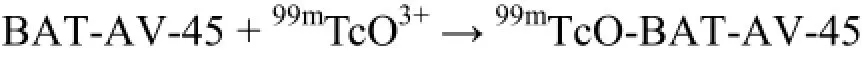
配体交换法反应式简单表示为:
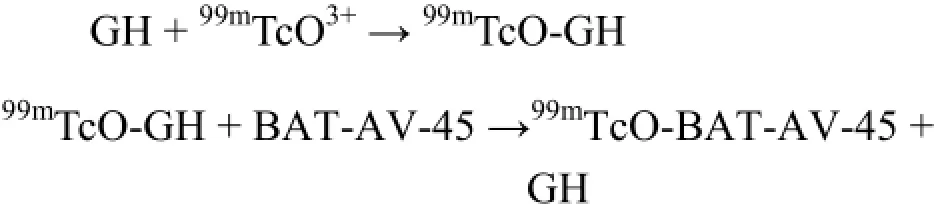
将99mTcO-BAT-AV-45和99mTcO-GH简记为99mTc-BAT-AV-45和99mTc-GH。由于GH易于直接与99mTcO3+络合,将99mTc稳定在99mTcO3+状态,又由于99mTc BAT-AV-45稳定性大于99mTc-GH,最终GH被BAT-AV-45置换,生成99mTc-BAT-AV-45。因此GH的浓度虽远高于BAT-AV-45,但有利于提高99mTc-BAT-AV-45的生成速率。
1.3.2 实验步骤
在3组(每组3瓶)西林瓶中各加0.2mL (40mg·mL−1)的GH溶液、0.1mL (10mg·mL−1)的EDTA-2Na溶液、0.05mL (1 mg·mL−1)的SnCl2盐酸溶液、0.05mL (1mg·mL−1)的BAT-AV-45的乙醇溶液、18.5MBq Na99mTcO4淋洗液、加磷酸盐缓冲液(1mol·L−1Na2HPO4·12H2O和KH2PO4,pH=5)至总体积为1mL。另取3组(每组3瓶)西林瓶,除不加GH外,如上加样,加磷酸盐缓冲液至总体积为1mL。这6组样本两两一对(加GH和不加GH)分别置于4 °C、25 °C、100 °C下反应,并于2min、5min、10min、15min、20min、30min分别用玻璃点样毛细管取样,点样于聚酰胺薄膜条(0.8cm×10cm)进行层析。展开剂为丙酮,展开后剪成10段,用γ-Counter测量生成的99mTc- BAT-AV-45的计数,计算标记率。
此外,另取3组(每组3瓶)西林瓶,加0.2mL (40mg·mL−1)的GH溶液而不加BAT-AV-45,如上加样,加磷酸盐缓冲液至总体积为1mL。分别于同上温度反应和同上时间取样、层析,测99mTc-GH的计数,计算标记率,以获得99mTc-GH的Rf值。
1.4 计算方法
根据文献[11]所述化学动力学计算方法和计算机软件CHEMKIN进行计算,求得反应级数n、速率常数k、反应活化能Ea和半衰期t1/2[12]。
1.4.1 反应级数n
用各温度、各时间点的结合动力学实验数据按式(1)计算各级反应速率常数,以其中方差最小的某级反应确定反应级数n,软件能自动确定n。
一级反应(n=1):
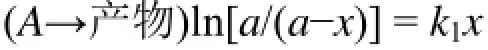
二级反应(n=2):
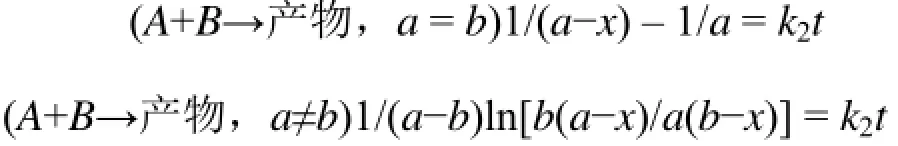
三级反应(n=3):

零级反应(n=0):

式中,a为反应物A的起始浓度;b为反应物B的起始浓度;k为反应速率常数;t为时间;x为t时刻生成物浓度;n为反应级数。
1.4.2 速率常数k
由上同时计算获得各温度下的速率常数k。
1.4.3 反应活化能Ea
根据阿仑尼乌斯公式计算标记反应的活化能:
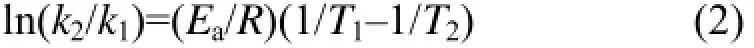
式中,Ea为反应活化能;T为绝对温度;R为里德堡常数(R=8.314 J·mol−1·K−1)。
1.4.4 半衰期t1/2
半衰期t1/2为反应物消耗一半所需时间,各级反应时间的半衰期可按式(3)计算:
一级反应:

二级反应:
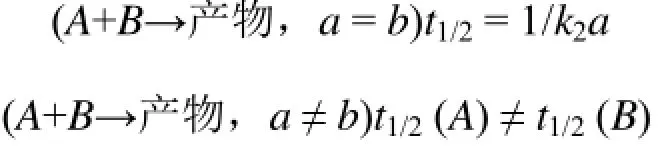
三级反应:

零级反应:

1.4.5 软件编制简述
输入动力学实验数据→根据式(1)利用动力学实验数据计算零级、一级、二级、三级反应的速率常数k→以速率常数k方差最小确定反应级数n→根据式(2)计算反应活化能Ea→根据式(3)计算半衰期t1/2→输出计算结果。
2 结果
2.1 结合动力学实验数据
层析结果表明,99mTc-BAT-AV-45的Rf=0.9-1.0,99mTc-GH的Rf=0.0-0.1,游离99mTc的Rf=0.0。99mTc-BAT-AV-45的标记率结果列于表1。
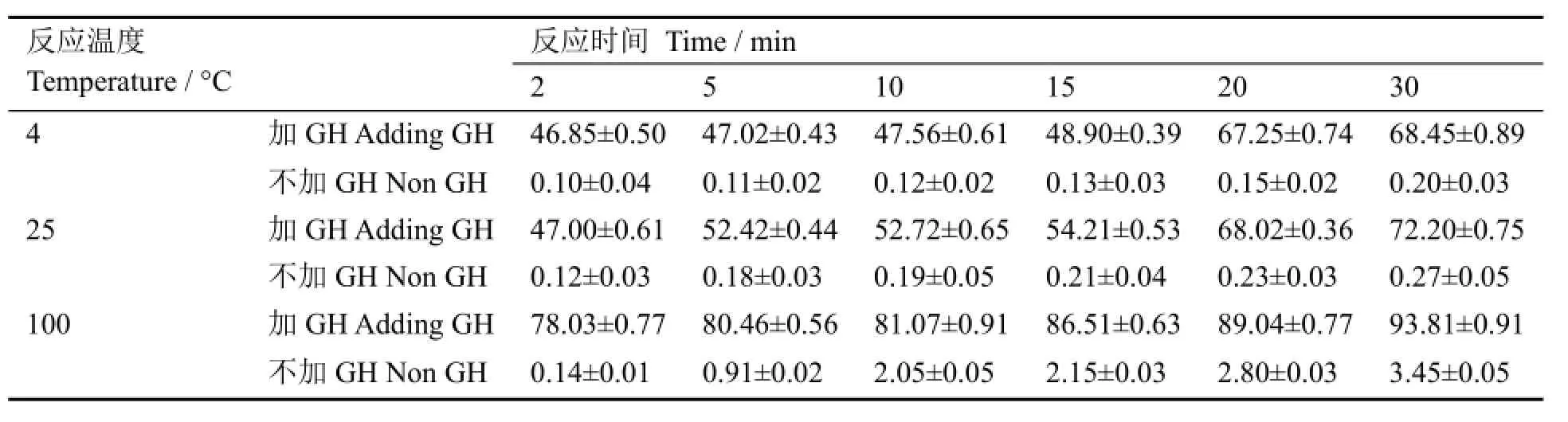
表1 99mTc-BAT-AV-45的标记率(x±SD, n=3)(%)Table 1 Labeling yields of 99mTc-BAT-AV-45 (x±SD, n=3) (%).
2.2 反应级数
用各温度、各时间点的实验数据(表1)计算零级、一级、二级、三级反应的速率常数,直接标记法的方差分别为:零级2.57、一级0.56、二级5.74、三级3.76;配体交换法的方差分别为:零级6.73、一级4.67、二级6.65、三级8.38。软件以速率常数方差最小方法确定直接标记法和配体交换法的反应级数均为n = 1。
2.3 速率常数
在计算反应级数的同时,计算得到不同温度下加GH和不加GH时的速率常数k1,结果列于表2。
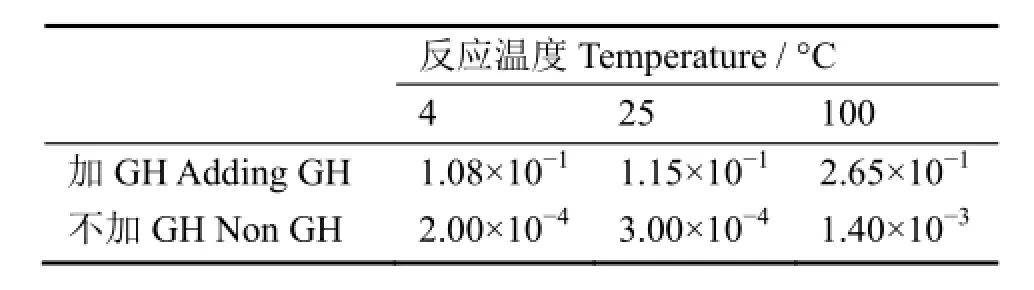
表2 不同温度下的速率常数k (min−1)Table 2 Rate constants k at different temperatures (min−1).
2.4 平均反应活化能
计算得到平均反应活化能Ea分别为:加GH为6.84 kJ·mol−1,不加GH为17.11 kJ·mol−1。
2.5 半衰期
计算得到各反应温度下加GH和不加GH时的反应半衰期t1/2,列于表3。
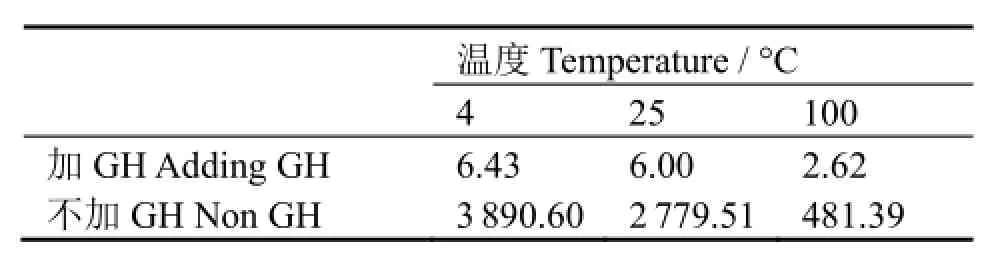
表3 不同温度下的半衰期(min)Table 3 Reaction half life t1/2 at different temperatures (min).
3 讨论
在放射性药物的99mTc标记中,能用直接标记法获得标记率高的产物,当然是最为理想和最方便的,但事实上,许多放射性药物用直接标记法很难获得高的标记率,甚至根本标记不上。在长期实践中,人们发现可以用GH进行配体交换法获得高的标记率,即在标记体系中加入GH作为过渡配体,先与99mTc形成络合物,再由被标记物进行配体交换,取代下GH,生成99mTc-被标记物的目的产物。这样,不仅可以大大提高标记率,而且一些原本标记不上的药物也能被标记上。但配体交换法成功的原理是什么?其理论依据何在?本文对此进行了化学动力学研究。
对于配体交换反应的历程,无疑用量子化学计算模拟是比较精准的,它能从分子水平演绎配体交换反应的过程,但计算量十分庞大。而用化学动力学计算,可以从宏观角度反映配体交换反应的难易程度,并指明反应的适宜条件,如反应温度、反应时间等,以获得反应速度快、产物得率高的最佳反应条件。
表1实验数据表明,99mTc-BAT-AV-45的标记率随温度和反应时间而增大。在相同的温度和反应时间下,加GH比不加GH的标记率明显要高得多。即使在100 °C和30min的条件下,不加GH时的标记率也仅为3.45%。这表明BAT-AV-45的99mTc标记仅靠提高反应温度不能获得理想的标记率,需要加入GH进行配体交换法来获取高的标记率。加入GH后,反应温度的影响也明显现显出来,如30min时,标记率从4 °C的68.45%增高到100 °C的93.81%。
通过速率常数方差最小方法确定反应级数n=1,此反应级数实质上为表观反应级数。BAT-AV-45与99mTc的标记反应是双分子螯合反应,由于在标记反应中,BAT-AV-45的摩尔浓度远大于99mTc的摩尔浓度,在标记反应后,被99mTc络合掉的BAT-AV-45占初始浓度很小份额,反应体系中BAT-AV-45的浓度几乎没有明显变化,仍保持了较高的配体浓度。反应速度表观上取决于99mTc的浓度,因此反应级数n=1。同样,在配体交换反应中,GH的摩尔浓度也远大于99mTc的摩尔浓度,反应前后体系中的GH浓度也无明显变化,反应速度表观上也取决于99mTc的浓度,因此也有反应级数n = 1。
表2数据表明,在相同温度下,加GH的速率常数是不加GH速率常数的几百倍。这说明不加GH作为过渡配体,标记反应极难进行。因此,虽然从热力学角度看该标记反应是可以进行的,但从动力学看,反应速度太慢,以至于不能明显观察到反应的进行。从而可以得到结论:添加GH作为过渡配体进行配体交换反应,是BAT-AV-45行99mTc标记成功与否的关键因素。此外,表2数据还表明速率常数与温度成正比,因此,温度升高有利于标记反应的迅速进行,因为温度升高有利于吸热反应的进行。从热力学角度讲,即是由环境向体系提供能量,以使反应能克服活化能,生成产物。考虑到临床使用的方便,我们将反应温度定为100 °C,用水浴加温很容易满足此条件。
根据实验数据计算而得的平均反应活化能结果是:加GH为6.84 kJ·mol−1,不加GH为17.11kJ·mol−1,亦即后者是前者的2.5倍。众所周知,反应活化能越大,反应越难进行;反之则越易进行。表1实验数据表明,不加GH时,几乎不反应,而加GH后,反应速度明显加快。尽管从热力学角度而言,99mTc-BAT-AV-45较99mTc-GH更稳定,99mTc-GH中的GH最终被BAT-AV-45置换掉而生成99mTc-BAT-AV-45,但从动力学角度来看,由于加入GH作为过渡配体,大大降低了整个反应的活化能,使标记反应能快速进行,在较短的时间内达到热力学平衡态。
表3数据列出了各反应温度下加GH和不加GH时的反应半衰期t1/2,该半衰期表明初始量一半的99mTc被络合所需要的时间。加GH后,仅几分钟,一半量的99mTc就被络合掉,说明标记反应很迅速。而不加GH,即使在100 °C时,络合一半量的99mTc也需要481.39min,仅从99mTc的放射性半衰期角度考虑,直接标记的方法也是不可取的。此外,表3数据还表明半衰期t1/2与反应温度成反比,说明温度升高有利于缩短标记反应时间。
4 结语
对于新研制的放射性药物通常是采用一些经验的方法进行尝试标记,以期找到反应速度快、标记率高的标记方法,很少对其反应动力学进行深入的研究。而在新药的标记中,由于对药物性质还不够了解,往往会因动力学原因而被错误地认为标记方法不对而放弃进一步研究。更多遇到的情况是标记率总是难以提高到理想的程度,比如难以提高到大于90%以上,或者是标记率不稳定,时高时低。固然可能存在其他影响因素,但反应动力学是非常重要的原因之一。BAT-AV-45是我们设计研制的新化合物,对其理化性质尚有许多需要探索之处。尽管用N2S2作为螯合基团在其他放射性药物中有所应用,但由于各自分子结构不同,其与99mTc的标记反应也就不尽相同。在BAT-AV-45的99mTc标记中,利用GH进行配体交换反应及提高反应温度是标记成功的关键所在。化学动力学研究使我们对
BAT-AV-45的99mTc标记反应有了较为理性而深入的认识,能从理论高度来剖析标记反应的内在实质,从而指导我们的实验研究,少走弯路,事半功倍。所阐述的化学动力学研究方法和编制的计算机软件对于其他放射性药物的标记反应研究也提供了有效手段。
1 Miller G. Alzheimer's biomarker initiative hits its stride[J]. Science, 2009, 326(5951): 386-389
2 van der Zee J, Sleegers K, van Broeckhoven C. Invited article: the Alzheimer disease-frontotemporal lobar degeneration spectrum[J]. Neurology, 2008, 71(15): 1191-1197
3 Treusch S, Hamamichi S, Goodman J L, et al. Functional links between Aβ toxicity, endocytic trafficking, and Alzheimer's disease risk factors in yeast[Z]. 2011: 334,1241-1245
4 Selkoe D J. Alzheimer's disease is a synaptic failure[J]. Science, 2002, 298(5594): 789-791
5 Mc Donald J M, Savva G M, Brayne C, et al. The presence of sodium dodecyl sulphate-stable Aβ dimers is strongly associated with Alzheimer-type dementia[J]. Brain, 2010, 133(5): 1328-1341
6 Phinney A L, Deller T, Stalder M, et al. Cerebral amyloid induces aberrant axonal sprouting and ectopic terminal formation in amyloid precursor protein transgenic mice[J]. Journal of Neuroscience, 1999, 19(19): 8552-8559
7 Billings L M, Oddo S, Green K N, et al. Intraneuronal Abeta causes the onset of early Alzheimer's disease-related cognitive deficits in transgenic mice[J]. Neuron, 2005, 45(5): 675-688
8 Wong D F, Rosenberg P B, Zhou Y, et al. In vivo imaging of amyloid deposition in Alzheimer disease using the radioligand18F-AV-45 (florbetapir [corrected] F 18)[J]. The Journal of Nuclear Medicine, 2010, 51(6): 913-920
9 Yao C H, Lin K J, Weng C C, et al. GMP-compliant automated synthesis of [18F]AV-45 (Florbetapir F 18) for imaging beta-amyloid plaques in human brain[J]. Applied Radiation and Isotopes, 2010, 68(12): 2293-2297
10 Zhang J K, Zhou X Q, Qin X F. Preparation, quality control and physico- chemical properties of99mTc-BAT-AV-45[J]. Journal of Radioanalytical and Nuclear Chemistry, 2012, 292(3): 1377-1383
11 Cao G X, Zhou X Q, Liu Y T, et al. Study of chemical kinetics on labeling of99mTc-N-ethyl-N2S2-Memantine[J]. Nuclear Science and Techniques, 2012, 23(1): 52-56
12 傅献彩, 沈文霞, 姚天扬. 物理化学[M]. 第四版. 北京:高等教育出版社, 1990: 700-755
FU Xiancai, SHEN Wenxia, YAO Tianyang. Physical chemistry[M]. 4thEd. Beijing: Higher Education Press, 1990: 700-755
CLC TL99, R445.5
Chemical kinetics study on the labeling of BAT-AV-45 with99mTc
CAO Guoxian ZHOU Xingqin MAO Shishi ZHANG Jiankang QIN Xiaofeng
(Key Laboratory of Nuclear Medicine, Ministry of Health, Key Laboratory of Molecular Nuclear Medicine of Jiangsu, Jiangsu Institute of Nuclear Medicine, Wuxi 214063, China)
Background: In recent years, a new amyloid-β-peptide (Aβ) protein imaging agent18F-AV-45 which can be used to diagnose Alzheimer's disease (AD), was developed. Whereas single-photon emission computed tomography (SPECT) was widely applied in medical clinic in China, a two function compound BAT was connected to the end of AV-45 to successfully synthesize a new compound BAT-AV-45, and its chemical kinetics of labeling reaction with99mTc was studied. Purpose:99mTc-BAT-AV-45 was synthesized via direct reaction and ligand exchange for obtaining high labeling yield. Methods: The labeling reactions were performed with three modes: (1) adding BAT-AV-45, GH and99mTc; (2) adding BAT-AV-45 and99mTc but non GH; (3) adding GH and99mTc but non BAT-AV-45. Reactants were incubated at 4°C, 25°C and 100°C, respectively. Samples were taken with capillary from vials at 2 min, 5 min, 10 min, 20 min and 30 min, respectively. Labeling yields were determined by thin layer chromatography (TLC). Order of reaction n, rate constant k, average activation energy Eaand reaction half life t1/2of labeling reaction were calculated with chemical kinetics software compiled by ourselves. Results: The results expressed that the labeling yields of99mTc-BAT-AV-45 with direct reaction and ligand exchange were proportional to reaction temperature and reaction time. The highest labeling yields with direct reaction and ligand exchange were 3.45%±0.05% and 93.81%±0.91%, respectively. The parameters of chemical kinetics were calculated. n was 1. k were 2.00×10−4min−1, 3.00×10−4min−1, 1.40×10−3min−1with direct reaction and 0.108 min−1, 0.115 min−1, 0.265 min−1with ligand exchange at 4°C, 25°C and 100°C, respectively. Eawere 17.11 kJ·mol−1with direct reaction and 6.84 kJ·mol−1with ligand exchange, respectively. t1/2were 3 890.60 min, 2779.51 min, 481.39 min with direct reaction and 6.43 min, 6.00 min, 2.62 min with ligand exchange at 4 °C, 25 °C and 100°C, respectively. Conclusion: The results indicated that the high labeling yield of99mTc-BAT-AV-45 could be obtained by using ligand exchange to reduce activation energy Eaof labeling reaction so as to accelerate the reaction.
99mTc-BAT-AV-45, Labelling, Alzheimer disease (AD), Imaging agent, Chemical kinetics
TL99,R445.5
10.11889/j.0253-3219.2015.hjs.38.010301
项目(No.81371590)、江苏省自然科学基金项目(No.BK2011167)资助
曹国宪,男,1954年出生,1985于苏州大学获理学硕士学位,研究员,从事放射性药物研究
2014-06-06,
2014-11-18

