生物炭作为EM菌载体影响因素及其条件优化
董金星,杨梦娇,陈小芳,周亚林,周金燕,陶雅圆,崔杰玉,谢 越
(安徽科技学院 资源与环境学院,安徽 凤阳 233100)
EM菌是主要菌种是以乳酸菌、光合细菌、酵母菌、乙酸菌为主的微生物复合而成的一种微生活菌制剂[1],其作为功能性微生物已经用于养殖业、渔业、污水及废弃物处置等多个方面[2],但如何使用适当的载体使EM菌充分发挥功效一直是研究的难点。生物炭是生物质在缺氧和相对温度“较低”(<700℃)条件下热解形成的产物[3-4],主要由有芳香烃和单质炭或具有石墨结构的炭组成,含有60%以上的碳元素,其作为肥料缓释载体、土壤改良剂、污染物修复、减少碳排放量等方面近些年来受到国内外学者的广泛关注[5-6]。生物炭孔隙度发达和比表面积巨大,可以作为优良的功能性微生物载体[7]。但生物炭作为EM菌的功能性微生物载体方面的研究却鲜见报道,本试验研究了生物炭作为EM菌载体的承载能力,利用平板计数法对其进行研究,优化生物炭投加量、菌液浓度、振荡时间、吸附温度等关键影响因子,探讨生物炭作为功能性微生物载体的可行性和最佳条件。
1 材料与方法
1.1 实验材料
生物炭:所用生物炭为自制稻壳生物炭,将稻壳放入刚玉坩埚内压紧加盖,用铝箔纸包裹严实后放入马弗炉内,500℃下烘制2h,即制得稻壳生物炭[8]。EM 菌培养基组成为:红糖100g,尿素1g,NaCl 1g,1L蒸馏水,溶解后调整pH至7.0±0.2。平板计数琼脂培养基组成:胰蛋白胨5.0g,酵母浸膏2.5g,葡萄糖1.0g,琼脂15g,1L 蒸馏水,溶解后调整 pH7.0 ±0.2,分装锥形瓶后,121℃高压灭菌灭菌15min[9]。无菌生理盐水:取8.5g NaCl溶于1L蒸馏水中,121℃高压灭菌灭菌15min。EM菌种采购自河南中广集团,菌种为黄褐色干粉状复合型菌剂,由双岐菌、乳酸菌、芽孢杆菌、光合细菌、酵母菌、放线菌、醋酸菌等组成。红糖购于安徽省凤阳县某超市;尿素、NaCl、胰蛋白胨、酵母浸膏、葡萄糖、琼脂等药剂均为分析纯。HZ500L恒温摇床(武汉瑞华仪器设备有限责任公司);GI54T高压灭菌锅(ZEALWAY);DNP-9272-1A恒温培养箱(上海三发科学仪器有限公司)。
1.2 实验方法
1.2.1 制备待测EM菌液 将EM菌种干粉接种于EM菌培养基,置于密闭塑料瓶中,36±1℃、200 r/min,每日放气一次,振荡培养48 h,即为活化EM菌液。再将活化EM菌液与EM培养基以体积比1∶19的比例,36℃恒温、160 r/min振荡,每日开盖放气一次,振荡培养72h后即为待测EM菌液。
1.2.2 不同生物炭投加量对 EM 菌吸附效果的影响 各取 0.40g、0.80g、1.20g、1.60g、2.00g、2.40g 生物炭,另取0g记为CK,加入250mL三角烧瓶内,分别加入10mL待测EM菌液和90mL无菌水,25℃、160 r/min振荡30min,取上清液测定EM菌CFU值,以CK的CFU值减去不同处理样品CFU值即为被生物炭吸附的EM菌CFU值,测定方法见1.2.6。每个处理做3个重复。
1.2.3 生物炭对不同浓度EM菌吸附效果的影响 各取10mL待测EM菌,分别稀释2倍、4倍、5倍、10倍、15倍、20倍,加入2g生物炭,另取0g记为CK,加入250mL三角烧瓶内,分别加入10mL待测EM菌液和90mL无菌水,25℃、160 r/min振荡30min,取上清液测定EM菌CFU值,以CK的CFU值减去不同处理样品CFU值即为被生物炭吸附的EM菌CFU值,测定方法见1.2.6。每个处理做3个重复。
1.2.4 不同振荡时间生物炭对EM菌吸附效果的影响 各取10mL待测EM菌、40mL无菌水,分别加入6 个250mL 三角烧瓶内,加入2g生物炭,25℃、160 r/min 振荡 0min、30min、60min、90min、120min、150min,另取0g记为CK,加入250mL三角烧瓶内,取上清液测定EM菌CFU值,以CK的CFU值减去不同处理样品CFU值即为被生物炭吸附的EM菌CFU值,测定方法见1.2.6。每个处理做3个重复。
1.2.5 不同温度下生物炭对EM菌吸附效果的影响 各取10mL待测EM菌、40mL无菌水,分别加入5个250mL三角烧瓶内,加入2g生物炭,分别置于20℃、25℃、30℃、35℃、40℃,160 r/min振荡60min,另取0g记为CK,加入250mL三角烧瓶内,取上清液测定EM菌CFU值,以CK的CFU值减去不同处理样品CFU值即为被生物炭吸附的EM菌CFU值,测定方法见1.2.6。每个处理做3个重复。
1.2.6 EM菌CFU值测定方法 在超净工作台内以无菌操作将待测样取1mL用无菌生理盐水稀释至104、105两个稀释倍数,各取1mL分别加入无菌培养皿内,每皿加入15mL~20mL尚未凝固的平板计数琼脂,混匀,凝固后在琼脂表面再覆盖一薄层琼脂培养基(约4mL),凝固后翻转平板,36±1℃培养48h±2h后记录稀释倍数和相对应的菌落数量,即为菌落形成单位(以CFU表示)。
1.3 最佳吸附效果选择
在单因素实验的基础上,以生物炭投加量、EM菌浓度、振荡时间、吸附温度4个条件作为参考因素,设计正交设计因素与水平考察,见表1。
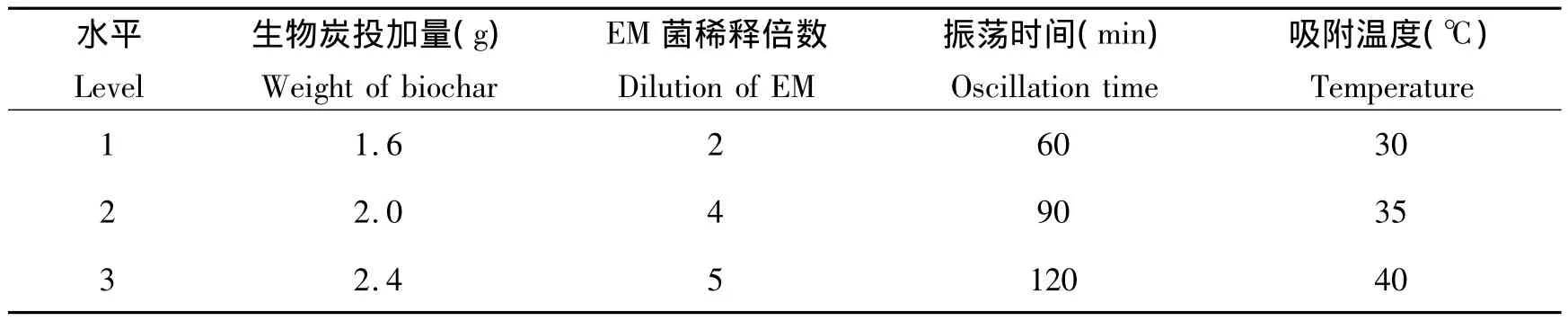
表1 正交设计因素与水平考察表Table 1 Orthogonal design factor and level survey
1.4 数据处理
数据分析采用Excel 2007和SPSS 19.0数据处理系统完成。
2 结果与分析
2.1 最佳吸附条件的确定
2.1.1 投加生物炭量的确定 试验1设计单因素变量为生物炭投加量,加入不同重量生物炭吸附处理后,取上清液稀释至合适倍数,分别接入计数培养基,经过48h培养后进行CFU计数,从图1可知,生物炭吸附的EM菌的数量随着生物炭的增加而增加,加入2.4g生物炭吸附的EM菌CFU数量最多,达到2.9×107CFU,相比投加量为0.4g时吸附的EM菌数量增加了93.3%,生物炭投加量与EM菌吸附量呈正相关性。当生物炭投加量0.4g时,其吸附的CFU数为1.5×107CFU,但当投加量增加一倍至0.8g时,其吸附的CFU仅为1.7×107CFU,增幅仅为13.3%。根据图2可知,单位生物炭吸附效果最好的是加入0.4g时,其吸附量为3.8×107CFU/g。随着生物炭投加量的增加,单位生物炭吸附量在投加至2.4g时逐渐减少为1.2×107CFU/g。由投加量0.4g增加至0.8克时,其单位生物炭吸附量大幅降低43.3%,但此后降幅显著减小,当投加量从2.0g提升至2.4g时,单位生物炭吸附量仅降低7.1%,生物炭投加量与单位生物炭吸附量呈负相关。
2.1.2 菌液浓度确定 试验2设计单因素变量为不同浓度EM菌,原EM菌液浓度为4.5×107CFU/mL,加入不同倍数纯水稀释处理后,取上清液稀释至合适倍数,分别接入计数培养基,经过48h培养后进行CFU计数。由图3可知,生物炭吸附效果最好的是稀释2倍,生物炭可吸附的EM菌达到2.3×107CFU/g,随着菌液浓度的降低吸附效果降低,当稀释至20倍时,生物炭吸附量仅0.3×107CFU/g,仅为稀释2倍时的10%。稀释倍数与EM菌吸附量呈负相关。刘庆莉[10]等人研究根瘤菌在草炭和蛭石作为载体试验中发现,以草炭和蛭石作为根瘤菌载体,低浓度的根瘤菌液接入更能发挥作用,而以液体作为根瘤菌载体,根瘤菌接入浓度较高才能发挥作用。
2.1.3 振荡时间的确定 从图4可知,试验3设计单因素变量为不同振荡时间,当振荡时间为0min时,吸附EM菌仅为0.3×107CFU/g,150min生物炭吸附的EM菌已达到2.9×107CFU/g,振荡30min较振荡0min生物炭吸附的EM菌增加了463%,但随着振荡时间的增加,振荡90min后吸附量增加已不显著,振荡150min较振荡120min吸附量仅增加3.2%,振荡120min较振荡90min吸附量仅增加4.5%。其原因是生物炭表层有着大量多空隙结构和特殊结构的官能团,孔道效应也较明显,利于吸附过程的进行。在吸附过程初期,吸附效率较为迅速,但随着吸附时间增加,EM菌大量聚集在生物炭的微孔和表面,使得生物炭吸附位不断减小,因此吸附速率逐渐降低。此前已有许多学者对振荡吸附时间作过研究,沈岩柏[11]等人研究当吸附载体为硅藻土时,振荡20min时已达稳定状态,马万征[12]等研究当活性炭吸附含铬废水时,150min可达稳定状态,而戴世华[13]等人研究的使用活性炭脱色工艺研究在70min即可达到最佳。本研究与其可能由于试验载体材质的不同,振荡90min后基本达到稳定状态。
2.1.4 吸附温度的确定 试验4单因素变量为不同吸附温度,从图5可知,当吸附温度为15℃时,生物炭吸附的EM菌仅为1.8×107CFU/g,当吸附温度上升至35℃时,生物炭吸附量达最大值2.6×107CFU/g,生物炭吸附量提高了44.4%。但当吸附温度上升至40℃时,生物炭吸附量降低为2.3×107CFU/g,降幅为11.5%,其原因可能为有部分EM菌超过35℃后开始死亡。此前许多学者对吸附温度与吸附量对菌群的影响进行研究,沈岩柏[12]等人的研究硅藻土对诺卡氏菌的吸附作用,室温下即可达到较好的吸附效果,但与赵颖[14]等人研究EM菌则在35℃时生长状态最佳,其原因可能因载体或菌种不同其对吸附温度产生的差异表现。
2.2 最佳吸附条件的选择
根据单因素试验结果,并考虑到在实际应用过程中对EM菌群最大总吸附数量的要求,选取1.6g、2.0g、2.4g作为正交试验3个因素水平;选取稀释2倍、稀释4倍、稀释5倍作为正交试验的个因素水平;选取60min、90min、120min作为正交试验3个因素水平,选择30℃、35℃、40℃作为正交试验的3个因素水平,以正交因子水平表设计正交实验表L9(34),见表2。

表2 正交试验结果表Table 2 Orthogonal experimental results tables
由表2的极差分析可知,4个因素中对生物炭吸附EM菌效果的影响大小主次顺序依次为:A>B>C>D,即生物炭投加量(A)>菌液浓度(B)>振荡时间(C)>吸附温度(D),生物炭投加量和菌液浓度对生物炭吸附EM菌影响较大。由正交试验K值可推导出,最优吸附条件为A3B1C3D3,但与正交试验表中最优吸附条件A3B1C3D2不相符,对组合A3B1C3D3进行重复试验,其吸附的生物炭为3.8×107CFU/g,大于正交试验中组合A3B1C3D2的3.6×107CFU/g,因此生物炭吸附EM菌最佳吸附条件为A3B1C3D3,即生物炭投加量2.4g、菌液稀释倍数2倍、振荡120min、吸附温度40℃、生物炭吸附的CFU值最高达到3.8×107CFU/g。
3 结论与讨论
目前对生物炭吸附重金属的研究较多,但对其作为吸附EM菌的载体研究鲜见报道。本文研究生物炭作为EM菌载体,生物炭投加量、菌液浓度、振荡时间、吸附温度等四个影响因素对其吸附效果的影响,获得如下结论:生物炭对EM菌有良好的吸附效果,生物炭吸附EM菌量与生物炭投加量呈正相关,但其吸附效率与生物炭投加量呈负相关;与EM菌的浓度呈正相关;与菌液稀释倍数呈负相关;与振荡吸附时间呈正相关,与吸附温度在15℃到35℃内呈正相关,但温度达到40℃吸附效率有所降低。根据正交实验结果可知,生物炭吸附EM菌主要影响因素为生物炭投加量>菌液浓度>振荡时间>吸附温度;吸附10mL浓度为4.5×107CFU/mL的EM菌液其最佳条件为生物炭投加量2.4g、菌液稀释倍数2倍、振荡120min、吸附温度40℃。本研究结果揭示了生物炭可以作为EM菌剂优良载体,具有潜在应用价值。
[1]鲁艳英,金亮,王谨,等.EM菌组成鉴定及其消除垃圾渗滤液恶臭研究[J].环境科学与技术,2009,32(8):62-63.
[2]王红强,刘雪平,王洋洋,等.EM菌在水处理中的应用综述[J].江苏农业科学,2014(6):4-6.
[3]何绪生,耿增超,佘雕,等.生物炭生产与农用的意义及国内外动态[J].农业工程学报,2011,27(2):1-7.
[4]何绪生,张树清,佘雕,等.生物炭对土壤肥料的作用及未来研究[J].中国农学通报,2011,27(15):16-25.
[5]李飞跃,梁媛,汪建飞,等.生物炭固碳减排作用的研究进展[J].核农学报,2013,27(5):681-686.
[6]谢祖彬,刘琦,许燕萍,等.生物炭研究进展及其研究方向[J].土壤,2011,43(6):857 -861.
[7]丁文川,曾晓岚,王永芳,等.生物炭载体的表面特征和挂膜性能研究[J].中国环境科学,2011,31(9):1451-1455.
[8]吕宏虹,宫艳艳,唐景春,等.生物炭及其复合材料的制备与应用研究进展[J].农业环境科学学报,2015,34(8):1-12.
[9]GB4789.2—2010,食品安全国家标准 食品微生物学检验 菌落总数测定[S].
[10]刘庆莉,王金生,刘丽君,等.大豆根瘤菌剂载体的选择及最佳施用浓度筛选[J].大豆科学,2014,33(2):207-210.
[11]沈岩柏,朱一民,魏德洲,等.硅藻土对诺卡氏菌的吸附作用[J].东北大学学报,2005,26(2):183-185.
[12]马万征,汪志东,邹海明,等.活性炭处理含铬废水的研究[J].安徽科技学院学报,2013,27(1):90-93.
[13]戴世华,孙玉军,宋玉玲,等.秀珍菇胞外多糖活性炭脱色工艺研究[J].安徽科技学院学报,2014,28(4):25-29.
[14]赵颖,曹映海.EM 菌培养基的优化及菌株数量的检测[J].水产养殖,2012,33(4):5-7.

