一株毒死蜱降解菌的固定化条件优化研究
段海明,余 利,张 扬,张 耀
(安徽科技学院 农学院,安徽 凤阳 233100)
毒死蜱,化学名称O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,是一种在世界范围内使用长达约50年的杀虫剂,又名乐斯本、白蚁清等,主要用于多种大田作物、果树和蔬菜害虫的防治[1]。但是,毒死蜱的广泛生产和使用,已经直接或间接的造成对水体、土壤和大气的污染[2]。众多研究证明,毒死蜱能够通过皮肤进入人体,并且在人体内有累积现象。据报道,毒死蜱在无明显毒性效应下即可对大脑发育或功能产生影响,低剂量就可引起DNA或蛋白质合成的特异性抑制,长期或重复施予亚毒性剂量可对细胞、神经轴突等产生影响,甚至可引起行为的改变。此外,毒死蜱可能为一种疑似致畸剂,引起令人担忧的出生缺陷和生殖细胞的DNA损伤等[3]。因此,毒死蜱污染环境的生物修复研究对于生态安全和人类健康具有重要意义。
研究表明,固定化细胞对各种外界因素的适应能力加强,微生物固定后不仅保持了生命活力,还可大幅度提高菌体密度,且便于固液分离,降解效率得以较大提高[4]。朱鲁生等[5]采用海藻酸钠溶胶把分离到的莠去津降解菌Arthrobacter sp.HB-5进行了固定化,并对土壤中含有的莠去津进行了降解试验,降解效果较好;Bazot S等[6]也采用海藻酸钠对Arthrobacter sp.N4和Delftia acidovorans W34两菌株进行了共固定化,探讨固定化菌对敌草隆的降解特性。本实验室已分离出降解毒死蜱的高效降解菌-蜡状芽孢杆菌,并已对其降解特性进行了研究,游离化菌在一定条件下对100mg/L毒死蜱的降解率达到64.8%[7]。
本研究在探明不同菌龄的游离化菌对毒死蜱降解的影响基础之上,系统开展了固定化蜡状芽孢杆菌对毒死蜱的降解曲线以及不同的包埋比、固定化时间、成型剂的浓度和海藻酸钠溶胶的浓度对固定化菌降解毒死蜱的影响研究,最后采用正交试验的方法优选出固定化菌的最佳制作方法,以期为固定化微生物降解毒死蜱提供技术支持。
1 材料与方法
1.1 供试材料
1.1.1 供试降解菌株 以从山东某农药企业生化废水处理池中分离到的蜡状芽孢杆菌为研究对象,在Genbank上的注册登录号为eu915686。
1.1.2 供试培养基 普通培养基、基础培养基和LB培养基的配制参照参考文献[8-9]。
1.1.3 供试药品 95.9%毒死蜱原药(山东华阳农药化工集团有限公司)配成48%毒死蜱乳油于4℃冰箱储存备用;按试验方案配制不同浓度海藻酸钠(国药集团化学试剂有限公司)溶胶,115℃灭菌15 min后备用;无水CaCl2(江苏宜兴第二化学试剂厂)用去离子水配成2%的CaCl2溶液,用作海藻酸钠固定化菌的成型剂;石油醚(AR,天津市永大化学试剂有限公司)。
1.2 试验方法
1.2.1 降解菌的培养和菌体的制备 无菌条件下将菌株接种到普通培养基平板上,在32℃恒温箱中培养72 h,待菌苔长出后取2接菌环于100 mL发酵培养基中,于33℃,150 r·min-1摇培20 h,将培养好的菌体置于低温冷冻离心机中离心、洗涤后获取菌体备用。
1.2.2 不同菌龄的蜡状芽孢杆菌对毒死蜱降解的影响 为了明确不同菌龄的游离化降解菌对毒死蜱降解的影响,菌株在LB培养基中分别培养10、15、20、25和30 h,以获取不同菌龄的菌体。然后于4℃、8000 r·min-1离心10 min收集菌体,用灭菌蒸馏水洗涤3次后离心获取菌体,最后采用灭菌蒸馏水调节接种菌悬液的OD600=2.5备用,接种量为10%(V/V),基础培养基配制的毒死蜱初始浓度为50 mg/L,降解反应液的总体积为10 mL。上述配制好的反应液装于50 mL灭菌三角瓶中,于33℃,150 r·min-1摇培24 h,以不接菌的含有50 mg/L毒死蜱的基础培养基作为对照,每一处理重复3次。培养结束后提取测定培养液中毒死蜱的残留量,计算降解率。
1.2.3 固定化菌的制备方法 海藻酸钠溶胶先在115℃下灭菌15 min,冷却至室温后把2 mL菌悬液加入10 mL海藻酸钠溶胶中,充分搅拌混匀,然后用容积为20 mL的玻璃注射器(针头内径为0.6 mm)吸取菌体和溶胶的混合液滴入到2%(m/V)的CaCl2溶液中造粒。造粒完毕后,固定化小球继续保持在上述CaCl2溶液中于4℃冰箱中交联24 h,最后用0.85%的灭菌生理盐水洗涤、过滤固定化菌,在无菌滤纸上晾干后备用。
1.2.4 固定化蜡状芽孢杆菌对毒死蜱的降解曲线 在50 mL三角瓶中加入10 mL采用基础培养基配制的毒死蜱初始浓度为50 mg/L的药液,将预先制备好的固定化菌以80g/L的接菌量接种,于33℃、150 r·min-1摇培12、15、18、21、24和27 h,以不接种固定化菌的含药基础培养基为空白对照,每一处理重复3次,确定固定化菌对毒死蜱的降解曲线。
1.2.5 不同包埋比对固定化菌降解毒死蜱的影响 分别称取以1.2.1的方法获得的菌体0.1g、0.2 g、0.25 g、0.33 g、0.5 g 和1.0 g 加入到2.0 mL 0.85%的灭菌生理盐水中混匀,然后将菌液加入 10 mL 2.5%的海藻酸钠溶胶中,充分搅拌均匀,使包埋比(菌体质量与溶胶的体积比:m/V)分别为1∶100、1∶50、1∶40、1∶30、1∶20和1∶10。依照1.2.3的方法造粒,于4℃冰箱中固定化24 h。在50mL三角瓶中加入10mL初始浓度为50mg/L的毒死蜱,固定化菌的接种量为80g/L,于33℃、150 r·min-1摇培24 h,以不接种固定化菌的含药基础培养基为空白对照,每一处理重复3次,检测不同的包埋比对毒死蜱降解的影响。
1.2.6 不同固定化时间对固定化菌降解毒死蜱的影响 称取以1.2.1的方法获得的菌体以包埋比为1∶20的比例混合均匀,依照1.2.3的方法制备固定化菌,于4℃冰箱中分别交联8 h、16 h、20 h、24 h、28 h、32 h和40 h,其它同1.2.5。检测不同固定化时间对毒死蜱降解的影响。
1.2.7 不同浓度的成型剂对固定化菌降解毒死蜱的影响 称取以1.2.1的方法获得的菌体以包埋比为1∶20的比例混合均匀,然后用容积为20 mL的玻璃注射器(针头内径为0.6 mm)吸取菌体和溶胶的混合液,分别滴入浓度为1.5%、2%、3%、3.5%、4%和5%的CaCl2溶液中固定化,于4℃冰箱中交联28 h,其它同1.2.5。检测不同浓度的成型剂对毒死蜱降解的影响。
1.2.8 不同浓度的海藻酸钠对固定化菌降解毒死蜱的影响 称取以1.2.1的方法获得的菌体0.5 g加入2.0 mL 0.85%的灭菌生理盐水中混合均匀,然后把菌液加入到10 mL浓度分别为2%、2.5%、3%、3.5%和4%的海藻酸钠溶胶中,充分搅拌均匀。其它同1.2.7。检测不同浓度的海藻酸钠对固定化菌降解毒死蜱的影响。
1.2.9 正交试验优化固定化菌的包埋条件 本试验选择海藻酸钠浓度、CaCl2浓度和固定化时间为3个因素,每个因素设3个水平,以1.2.3的方法制备固定化菌,以制得的固定化菌对50 mg/L毒死蜱的降解率为目标函数,采用L9(34)的正交表进行正交试验(表1),通过分析得出各因素对毒死蜱降解的影响次序和各因素应选取的最优水平。
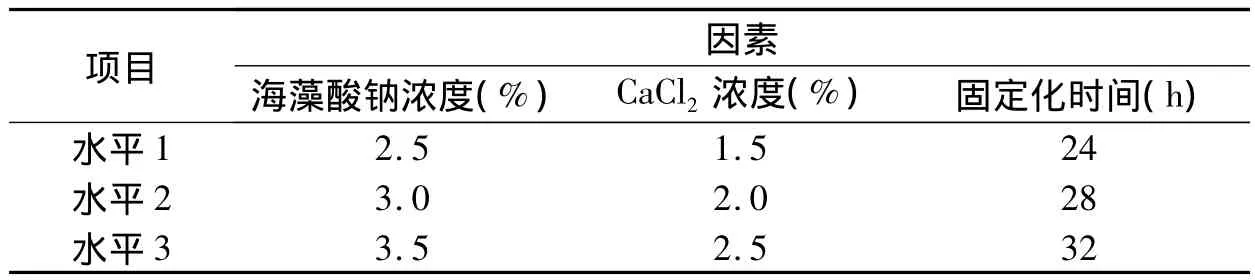
表1 正交试验表设计Table 1 Orthogonal experiment designment
1.3 毒死蜱残留测定方法和数据分析
固定化菌降解毒死蜱结束之后,取5 mL反应液用等体积的石油醚提取2次,合并2次提取液后检测。利用毒死蜱在λ=290 nm[10]左右处有紫外吸收峰的特性,通过紫外分光光度计扫描确定在λ=292 nm处测定样品的OD292,根据标准曲线计算样品中毒死蜱的含量,计算毒死蜱的降解率。试验数据均采用SPSS 13.0软件进行分析。
2 结果与分析
2.1 不同菌龄的游离化菌对毒死蜱降解的影响
由图1可见,游离化蜡状芽孢杆菌的菌龄从10 h增至20 h时,降解率逐渐上升,菌龄为20 h时获得的菌体(菌体密度为OD600=2.5)对毒死蜱的降解率达60.3%,而培养时间从20 h增至30 h时,降解率则逐渐下降。因此,在本研究中蜡状芽孢杆菌降解毒死蜱的菌龄为20 h。
2.2 固定化菌对毒死蜱的降解曲线
从图2可见,固定化菌对毒死蜱降解的反应时间从12 h增至27 h,降解率逐渐上升,24 h对毒死蜱的降解率达到75.4%,24 h之后固定化菌对毒死蜱的降解速率减慢,降解率增幅较小。因此,确定下一步试验固定化菌对50 mg·L-1毒死蜱的反应时间为24 h。
2.3 不同包埋比对毒死蜱降解的影响
由图3可见,菌体和海藻酸钠溶胶的包埋比从1∶100增加到1∶20时对50 mg/L毒死蜱的降解率逐渐增大,包埋比为1∶20达最大为76.8%,包埋比继续增大降解率则呈下降的趋势。因此,确定包埋比为1∶20时对50 mg/L毒死蜱的降解率最高。
2.4 不同固定化时间对毒死蜱降解的影响
由图4可见,蜡状芽孢杆菌的固定化时间从8 h增至28 h,降解率呈上升趋势,固定化时间为28 h时,降解率达最大为81.7%,28 h之后降解率则逐渐下降。因此,为提高蜡状芽孢杆菌对毒死蜱的的降解效果,确定蜡状芽孢杆菌菌液在海藻酸钠溶胶中的固定化时间为28 h。
2.5 不同浓度成型剂对毒死蜱降解的影响
由图5可见,随着成型剂CaCl2浓度的增大,固定化菌对毒死蜱的降解率先上升后下降。CaCl2浓度为2%降解率达最大为82.6%。然而,随着成型剂浓度的再次升高,固定化菌对50 mg/L毒死蜱的降解率则逐渐下降,在CaCl2浓度上升到5%达到最低为68.4%。因此,可以确定,固定化菌成型剂浓度为2%时对50 mg/L毒死蜱的降解率最高,效果较好。
2.6 不同浓度海藻酸钠包埋对降解率的影响
由图6可见,随着包埋剂海藻酸钠浓度的增大,固定化菌对毒死蜱的降解率先上升后降低。海藻酸钠浓度为3%时降解率达最大为85.7%,包埋剂浓度从2.5%上升到3.5%时降解率分布在83% ~86%之间(p<0.05)。因此,可以根据固定化菌不同的使用要求和条件而采用不同浓度的海藻酸钠溶胶包埋。
2.7 正交试验结果分析
正交试验数据经SPSS13.0分析软件方差分析,结果表明,海藻酸钠浓度(p=0.003)、CaCl2浓度(p=0.004)和交联时间(p=0.001)三因素对固定化菌降解毒死蜱的影响都达到显著水平,影响次序依次为固定化时间>海藻酸钠浓度>CaCl2浓度。通过正交试验选出的最优水平分别为:海藻酸钠浓度为3.0%,CaCl2浓度为1.5%,固定化时间为32 h。
3 讨论与结论
3.1 讨论
固定化降解菌能够保持细胞的浓度和纯度,对于农药污染的消除与其它方法相比具有不可比拟的优势[11]。在固定化微生物降解农药的过程中,降解菌的菌龄、包埋比和海藻酸钠浓度、成型剂CaCl2浓度和固定化时间等因素会影响微生物的活性、含菌量、固定化菌的机械强度、传质效果等,最终决定了对目标污染物降解效率的高低。肖巧巧等[12]报道了一株恶臭假单胞菌(Pseudomonas putida)对微囊藻毒素-LR具有较好的降解作用,其中降解菌的菌龄对降解有着较大的影响,菌龄为36 h降解效果最佳。Feng等[13]研究利用硅藻土固定化假单胞菌株M285时发现,固定化处于对数生长期的菌体比处于稳定期的降解菌对TCP的去除效果更佳,这就说明菌龄的大小对于固定化菌降解污染物具有重要作用。窦晶晶等[14]研究了固定化产碱菌对多菌灵的降解效果,并采用正交试验对海藻酸钠浓度、氯化钙浓度和交联时间三因素进行了条件优化,得出对降解效果影响的次序依次为交联时间、海藻酸钠浓度和CaCl2浓度,优选得出的条件为海藻酸钠浓度2%,CaCl2浓度4%以及固定化时间24 h。本研究得出的影响毒死蜱降解率的上述三因素的次序是相同的,但是优化指标不同,故海藻酸钠和氯化钙的最适浓度以及固定化时间要根据具体实验来选择确定。通过本实验进一步综合分析得出,固定化时间所影响的海藻酸钠与钙离子所形成的钙凝胶的强度是影响固定化菌降解农药的决定性因素之一,若固定化时间不足,固定化菌的机械强度较小,则会影响菌株的附着和生长;固定化时间若过长,凝胶的强度过高,影响固定化菌的传质性能,也无法获得良好的降解效果。除此之外,海藻酸钠浓度越高,包埋后的小球传质性能越差,氧气和目标污染物向固定化菌内部的扩散阻力越大,从而导致微生物的活性下降、底物不能有效的和菌体相接触,从而使得降解率不断下降。但是,若海藻酸钠浓度较低,制得的固定化菌在使用过程中容易破碎,菌体外泄,固定化可使降解菌抗毒性能和耐受力增强的优势也得不到充分发挥[15]。
3.2 结论
(1)游离化蜡状芽孢杆菌菌体的菌龄为20 h时对50 mg/L毒死蜱的降解率达最高。
(2)海藻酸钠固定化菌降解毒死蜱的反应时间为24 h对50 mg/L毒死蜱的降解率达到75.4%,菌体和海藻酸钠溶胶的包埋比(m/V)为1∶20时对毒死蜱的降解率达最高为76.8%,菌株在成型剂2%CaCl2溶液中固定28 h对毒死蜱的降解率达最高。海藻酸钠溶胶浓度为3%对毒死蜱的降解率达最大为85.7%。
(3)通过正交试验得出,海藻酸钠浓度(A)、CaCl2浓度(B)和固定化时间(C)对50 mg/L毒死蜱降解率的影响次序为C>A>B,最优水平分别为:海藻酸钠浓度3.0%、CaCl2浓度1.5%和固定化时间32 h。
[1]LAKSHMI C V,KUMAR M,KHANNA S.Biodegradation of chlorpyrifos in soil by enriched cultures[J].Current Microbiology,2009,58(1):35-38.
[2]刘腾飞,邓金花,周峰杰,等.毒死蜂在土壤中的降解及分析研究进展[J].中国农学通报,2014,30(9):26-34.
[3]PERERA F P,RAUH V,WHYATT R M,et al.A summary of recent findings on birth outcomes and developmental effects of prenatal ETS,PAH,and pesticide exposures[J].Neurotoxicology,2005,26(4):573 -587.
[4]QIAO L,WEN D H,WANG J L.Biodegradation of pyridine by Paracoccus sp.KT-5 immobilized on bamboo-based activated carbon[J].Bioresource Technology,2010,101:5229 -5234.
[5]朱鲁生,辛承友,王倩,等.莠去津高效降解细菌HB-5的固定化研究[J].农业环境科学学报,2006,25(5):1271-1275.
[6]Bazot S,Bois P,Joyeux C,et al.Mineralization of diuron[3-(3,4-dichlorophenyl)-1,1-dimethylurea]by co-immobilized Arthrobacter sp.and Delftia acidovorans[J].Biotechnology Letters,2007,29(5):749 -754.
[7]段海明.蜡状芽孢杆菌不同菌株降解有机磷农药的特性分析[J].生态环境学报,2012,21(9):1608-1613.
[8]段海明,王开运,于彩虹.耐盐性毒死蜱降解菌HY-1的产酶培养基及发酵条件优化[J].微生物学通报,2011,38(3):335-361.
[9]郭新强,李荣,林栋青,等.三唑磷降解菌株 GS-1的分离鉴定及其降解特性的研究[J].微生物学通报,2009,36(8):1143-1149.
[10]王金花,朱鲁生.3株真菌对毒死蜱的降解特性[J].应用与环境生物学报,2005,11(2):211-214.
[11]陈铭,周晓云.固定化细胞技术在有机废水处理中的应用与前景[J].水处理技术,1997,23(2):98-104.
[12]肖巧巧,尹华,叶锦韶,等.一株微囊藻毒素-LR降解菌的降解特性[J].环境化学,2014,33(9):1594-1600.
[13]Feng Y,Racke K D,Bollag J M.Use of immobilized bacteria to treat industrial wastewater containing a chlorinated pyridinol[J].Applied Microbiology and Biotechnology,1997,47(1):73-77.
[14]窦晶晶,冯贵颖,呼世斌,等.一株多菌灵降解菌包埋条件及降解特性[J].中国环境科学,2011,31(3):431-436.
[15]董怡华,胡筱敏,张玉革,等.包埋固定化Rhodopseudomonas palustris对邻氯苯酚的降解[J].中南大学学报:自然科学版,2014,45(4):1369-1376.

