基于烟酰腙Schiff碱的Cu(Ⅱ)和Ni(Ⅱ)配合物的合成、晶体结构和性质
储召华 解庆范 李颖茜 陈延民*,
基于烟酰腙Schiff碱的Cu(Ⅱ)和Ni(Ⅱ)配合物的合成、晶体结构和性质
储召华1解庆范2李颖茜2陈延民*,2
(1韩山师范学院化学系,潮州521041)
(2泉州师范学院化学与生命科学学院,泉州362000)
采用缓慢挥发法合成了2个烟酰腙类Schiff碱配合物[Cu(Py)(HL1)]2(1)和[Ni(L2)2](2),其中,H3L1=2,4-二羟基苯甲醛缩烟酰腙,HL2=2-乙酰基吡啶缩烟酰腙。采用元素分析、红外光谱、紫外光谱、荧光光谱和热重分析以及X-射线单晶衍射分析进行了表征。结果表明,1和2的晶体均属单斜晶系,P21/c空间群;1的晶胞参数a=0.739 86(12)nm,b=1.903 7(3)nm,c=1.154 86(19) nm,β=105.090(3)°,V=1.570 5(4)nm3;该化合物是中心对称的双核配合物,每个Cu(Ⅱ)离子都处于畸变四方锥配位环境;结构基元通过π-π相互作用和O-H…N氢键形成三维超分子。2的晶胞参数a=2.034 0(5)nm,b=1.183 2(3)nm,c=1.020 7(3)nm,V= 2.456 1(11)nm3;中心离子Ni(Ⅱ)的配位数为6,它处于畸变八面体配位环境。配合物有很高的热稳定性,分解温度分别为315℃(1)和358℃(2)。
烟酰腙;配合物;晶体结构;热稳定性
Schiff碱及其金属配合物在医药、农药、仿生模拟、催化剂、功能材料和荧光分析等方面具有广泛的应用前景[1-7],因而在药物化学、配位化学和材料化学等领域备受研究者的关注。Schiff碱结构丰富,通过对分子的修饰可以形成各种各样的结构类型,如水杨醛类、杂环类、含硫类、大环类和酰腙类等Schiff碱。酰腙类Schiff碱[8-13],尤其是含吡啶基酰腙类Schiff碱[14-15],有良好的生物药理活性,有很高的热稳定性和很强的配位能力。它的配位方式与酰腙的结构、介质的酸碱度、原料的配比、第二配体的影响以及金属离子电子构型的特点和金属盐的阴离子等因素有关[15-16]。为了获得更多的结构信息,作为我们研究工作的一部分[10-11,17],本文报道2,4-二羟基苯甲醛缩烟酸酰腙Cu(Ⅱ)配合物和2-乙酰基吡啶缩烟酸酰腙Ni(Ⅱ)配合物,分析了它们的晶体结构、光谱性质和热稳定性。
1 实验部分
1.1 仪器与试剂
德国Elmentar公司Vario EL型元素分析仪;DDS-307A型电导仪;德国塞驰STA 409 PC型综合热分析仪;美国Nicolet公司is10型FT-IR红外光谱仪;上海美普达UV-1800PC型紫外-可见分光光度计;德国Bruker公司Smart Apex CCD单晶衍射仪;美国Varian公司CARY/Eclipse型荧光分光光度计。2-乙酰基吡啶(98%),烟酸酰肼(98%),其他均为分析纯试剂。
1.2 配合物的合成
1.2.1 配合物[Cu(Py)(HL1)]2(1)的合成
将20 mmol烟酸肼和20 mmol2,4-二羟基苯甲醛溶于50 mL热乙醇中,加入1 mL冰醋酸,然后于80℃下加热搅拌回流2 h,冷却,放置一夜,自然发挥去除部分溶剂,析出大量淡黄色粉末配体(H3L1),抽滤,用无水乙醇洗涤数次,自然干燥备用。对C13H11N3O3的元素分析实测值(计算值)(%):C 60.63 (60.70),H 4.39(4.31),N 16.31(16.34)。IR(KBr,ν/ cm-1):3 415,3 171,3 019,1 646,1 639,1 609,1 576,1 508, 1 464,1 298,1 230,1 169,1 123,1 030,966,824,700,655。
将0.128 g(0.4 mmol)H3L1溶于5 mL DMF,0.080 g(0.4 mmol)Cu(Ac)2·H2O溶于1 mL吡啶和20 mL甲醇混合溶剂,然后将二者混合,于60℃下加热搅拌2 h,冷却至室温,过滤,滤液静置3 d后,析出1的黑色棒状晶体。对C36H28Cu2N8O6的元素分析实测值(计算值)(%):C 54.39(54.34),H 3.51(3.55),N 14.16(14.08)。IR(KBr,ν/cm-1):3 421,3 048,1 613, 1 593,1 535,1 521,1 472,1 448,1 218,1 173,1 130,1 042,981,845,751,696,641。
1.2.2 配合物[Ni(L2)2](2)的合成
HL2配体参照文献[16]的方法合成。对C13H12N4O的元素分析实测值(计算值)(%):C 65.08(65.02),H 5.16(5.00),N 23.42(23.32)。IR(KBr,ν/cm-1):3 256,1 672,1 648,1 589,1 541,1 438,1 284,1 155,1 023,991,906,834,787,709,699。
将0.096 g(0.4 mmol)HL2溶于5 mL DMF,0.099 g(0.4 mmol)Ni(Ac)2·4H2O溶于15 mL甲醇,然后将二者混合,于60℃下加热搅拌2 h,冷却至室温,过滤,滤液静置,1周后析出2的褐色立方体晶体。对C26H22N8NiO2的元素分析实测值(计算值) (%):C 58.21(58.13),H 4.02(4.10),N 20.81(20.85)。IR (KBr,ν/cm-1):1 591,1 579,1 559,1 498,1 459,1 370, 1 307,1 163,1 032,1 000,907,828,781,738,703,681。
1.3 晶体结构测试
选取1的0.12 mm×0.11 mm×0.08 mm和2的0.26 mm×0.24 mm×0.22 mm单晶置于单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ= 0.071073 nm)分别在2.12°~25.00°(1)和1.00°~28.00° (2)范围内,以φ~ω扫描方式于298(2)K(1)和293(2) K(2)下收集单晶衍射数据。全部强度数据均经Lp因子校正,并进行了经验吸收校正,晶体结构由直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正,氢原子由理论加氢法得到,结构解析采用SHELXS-97程序包,结构精修采用SHELXL-97(1)[18]和SHELXTL(2)[19]程序包。晶体学数据详见表1。主要键长和键角见表2和3。
2.牛副流行性感冒。剖检可见支气管肺炎和纤维素性胸膜炎变化,肺泡和细支气管上皮细胞肥大、增生,肺脏实变。
CCDC:1041107,1;1043828,2。
2 结果与讨论
2.1 晶体结构描述
2.1.1 配合物1的晶体结构
配合物1是一种具有中心对称的双核Cu(Ⅱ)配合物(图1),分子由2个-2价的2,4-二羟基苯甲醛缩烟酸酰腙配体(HL1)2-、2个吡啶分子和2个Cu(Ⅱ)离子所组成,化学式为[Cu(Py)(HL1)]2,核心是一个共平面的[Cu2(μ-O)2]。Cu…Cu距离为0.328 7(2)nm,每个铜原子都处于一个(4+1)四方锥的配位环境,其
中,(HL1)2-配体的1个酚盐μ-O、1个亚氨基N、1个酰腙基O(羰基烯醇化且脱除质子)和吡啶Py配体的N原子位于底面,另一对称酰腙配体相应的1个酚盐氧μ-O位于锥顶位置,铜原子与锥底4个配原子(O1,O2,N3和N4)形成的最小二乘面完全共平面。锥底邻位原子组成的键角为81.11(8)°~93.66(8)°,对角线原子键角为166.46(9)°~172.48(7)°,锥顶原子与锥底原子组成的键角为85.18(6)°~100.01(7)°。C13-O2-Cu1的键角为126.55(2)°,说明O2的杂化轨道由sp3转化为sp2。锥底Cu-O键长为0.189 3(2)~0.192 5(2)nm,与文献[20-22]值(0.188 8~0.192 2(2)nm)相似,比2-乙酰基吡啶缩异烟酰腙铜配合物[Cu(Ac)L]的键长(0.194 0~0.199 9 nm)[17]短;Cu-N(亚胺基)键长为0.190 4(2)nm,与2,4-二羟基苯甲酰腙铜配合物[Cu(L)DMF][20]接近,比文献值(0.195 2~0.208 7 nm)[21-23]短得多,Cu-N(Py)键长为0.199 2(2)nm,比5-氯水杨醛缩水杨酰腙铜配合物[Cu2(L)2(Py)2][21]中类似的键长(0.202 9~0.205 2 nm)短。轴向上Cu1-O2i键长0.253 2(2)nm,比类似结构的双核铜配合物[21,23]的(0.277 5(4)nm和0.271 9(5) nm)短得多。

表1 配合物1和2的晶体学数据Table 1 Crystallographic data for 1 and 2
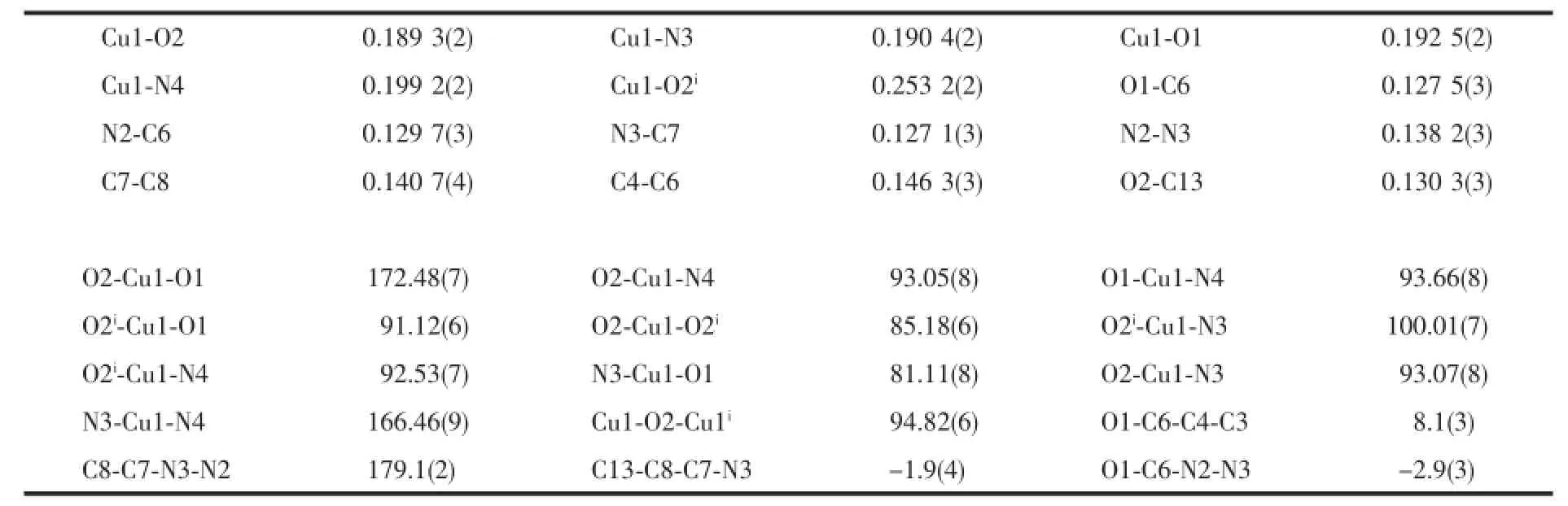
表2 配合物1的主要键长(nm)、键角和扭转角(°)Table 2 Selected bond lengths(nm),bond angles and torsion angles(°)for 1
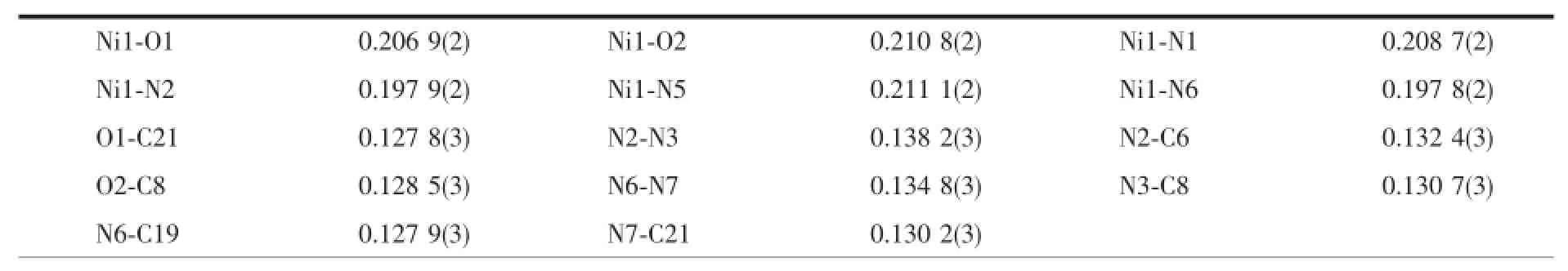
表3 配合物2的主要键长(nm)、键角和扭转角(°)Table 3 Selected bond lengths(nm),bond angles and torsion angle(°)for 2
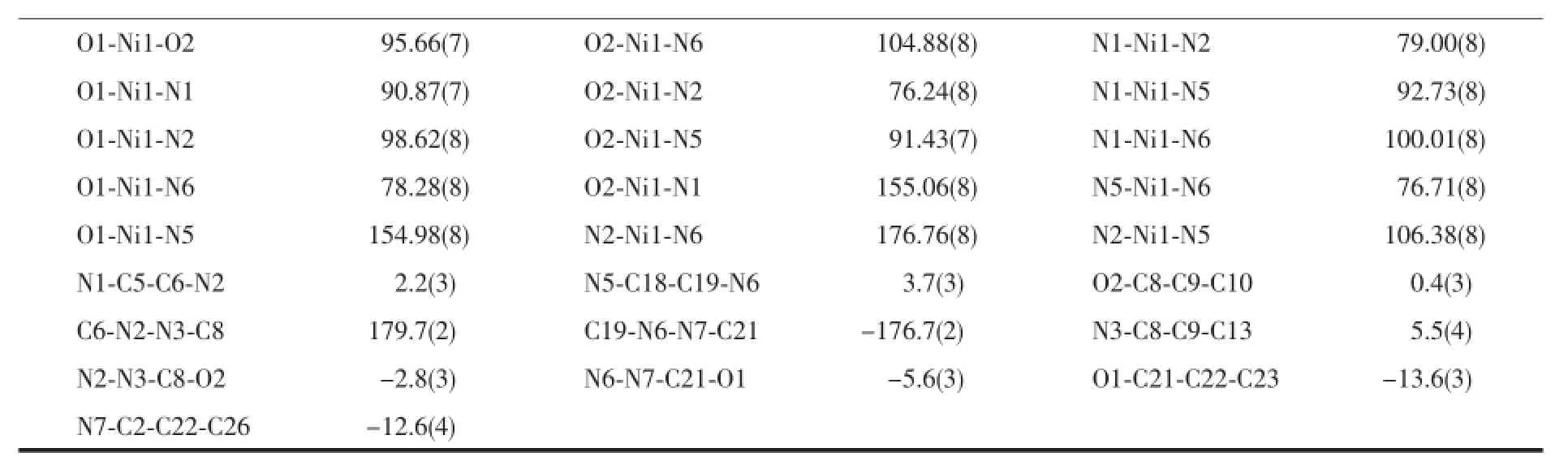
续表3

图1 配合物1分子结构图(椭球率30%)Fig.1 Molecular structure of 1 with 30%probability ellipsoids
扭转角C8-C7-N3-N2(179.1(2)°)、C13-C8-C7-N3 (-1.9(4)°)和O1-C6-N2-N3(-2.9(3)°)说明苯环与酰腙基团存在较强共轭作用,致使C7-C8键长(0.140 7(4) nm)接近C=C双键;而C4-C6键长(0.146 3(3)nm)呈现单键特征,原因是吡啶环与酰腙基团共轭程度小,扭转角O1-C6-C4-C3为8.1(3)°。苯环与吡啶环二面角约为6°。相邻的双核结构基元的酰腙部分的苯环与吡啶环相互平行,Cg1…Cg2ii质心间距为0.352 44(4)nm,小于0.38 nm,说明二者之间存在弱的π-π相互作用,从而沿a轴方向形成一维超分子链(图2);而未配位的羟基与相邻分子的烟酰基片段吡啶N的分子间氢键O-H…N(0.267 1(3)nm)将配合物进一步扩展为三维超分子网络(图3)。

图2 配合物1中沿a轴方向分子间的π…π相互作用Fig.2 Intermolecularπ…πinteractions along a axis in the 1
2.1.2 配合物2的晶体结构

图3 配合物1中通过氢键和π…π相互作用形成的三维超分子网络Fig.3 3D supermolecular network via O-H…N hydrogen bonds andπ…πinteractions in 1

图4 配合物2的分子结构(椭球率30%)Fig.4 Molecular structure of complex 2 with 30% probability ellipsoids
2.2 红外光谱和电子光谱
红外光谱中,配体H3L1和HL2在3 171和3 256 cm-1处吸收峰归属次氨基的N-H伸缩振动,在1 646和1 639及1 672和1 648 cm-1的强吸收峰分别归属羰基C=O和亚胺基C=N的伸缩振动,3 189 cm-1来自酰胺基团CO(NH)的N-H伸缩振动。形成配合物1和2后N-H和C=O的伸缩振动吸收峰均消失,表明酰胺基团以烯醇式去质子化与金属离子配位。1和2中C=N伸缩振动分别红移到1 613和1 591 cm-1,红移了26和43 cm-1,表明了亚胺基的氮原子参与了配位。

表4 配合物2中弱的C-H…O和C-H…π相互作用Table 4 Weak C-H…O and C-H…πinteractions in 2a,b
配体及其配合物紫外可见光谱见图5。配体H3L1在259、305和339 nm处的吸收带分别归属为π→π*电子跃迁、C=N的n→π*电子跃迁和配体内的电荷转移跃迁(ILCT),形成配合物1后由于共轭程度增大而导致π→π*电子跃迁(271 nm)和n→π*电子跃迁(317 nm)发生红移,而ILCT(337 nm)减弱,同时在393 nm处出现一个很强的新的吸收峰,归属于配体到金属的荷移跃迁(LMCT)。配体HL2的287和367 nm吸收归属π→π*电子跃迁和n→π*电子跃迁,形成配合物2后由于其中一个配体的吡啶基与其他原子的平面发生较大的偏离,导致π→π*电子跃迁分裂为262和289 nm;386 nm处出现的新的强吸收带归属配体到金属的LMCT,从而进一步证明金属与配体配位。

图5 配体及配合物的紫外可见光谱Fig.5 UV-Vis spectra of the ligand and complexes
2.3 配合物的热稳定性
以10℃·min-1的升温速率,在N2气氛下于室温~800℃范围测试了配合物的热稳定性(图6)。结果表明配合物1和2具有很高的热稳定性。配合物1从315℃开始分解,315~393℃快速失重34.5%,可能与失去吡啶配体和酰腙配体的吡啶基片段有关(计算值39.5%),之后炭化持续缓慢失重,至800℃残重50%。配合物2分解分两阶段,358~391℃快速失重48.9%,可能与脱除酰肼部分的吡啶基和N2以及甲基有关(计算值49.5%),391~702℃炭化失重18.0%,至800℃残重27.9%。

图6 配合物1和2的热重分析图Fig.6 TG curves of the 1 and 2
[1]Bazzicalupi C,Bencini A,Bianchi A,et al.Coord.Chem. Rev.,2008,252:1052-1068
[2]Saadeh H A,Shaireh E A A,Mosleh I M,et al.Med.Chem. Res.,2012,21:2969-2974
[3]Grivani G,Ghavami A,KuerákováM,et al.J Mol.Struct., 2014,1076(5):326-332
[4]Ray S,Konar S,Jana A,et al.J.Mol.Struct.,2014,1058 (24):213-220
[5]WANG Yan(王彦),LIU Guang-Xiang(刘光祥).Chinese J. Inorg.Chem.(无机化学学报),2009,25(4):713-719
[6]HUO Yong-Qian(霍涌前),WANG Sheng-Wen(王升文),CUI Hua-Li(崔华莉),et al.Chinese J.Inorg.Chem.(无机化学学报),2010,26(7):1274-1278
[7]Qin X T,Ding S,Xu X B,et al.Polyhedron,2014,83(24): 36-43
[8]Ainscough E W,Brodie A M,Dobbs A J,et al.Inorg.Chim. Acta,1998,267:27-38
[9]Richardson D R,Becker E,Bernhardt P V.Acta Cryst.,1999, C55:2102-2105
[10]XIE Qing-Fan(解庆范),GAO Ping-Zhang(高平章),CHEN Yan-Min(陈延民).Chinese J.Inorg.Chem.(无机化学学报), 2014,30(10):2382-2388
[11]CHEN Yan-Min(陈延民),XIE Qing-Fan(解庆范),WEI Zan-Bin(魏赞斌),et al.Chinese J.Inorg.Chem.(无机化学学报), 2014,30(6):1243-1249
[12]Ebrahimipour S Y,Khabazadeh H,Castro J,et al.Inorg. Chim.Acta,2015,427:52-61
[13]You Z L,Shi D H,Zhang J C,et al.Inorg.Chim.Acta, 2012,384:54-61
[14]Mondal S,Naskar S,Dey A K,et al.Inorg.Chim.Acta, 2013,398:98-105
[15]Khandar A A,Afkhami F A,Hosseini-Yazdi S A,et al. Inorg.Chim.Acta,2015,427:87-96
[16]Yi L J,Xu G C,Zhang L,et al.Inorg.Chem.Commun., 2014,45:6-39
[17]CHEN Yan-Min(陈延民),XIE Qing-Fan(解庆范),LIU Jin-Hua(刘金花),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(1):74-80
[18]Sheldrick G M.SHELX-97,Program for X-ray CrystalStructure Solution and Refinement,University of Göttingen, Germany,1997.
[19]Sheldrick G M.SHELXTL,Program for X-ray Crystal Structure Solution and Refinement,University of Göttingen, Germany,1997.
[20]WANG Hui(王慧),GAN Guo-Qing(甘国庆),QU Yang(瞿阳),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28 (6):1217-1221
[21]WU Qiong-Jie(吴琼洁),CHEN Xiao-Hua(陈小华),CAI Bi-Qiong(蔡碧琼),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(1):201-206
[22]ZHENG Chang-Zheng(郑长征),WANG Yan-Yan(王燕燕), WANG Liang(王亮).Chinese J.Inorg.Chem.(无机化学学报),2014,30(7):1474-1480
[23]QIU Xiao-Yang(仇晓阳).Chinese J.Inorg.Chem.(无机化学学报),2014,30(7):1667-1672
Syntheses,Crystal Structures and Properties of Copper(Ⅱ)and Nickel(Ⅱ) Complexes Based on Nicotinoyl Hydrazone Schiff Base
CHU Zhao-Hua1XIE Qing-Fan2LIYing-Qian2CHEN Yan-Min*,2
(1Department of Chemistry,HanShan Normal University,Chaozhou,Guangdong 521041,China)
(2College of Chemistry&Life Science,Quanzhou Normal University,Quanzhou,Fujian 362000,China)
The copper(Ⅱ)and nickel(Ⅱ)complexes ofnicotinoylhydrazone Schiffbase,[Cu(Py)(HL1)]2(1)and[Ni(L2)2] (2),where H3L1is pyridine-3-carboxylic acid(2,4-dihydroxy-benzylidene)hydrazide,HL2is pyridine-3-carboxylic acid(pyridine-2-yl ethylidyne)hydrazide,were respectively synthesized by slow evaporation methods in mixedsolvent,and characterized by elementalanalysis,IR,UV-Vis,FL spectra,TGA and single crystal X-ray diffraction. The crystals of1 and 2 belongs to the monoclinic system,space group P21/c with cell parameters(1)a=0.739 86(12) nm,b=1.903 7(3)nm,c=1.154 86(19)nm,β=105.090(3)°,V=1.570 5(4)nm3and(2)a=2.034 0(5)nm,b=1.183 2(3) nm,c=1.020 7(3)nm,V=2.456 1(11)nm3.The complex 1 is a centrosymmetric binuclear complex with Cu(Ⅱ) ions in square pyramidalgeometry.The structure units of 1 are linked by intermolecularπ-πinteractions and OH…N hydrogen bonds,forming three-dimensional supermolecular network.In 2,the Ni(Ⅱ)ions act as distorted octahedral geometry,being surrounded by two imine nitrogen atoms,two deprotonated amide oxygen atoms and two pyridyl nitrogen atoms from two monovalence anions of HL2ligand.The tests showed the two complexes displayed good thermal stability below 315℃(1)和358℃(2),respectively.CCDC:1041107,1;1043828,2.
nicotinoyl hydrazone;complexes;crystal structure;thermal stability
O614.1
A
1001-4861(2015)07-1380-07
10.11862/CJIC.2015.189
2015-04-11。收修改稿日期:2015-05-27。
福建省教育厅A类重点项目(No.JA14261),2014年国家级大学生创新创业训练计划项目(No.201410399017)资助。
*通讯联系人。E-mail:qzucym@163.com;会员登记号:S06N2113M1304。

