微囊性附属器癌1例报道及文献复习
朱旭友,易祥华,梁 军,范德生,顾 俊,邱维喆
微囊性附属器癌1例报道及文献复习
朱旭友,易祥华,梁 军,范德生,顾 俊,邱维喆
同济大学附属同济医院病理科,上海 200065
目的 探讨微囊性附属器癌(microcystic adnexal carcinoma,MAC)患者的临床病理特征,以提高对该病的诊断水平。方法 观察1例MAC患者的临床表现、影像学特点,分析手术标本病理形态特征及免疫组织化学表型,并结合文献进行探讨。结果 患者为老年男性,临床表现为腋下肿物伴有疼痛;CT示团片状稍低密度软组织影,增强见不均匀强化;病理示肿瘤细胞呈条索、细胞簇及腺样结构,异型性显著;免疫组化显示瘤细胞AE1/AE3,CK19和EMA染色阳性。结论 MAC是一种低度恶性肿瘤;手术不易彻底切除,复发率较高;对于活检的标本极易误诊,明确诊断依赖手术切除标本。
微囊性附属器癌;诊断;鉴别诊断
微囊性附属器癌(m icrocystic adnexal carcinoma,MAC)是一种少见的局部侵袭性的恶性附属器肿瘤。具有向毛囊和汗腺双向分化和硬化性间质的低度恶性肿瘤,为汗腺癌的一种特殊亚型。发生在头面部较多。本文报道1例发生在左腋下的MAC,并结合文献复习探讨MAC的临床病理特征,以提高对该病的诊断。
1 材料与方法
1.1 临床资料
患者,男,79岁。4月前无意中发现左侧腋下一肿物,直径约2cm,伴有疼痛,局部皮肤发红,无破溃,于我院门诊就诊,考虑软组织感染,予抗感染对症治疗。3个月前于外院就诊,行活检,病理示“副乳腺组织,伴炎性纤维组织增生”。2个月前再次于我院门诊就诊,CT检查提示“左腋窝前壁皮下团片状稍低密度软组织影,增强后见明显不均匀强化,大小约2.7cm×1.7cm,考虑恶性肿瘤可能”(图1)。查体:左腋下可见陈旧性手术疤痕,可及肿块约4cm×4cm大小,质硬,轻度压痛,无明显活动性,左腋下皮肤干燥,色素沉着,未及肿大淋巴结。既往史:50余年前因“臭汗症”行双侧腋窝大汗腺切除术,否认肝炎、结核、疟疾病史,否认高血压、心脏病史,否认糖尿病、脑血管疾病、精神疾病史,否认其他手术、外伤、输血史,否认食物、药物过敏史。手术沿左腋下肿块周围梭形切开,切口长约4 cm,切开皮肤,皮下脂肪,沿两侧分离,保留皮下脂肪层2mm,完整切除肿块。
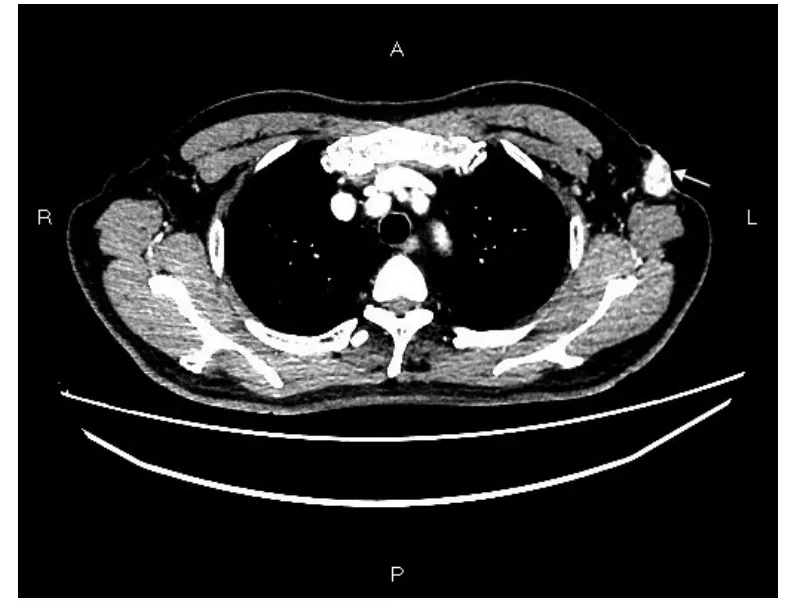
图1 CT示左腋窝前壁皮下团片状稍低密度软组织影,增强后见明显不均匀强化(箭头示)Fig.1 CT demonstrated,a slightly lower density of the mass in the left anterior axillary,with heterogenous enhancement.(Arrow)
1.2 方法
手术标本经4%中性甲醛溶液固定,常规石蜡包埋后切片,厚为4~5μm苏木精-伊红(HE)染色、碘酸雪夫(D-PAS)特殊染色后于光学显微镜下观察。免疫组化采用EnVision二步法,DAB显色,苏木精复染,一抗包括:AE1/AE3、CK19、P63、EMA、CK7、S-100、Ber-EP4、SMA、Ki-67、CEA、ER、GCDFP-15、P53、bcl-2、CK20、C-erbB-2和CD34,试剂为DAKO公司产品。
2 结果
2.1 大体检查
带皮肤组织一块,大小4cm×3cm×2.5cm,皮肤大小4cm×2.5cm,皮肤表面高低不平,中央见灰红突起,大小2cm×1.5cm×0.5cm,已切开,切面见灰白色肿块,大小2.8cm×2.5cm×1.8cm,质实稍硬,边界欠清(图2)。
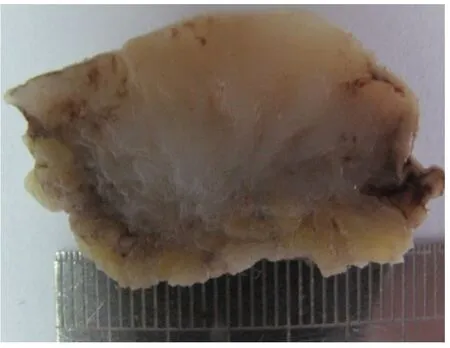
图2 大体示切面灰白色,质实稍硬,边界欠清Fig.2 The grossappearance,a grey-whitemass with obscure boundar and little hard consistency in cut surface
2.2 镜检
表浅部为小的实性或囊性结构,小至中等大小的角囊肿,似毛囊漏斗部小囊肿和导管(图3)。中层小导管腔内有PAS阳性的嗜酸性物质(图4),可见囊内容物钙化,神经见肿瘤侵犯。深部为间质硬化及肿瘤细胞呈条索、细胞簇及腺样结构(图5),并呈侵袭性生长。细胞核异型性明显(图6),未见明显核分裂象。
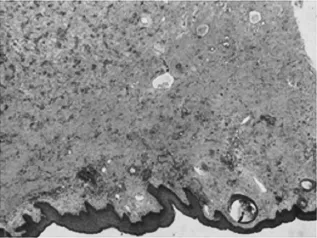
图3 低倍表浅可见小至中等大小的角囊肿,似毛囊漏斗部小囊肿和导管(HE×40)Fig.3 In low power field,sm all tom edium size cysts seem to be cystsand ducts in the hair in fundibu lar in super ficial tissue(HE×40)
2.3 免疫组织化学染色
AE1/AE3(图7)+,CK19+,P63+,EMA+,CK7部分+,S-100部分+,CEA-,ER-,GCDFP-15-,SMA-,Ki-67+(<5%),P53-,Ber-EP4部分+,bcl-2-,CK20-,C-erbB-2-,CD34-。特殊染色:PAS+(图8)。
2.4 病理诊断
(左腋下)微囊性附属器癌。术后患者愈合良好,门诊随访中。
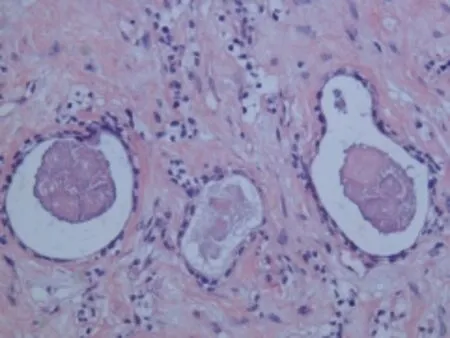
图4 中层小导管腔内有嗜酸性物质(HE×200)Fig.4 Eosinophilswere observed in the lumen of the middle layer(HE×200)
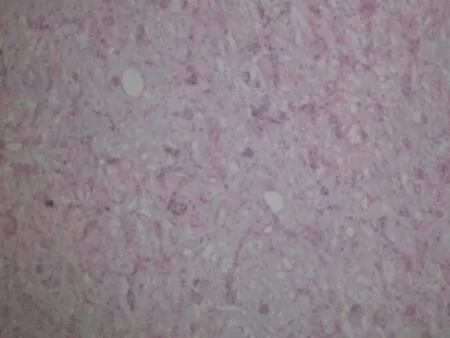
图5 深部间质硬化及肿瘤细胞呈条索、细胞簇及腺样结构(HE×100)Fig.5 In deep ly isclerosing stroma,tumor cellsarranged in funicular,cell clustersand adenoid structures.(HE×100)
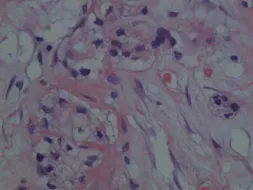
图6 细胞核异型性明显(HE×400)Fig.6 Nuclears showed obviousatypia(HE×400)
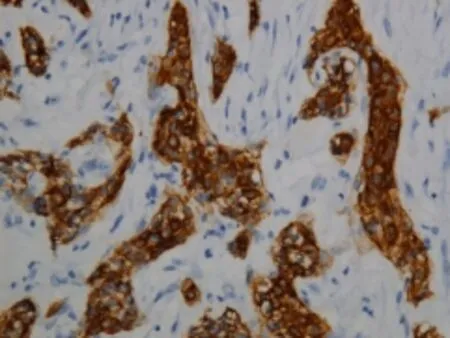
图7 免疫组化AE1/AE3弥漫强阳性(EnVison法×200)Fig.7 Diffuse strong positive staining of AE1/AE3wasobserved by imm unohistochem istry in tumor cells(EnVisonmethod×200)
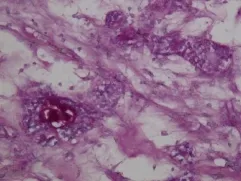
图8 导管腔内嗜酸性物质PAS染色阳性(PAS染色×200)Fig.8 PASpositivematerialwasobserved in lumen of duct(PAS staining×200)
3 讨论
微囊性附属器癌又称为硬化性汗腺导管癌、小汗腺上皮瘤、汗管瘤样癌,是一种向毛囊和汗腺双向分化、局部浸润性生长和硬化性间质的低度恶性肿瘤。1982年由Goldstein等[1]首先报道。
MAC好发成人头面部皮肤[2],亦可见颈部、躯干、乳房和腋窝,较少见臀部、手掌、脚趾、外阴及肛周处皮肤。女性更为常见,发病年龄6~90岁,大多在41~60岁发病,偶见于儿童[3],先天性病例更加少见[4],肿瘤生长缓慢,病史持续数月到数年,有的病例可达数十年[5]。临床主要表现为非对称性局限性结节斑块或囊样结构,高出皮面,平均直径小于2cm,表面皮肤可正常或鳞屑或萎缩。一般无临床症状,部分患者出现麻木、瘙痒、灼热及疼痛等感觉异常,大多因肿瘤浸润神经而至。肿瘤以局部浸润和破坏为主,转移能力很低。术前光学相干断层扫描(OCT)对于判断肿块的大小及深度均有重要帮助[6]。本例患者为老年男性,病史约为4月余,发病初就伴有疼痛。
MAC病因大部分不明确,少数病例继发于局部皮肤放疗后,其他可能因素包括紫外线和免疫缺陷,本例患者50年前有过双侧腋窝切除大汗腺的手术史,本病的发生可能与手术有关。肿瘤来源多潜能附属器角阮细胞,在发展过程中分化不完善,故分化多样。MAC典型的组织学表现为:表浅部为小的实性或囊性结构,小至中等大小的角囊肿,似毛囊漏斗部小囊肿和导管。中层完全由小导管构成,结构精细,常侵犯神经及神经周隙,腔内有PAS阳性的嗜酸性物质,偶见囊内容物钙化。深部为间质硬化及肿瘤细胞呈条索、细胞簇及腺样呈印第安火把样排列,并呈侵袭性生长。少数病例伴皮脂腺细胞分化区,还有些可见相似毛鞘分化区,这些现象提示向毛-皮脂腺-大汗腺单位分化。有时病变完全由导管构成,故有“汗管瘤样癌”或“硬化性汗腺导管癌”之称[7]。提示这些肿瘤可能来源小汗腺导管。免疫显示肿瘤细胞胞浆AE1/AE3、CK7和bcl-2呈阳性表达,导管腔面细胞膜可表达EMA和Ber-EP4,小管外周细胞为α-SMA及S-100阳性。P63在小管外周细胞中多阳性表达,而其中央的细胞多阴性,在真皮深部这种表达更加明显[8]。P53阳性的肿瘤细胞大约不超过25%。瘤细胞增值指数较低,Ki-67阳性细胞数小于5%[9]。CK20、C-erb-B2和CD34均为阴性。观察本例患者免疫组化结果肿瘤细胞弥漫表达AE1/AE3、CK19及EMA,部分导管腔面细胞表达CK7及Ber-EP4,而外周细胞弥漫表达P63及散在表达S-100,肿瘤细胞显示SMA、CEA、ER、GCDFP-15、bcl-2、CK20、C-erbB-2、CD34及P53均为阴性表达,增值指数Ki-67阳性细胞数少(<5%)。
MAC由于肿瘤细胞具有多向分化、瘤细胞分化良好及细胞周围呈致密的纤维间质等特点,应鉴别诊断的疾病有:①促结缔组织增生性毛发上皮瘤[10],主要累及真皮浅层,肿瘤边界光滑,瘤巢周围的细胞呈栅栏状排列,肿瘤细胞无向汗腺分化的特点;②硬化性基底细胞癌,临床表现为扁平斑块,瘢痕样,组织学主要由基底样肿瘤细胞组成大小不一的团、索,无明显腺腔分化,其与周围组织之间常有收缩的组织间隙,肿瘤细胞密集,无明显的良性细胞,也无毛囊及汗腺分化特点;③汗管瘤等汗腺分化的良性肿瘤,仅是浅部组织活检的病例,MAC与汗管瘤很难区分。汗管瘤缺乏角质形成细胞和异型性改变。一般良性肿瘤中细胞质染色细腻,分化成熟,双层结构保留,更不会出现侵犯神经等改变;④鳞状细胞癌,肿瘤多处与表皮相连,细胞核异型明显,核分裂象较多见,无导管分化的特点。对于活检的标本极易误诊,本病例的活检下HE形态小管状结构就被误认为是副乳腺组织。
MAC治疗以Mohs显微外科手术或者局部扩大切除治疗为主,术后可以局部放疗[11-12]。但局部放疗对本瘤的疗效还不肯定,有些病例局部放疗后不仅对MAC的治疗无效,而且诱导其转移潜能的增加。近来,有报道对一些具有术后复发倾向或病变范围较大、手术难以切除的病变给予局部放疗,可有效控制肿瘤复发或使肿瘤部分消退[13-14]。对于Mohs显微外科手术患者其复发率较低[15]甚至为零。对于局部手术切除后复发率达40%~60%,少数可发生淋巴结转移,其主要由于肿瘤边界不清,肿瘤细胞浸润较深,大多数肿瘤边缘超出临床所见的范围,手术不易彻底切除。据报道,肿瘤切除30年后仍可复发[16],因此长期的门诊随访尤其重要。
[1] Goldstein DJ,Barr RJ.Santa Cruz DJ.M icrocystic adnexal carcinoma;a distinct clincopathologic entity[J].Cancer,1982,50(3):566-572.
[2] Yu JB,Blitzblau RC,Patel SC,etal.Surveillance epidem iology and end results(SEER) database analysis of m icrocystic adnexal carcinoma(sclerosing sweatductcarcinoma)of the skin [J].Am JClin Oncol,2010,3(2):125-127.
[3] Nelson PS,Bourgeois KM,Nicotri T Jr,et al.Sclerosing sweat duct carcinoma in a 6-year-old A frican American child[J].Pediatr Dermatol,2008,25(1):38-42.
[4] Smart DR,Taintor AR,Kelly ME,et al.M icrocystic adnexal carcinoma:the first reported congenital case[J].Pediatr Dermatol,2011,28(1):35-38.
[5] Liyanage SE,Saleh GM,Rose GE,et al.Delayed diagnosis of m icrocystic adnexal carcinoma in progressive eyelid distortion [J].A rch Ophthalmol,2010,128(1):132-135.
[6] A law iSA,Batz S,Röwert-Huber J.etal.Correlation of optical coherence tomography and histology in microcystic adnexal carcinoma:acase report[J].SkinResTechnol,2015,21(1):15-17.
[7] Schaller J,Rytina E,Rütten A,et al.Sweat duct proliferation associated with aggregates of elastic tissue and atrophoderm ia verm iculata:a simulator of microcystic adnexal carcinoma.Reportof two cases[J].JCutan Pathol.2010,37(9):1002-1009.
[8] Vidal CI,Goldberg M,Burstein DE,et al.P63 immunohistochem istry is a useful adjunct in distinguishing sclerosing cutaneous tumors[J].Am JDermatopath,2010,32(3):257-261.
[9] LeBoitPE,Burg G,Weedon D,etal.世界卫生组织肿瘤分类及诊断标准系列—皮肤肿瘤病理学和遗传学[M].廖松林,译.北京:人民卫生出版社,2006.
[10] Tse JY,Nguyen AT, Le LP,et al.Microcystic adnexal carcinoma versus desmoplastic trichoepithelioma:a comparative study[J].Am JDermatopathol.2013,35(1):50-55.
[11] Diamantis SA,Marks VJ.Mohs m icrographic surgery in the treatment of microcystic adnexal carcinoma[J].Dermatol Clin,2011,29(2):185-190.
[12] Kim LH,Teston L,Sasani S,et al.Microcysticadnexal carcinoma:successfulmanagement of a large scalp lesion[J].J Plast Surg Hand Surg,2014,48(2):158-160.
[13] Baxi S,Deb S,Weedon D,etal.M icrocystic adnexal carcinoma of the skin:the role of adjuvant radiotherapy[J].JM ed Imaging RadintOncol,2010,54(5):477-482.
[14] Pugh TJ,Lee NY,Pacheco T,et al.M icrocystic adnexal carcinoma of the face treated with radiation therapy:a case reportand review of the literature[J].Head Neck,2012,34(7):1045-1050.
[15] Chaudhari SP,Mortazie MB,Blattner CM,etal.Treatments for Microcystic Adnexal Carcinoma—A Review[J].JDermatolog Treat.2015,Sep2:1-20.
[16] Lupton GP,McMarLin SL.Microcystic adnexal carcinoma.Reportof a case with 30-year follow-up.Arch Dermatol,1986,122(3):286-289.
Microcystic adnexal carcinom a:clinicaland pathologic analysis and review of literature
ZHU Xuyou,YIXianghua,LIANG Jun,FANDesheng,GU Jun,QIUWeizhe
DepartmentofPathology,TongjiHospital,TongjiUniversity SchoolofMedicine,Shanghai200065,China
Objective To investigate the clinicopathologic characteristics of m icrocystic adnexal carcinoma (MAC)for improving the diagnosis.M ethods One case of MAC was observed for its clinical symptoms,imaging features,the pathological characteristics and immunohistochem ical phenotypes of surgical specimenswere analysed,and the relevant literatures were also reviewed.Resu lts The main clinical manifestation of this old male patient was characterized by axillary mass with pain.A slightly lower density of the mass was shown by chest CT.Meanwhile,unevenly consolidated was detected by enhanced CT.The pathological sections demonstrated that funicular tumor cells,cell clusters and adenoid structures formed.Moreover,positive staining of AE1/AE3,CK19 and EMA were observed by immunohistochem istry in tumor cells.Conclusion MAC is a low-grademalignancy.In addition,its complete resection rate is lower,and the postoperative recurrence rate is higher.It is easy to bem isdiagnosed by biopsy,and depends on surgicalspecimen to confirm the diagnosis.
Microcystic adnexal carcinoma;Diagnosis;Differentialdiagnosis
R739.5
B
2095-378X(2015)03-0192-04
10.3969/j.issn.2095-378X.2015.03.015
朱旭友(1983—),男,主治医师,硕士,研究肿瘤病理学通信作者:梁 军,电子信箱:juneliang05@163.com

