核输入蛋白α/β真核表达载体的构建及细胞内定位
罗晓丽 ,周蕾,丁丽华,张亚楠,刘婕,贾晓蒙,陈滢洁,熊加秀,陈志达,叶棋浓,赵丽纯
1.吉林大学 药学院,吉林 长春 130021;2.首都医科大学 附属北京世纪坛医院肿瘤内科,北京 100038;3.军事医学科学院 生物工程研究所,北京 100850
细胞外信号主要通过相应受体及细胞内信号转导从而引起细胞发生核反应,在细胞增殖、分化、发育、凋亡及与细胞反应有关的物质合成调控中起重要作用。进入胞质的信号分子及其活化产物必须通过核膜进入细胞核,才可以引起核反应。真核细胞核膜上分布的核孔复合体(nuclear pore complex,NPC)是细胞核内外进行物质交换的主要通道,分子较小的化合物可自由通过NPC或采取被动扩散的方式进入细胞核,而相对分子质量在50 000以上的蛋白则通过主动转运进入细胞核[1],而核输入蛋白(importin)能帮助具有核定位信号(nuclear localization signal,NLS)的蛋白质入核,在蛋白质的入核过程中发挥十分重要的作用。核输入蛋白有α和β两种亚基,存在于胞质中,入核蛋白通过NLS识别细胞质内的核输入蛋白α,并与之结合形成“核输入蛋白-底物”二聚体,再与核输入蛋白β形成复合物,帮助入核蛋白通过NPC 进入核内,在核内RanGTP 酶的作用下,复合物发生解聚,入核蛋白被释放在核内[2],而核输入蛋白与RanGTP 形成新的复合物通过NPC重返细胞质,在胞质内RanGTP 水解为RanGDP,同时核输入蛋白被释放参与新一轮的入核转运[3]。
我们拟构建核输入蛋白α/β的真核表达载体,并通过免疫荧光染色技术确定其细胞定位,为进一步研究其生物活性及应用奠定基础。
1 材料和方法
1.1 材料
人胚肾293T 细胞、pXJ-40-myc 载体来自军事医学科学院生物工程研究所;限制性内切酶、DNA连接酶、PCR 试剂购自TaKaRa 公司;VigoFect 购自威格拉斯生物技术有限公司;质粒提取、胶回收、PCR回收试剂盒购自Promega公司;DMEM及小牛血清购自Gibco公司;引物由北京赛百盛基因技术有限公司合成;测序由北京奥科生物技术有限公司完成。
1.2 myc-Importin α/β重组质粒的构建与测序
以乳腺癌文库为模板,根据文献报道的核输入蛋白α/β的编码序列[4-5]合成引物。核输入蛋白α上游引物为5'-CGGGATCCATGTCCACCAACGAGAA TGC-3',下游引物为5'-ATAAGAATGCGGCCGCCT AAAAGTTAAAGGTCCCAGG-3';核输入蛋白β上游引物为5'-CGGGATCCATGGAGCTGATCACCATTC TCG-3',下游引物为5'-ATAAGAATGCGGCCGCTC AAGCTTGGTTCTTCAGTTTC-3'。按以下条件进行PCR 扩增:95℃预变性5 min;95℃变性30 s,65℃退火30 s,72℃延伸3.5 min,30个循环;72℃7 min再延长。用胶回收试剂盒回收PCR产物。
用BamHⅠ/NotⅠ双酶切pXJ-40-myc 载体,经10 g/L 琼脂糖凝胶电泳后,胶回收载体大片段;将PCR片段回收后再用BamHⅠ/NotⅠ酶切,形成带有与载体相同黏性末端的双链,用T4DNA连接酶连接入pXJ-40-myc 载体,转化大肠杆菌DH5α,挑选克隆,液体培养基振荡培养并提取质粒,用BamHⅠ/NotⅠ双酶切鉴定,鉴定正确的克隆送北京奥科生物技术有限公司测序。
1.3 细胞转染和Western印迹检测
按常规方法进行转染。用含双抗、含100 mL/L胎牛血清的DMEM 培养基将293T细胞接种于6 cm皿中,接种量以转染时细胞密度达到80%为宜,培养24 h 后进行转染,转染前1 h 换液。将4 μL Vigo-Fect 与200 μL NaCl 混合,再将总量为10 μg 的重组质粒与200 μL NaCl 混合,然后将上述2 种溶液轻轻混合,室温放置15 min,加入6 cm皿中,并以同样方法转染空pXJ-40-myc 载体作为对照,37℃、5% CO2常规培养,4~6 h换液。质粒转染293T细胞24 h 后收集细胞蛋白,加入2×SDS 加样缓冲液,煮沸10 min,高速离心2 min,取上清液进行SDSPAGE 后,电转移至硝酸纤维素膜上;用5%脱脂奶粉于4℃封闭过夜,加入用5%脱脂奶粉以1∶5000稀释的用HRP 标记的抗myc 标签鼠单克隆抗体,室温轻摇1 h,TBST洗膜3次,每次5 min;用化学发光法显色5 min,压片显影。
1.4 免疫荧光检测
将转染后培养24 h的24孔板从培养箱中取出,1×PBS 洗3 次;用40 g/L 多聚甲醛固定20 min,1×PBS洗3次,每次10 min;加入含0.5% Triton X-100和1%羊血清的PBS 冰上渗透10 min;用含1%羊血清的PBS 封闭30 min,滴加Alexa Fluor 594 标记的抗myc-tag 抗体(1∶2000),室温孵育1 h;1×PBS 洗3次,每次10 min;用0.1 g/mL DAPI染核,1×PBS洗2次,每次5 min;封片,于荧光显微镜下观察。
2 结果
2.1 myc-Importin α/β重组质粒的构建与鉴定
以本实验室保存的乳腺癌文库为模板,PCR 扩增核输入蛋白α/β的编码序列,分别获得约1590 和2630 bp 的DNA 片段,与预期大小一致(图1)。将PCR产物用BamHⅠ/NotⅠ双酶切后,再与经相同酶切的pXJ-40-myc 载体连接,转化大肠杆菌DH5α,挑选克隆进行菌液PCR 鉴定,初步筛选带有核输入蛋白α/β基因的阳性重组克隆。将所得阳性克隆提质粒,经酶切鉴定均可切出2 条长度分别约为5000和1590 bp 及5000 和2630 bp 的条带,符合预期结果(图2)。DNA序列测定结果表明插入片段的DNA序列与核输入蛋白α/β基因的编码序列完全一致(数据略)。
2.2 Western 印迹检测myc-Importin α/β在293T 细胞中的表达
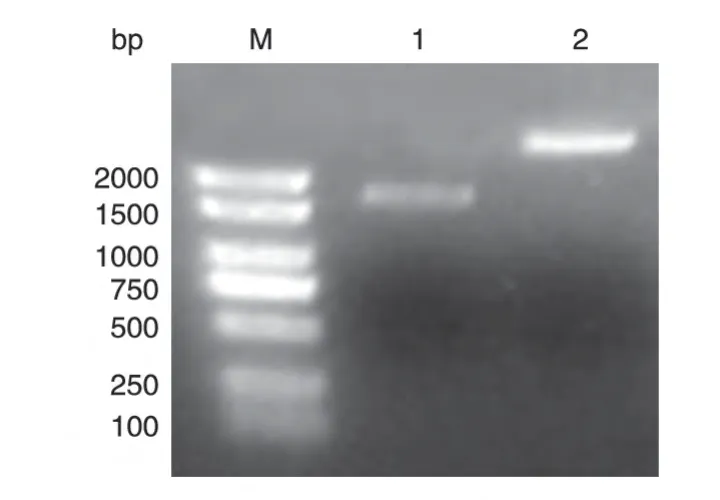
图1 PCR扩增核输入蛋白α/β的编码序列
将构建的myc-Importin α/β重组质粒和myc 空载体分别转染293T 细胞系,24 h 后提取蛋白进行SDS-PAGE,Western 印迹检测蛋白表达。结果显示,转染重组质粒后,用myc-HRP 抗体能够在相对分子质量约62×103和100×103大小处分别检测到明显的特异性条带,空载体无条带(图3),说明重组蛋白在293T细胞中能够正确表达。
2.3 荧光显微镜观察myc-Importin α/β在293T 细胞中的定位
为了了解核输入蛋白α/β在细胞中的定位,将构建的myc-Importin α/β重组质粒和空载体分别转染293T细胞系,培养24 h后在显微镜下观察。结果显示,在转染myc-Importin α重组质粒的293T细胞中,红色荧光在细胞质与细胞核中均有分布;而转染myc-Importin β重组质粒的293T 细胞中,红色荧光主要集中于细胞核。说明myc-核输入蛋白α融合蛋白表达后在293T 细胞质与细胞核中均有分布,而myc-核输入蛋白β融合蛋白主要定位于细胞核(图4)。
据文献报道,核输入蛋白存在于细胞质中,运送蛋白进入细胞核[6],而在本实验中通过免疫荧光检测到核输入蛋白α存在于细胞质和细胞核,而核输入蛋白β主要存在于细胞核。我们认为细胞转运所描述的是一个动态过程,而免疫荧光技术是把蛋白固定在了一个时间点再进行检测,另外可能由于实验方法的不同,所以出现了其主要定位于核中的情况。
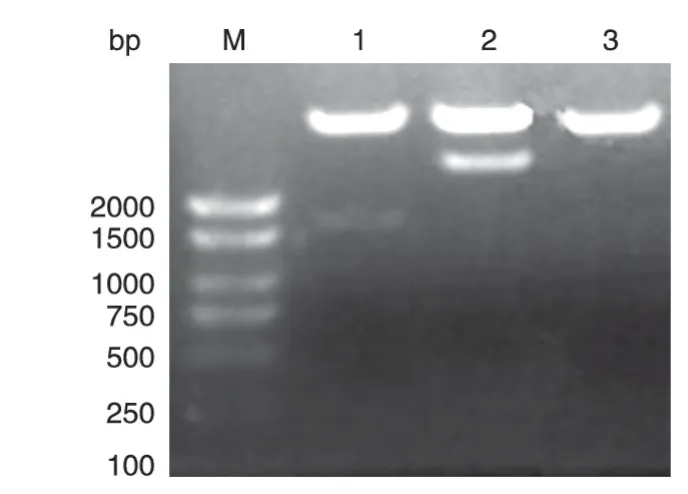
图2 重组质粒myc-Importin α/β的BamHⅠ/NotⅠ双酶切产物电泳图谱
3 讨论
核输入蛋白α通过识别和结合靶蛋白的NLS 帮助蛋白质入核,是核孔靶向复合物的重要组成部分。其主要分为3 个结构单元:未知功能的亲水羧基端、带正电既能结合自身序列中的串联重复模体又能结合核输入蛋白β的结构域(importin β binding doman,IBB),以及一个大的NLS 中央结合结构域[7]。核输入蛋白α在进化过程中结构和功能上比较保守,如人的6 个输入蛋白呈现60%的序列相似性[8-9];而核输入蛋白β家族成员在功能上保守,在蛋白质序列上呈现较低的相似性[10]。核输入蛋白β家庭成员相对分子质量为95×103~145×103,结构上都具有保守的N端Ran结合结构域(IBN-N domain)和多个HEAT Repeats结构域[11]。HEAT是由连续重复的37~46 个氨基酸残基组成的螺旋形棒状结构单元,而HEAT Repeats是由多个这样的结构域叠加形成的具有延展性的超螺旋,可以通过改变构象以配合结构不同的底物。另外,核输入蛋白β可以使用4种接头蛋白来识别不同类型的底物,从而使得一个受体可以拥有广泛的底物类型,协调了少数受体与大量底物之间的矛盾[12-13]。大多数核输入蛋白β家族成员可以直接识别底物的NLS 并与之结合,而核输入蛋白β1 却需要通过与核输入蛋白α的N 端IBB结构域结合[14],借助其作为接头蛋白,从而识别具有经典核定位信号的底物。

图3 Western印迹检测重组核输入蛋白在293T细胞中的表达
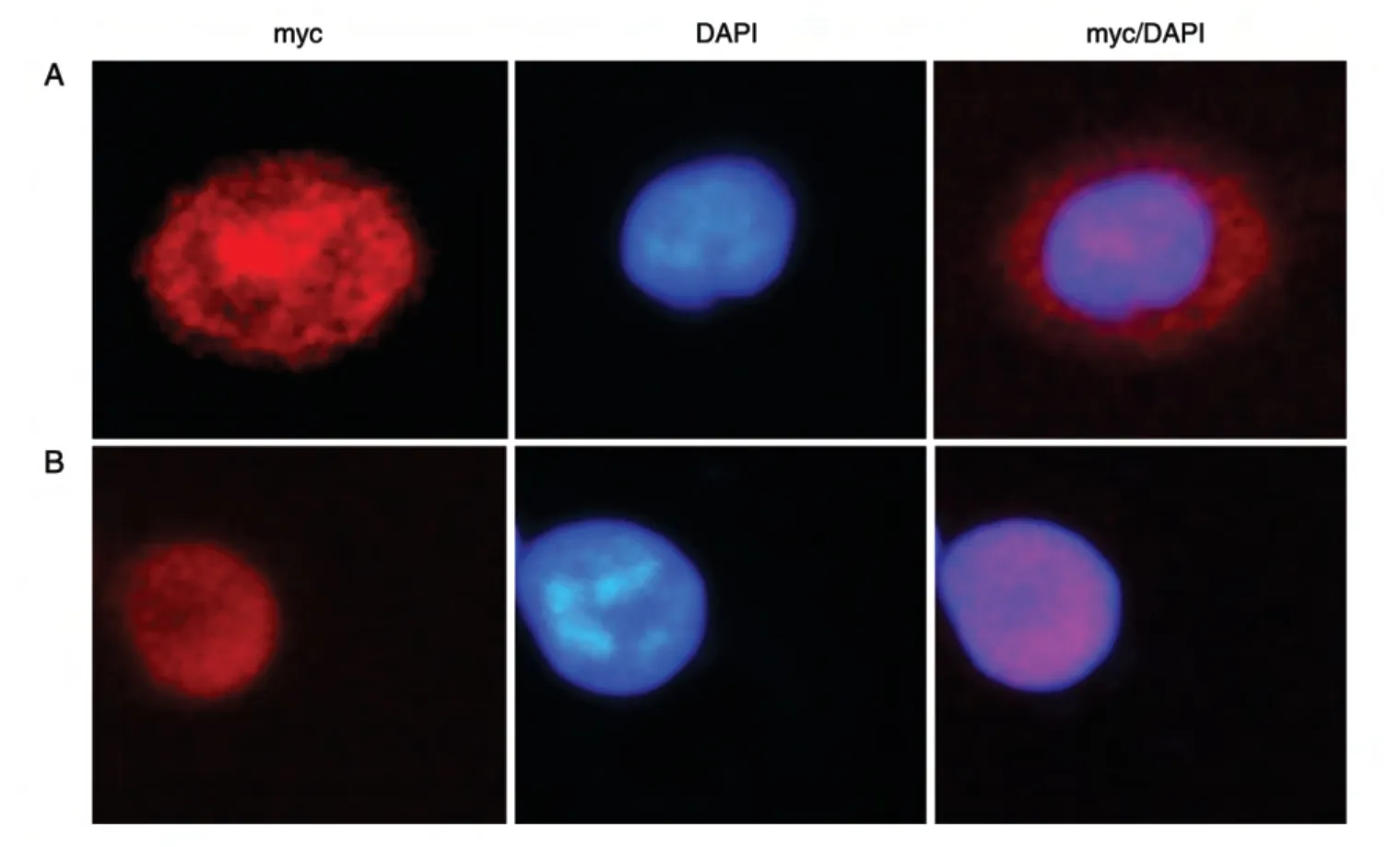
图4 myc-Importin α/β在293T细胞中的定位(荧光显微镜,×400)
核输入蛋白家族成员介导真核细胞核质转运,是核质转运的重要枢纽,也是外来蛋白质进入宿主细胞的有效途径,如一些病毒是通过与核输入蛋白α的结合从而完成入核[15]。Smad-3 具有保守的NLS序列,与Smad-4 结合形成Smad-3/Smad-4 复合物,输入蛋白可识别其NLS 序列从而运送其入核,通过Smad-3/Smad-4 的MH1 发夹样结构与DNA 上的Smads结合元件(smads-binding element,SBE)结合,在其他转录因子的协同作用下调节靶基因的转录,从而实现信号转导[16]。MDM2 可以与p53 的转录活性结构域结合,抑制p53 的转录活性[17-18];MDM2 也可以通过其自身的NES和NLS序列从胞核向胞质转位,并将p53蛋白移位至胞质中,然后在胞质蛋白酶的作用下p53 蛋白被降解,从而使细胞发生抗凋亡而癌变[19]。
蛋白质入核是十分复杂的生物学过程,受到蛋白质磷酸化水平、核转运因子等诸多因素在多个水平上的多重调控,从而使得功能蛋白及其他核蛋白精确分布并正常发挥功能。若蛋白质的核质转运受到干扰,将影响其功能的发挥,最终导致疾病的发生。探明蛋白质的入核机制和调节机制,对研究机体的生命活动,阐明疾病发生、发展机理,以及对新药物的研发都具有重要意义。
[1]Powers M A,Dasso M.Nuclear transport erupts on the slopes of Mount Etna[J].Nat Cell Biol,2004,6(2):82-86.
[2]周杰,杨雨晗,张琴,等.重组人Importin α原核表达、纯化及多克隆抗体的制备[J].成都医学院学报,2010,5(3):242-246.
[3]孙兆明,于士柱,安同岑,等.GST-NLS(ING1)融合蛋白表达载体构建及表达纯化的研究[J].国际生物医学工程杂志,2006,29(2):69-72.
[4]Köhler M,Ansieau S,Prehn S,et al.Cloning of two novel human importin-α subunits and analysis of the expression pattern of the importin-α protein family[J].FEBS Lett,1997,417(1):104-108.
[5]Görlich D,Kostka S,Kraft R,et al.Two different subunits of importin cooperate to recognize nuclear localization signals and bind them to the nuclear envelope[J].Curr Biol,1995,5(4):383-392.
[6]Goldfard D S,Cobett A H,Mason D A,et al.Importin alpha:a multipurpose muclear-transport receptor[J].Trends Cell Biol,2004,14(9):505-514.
[7]李载权,唐朝枢,周爱儒.生物大分子的细胞核质转运[J].生理科学进展,2000,31(3):253-256.
[8]Kotera I,Sekimoto T,Miyamoto Y,et al.Importin alpha transports CaMKIV to the nucleus without utilizing importin beta[J].EMBO J,2005,24(5):942-951.
[9]Melen K,Fagerlund R,Franke J,et al.Importin alpha nuclear localization signal binding sites for STAT1,STAT2,and influenza A virus nucleoprotein[J].J Biol Chem,2003,278(30):28193-28200.
[10]Kohler M.Evidence for distinct substrate specificities of importin alpha family members in nuclear protein import[J].Mol Cell Biol,1999,19(11):7782-7791.
[11]王潇,王玉鹏,全宇,等.细胞核质转运受体importin β家族与转运调控[J].细胞生物学杂志,2006,2(8):637-645.
[12]Harel A,Forbes D J.Importin bata:conducing a much larger cellular symphony[J].Mol Cell,2004,16(3):319-330.
[13]Otis K O,Thompson K R,Martin K C.Importin-mediated nuclear transport in neurons[J].Curr Opin Neurobiol,2006,16(3):329-335.
[14]Cherezova L,Burnside K L,Rose T M,et al.Conservation of complex nuclear localization signals utilizing classical and non-classical nuclear import pathways in LANA homologs of KSHV and RFHV[J].PLoS One,2011,6(4):e18920.
[15]Bhuvanakantham R,Chong M K,Ng M L.Specific interaction of capsidprotein and importin-α/β influences West Nile virus production[J].Biochem Biophys Res Commun,2009,389(1):63-69.
[16]Cordenonsi M,Dupont S,Maretto S,et al.Links between tumor suppressors:p53 is required for TGF-beta gene responses by cooperating with Smads[J].Cell,2003,113(3):301-314.
[17]Chen J,Wu X,Lin J,et al.mdm-2 inhibits the G1 arrest and apotptosis functions of the p53 tumor suppressor protein[J].Mol Cell Biol,1996,16(5):2445-2452.
[18]Lu H,Levine A J.Human TAFII31 protein is a transcriptional coactivator of the p53 protein[J].Proc Natl Acad Sci USA,1995,92(11):5154-5158.
[19]李曼,陈晨,陶泽璋,等.蛋白质的核质转位在细胞凋亡及癌变过程中的研究进展[J].肿瘤防治研究,2012,39(10):1272-1276.

