Bischler-Napieralski反应在合成具有生物活性的杂环化合物中的应用
金玉婷
(浙江工业大学药学院,浙江杭州310014)
医药化工
Bischler-Napieralski反应在合成具有生物活性的杂环化合物中的应用
金玉婷
(浙江工业大学药学院,浙江杭州310014)
综述了合成具有生物活性的二氢异喹啉和四氢异喹啉类化合物的最常用方法-Bischler-Napieralski反应。该方法底物简单易得,反应性好,可应用于工业化生产。介绍了应用于Bischler-Napieralski反应的不同氯代试剂,以及研究者们对Bischler-Napieralski反应应用范围的拓展,即将其应用于合成具有生物活性的五元和七元杂环化合物。
Bischler-Napieralski反应;生物活性;杂环化合物;氯代试剂
0 前言
Bischler-Napieralski反应是指β-芳基乙基酰胺在氯代试剂的作用下,发生分子内亲电取代,环合生成二氢异喹啉类化合物的反应。该反应是德国化学家比希勒(August Bischler)和其合作者瑞士化学家纳皮拉尔斯基(Bernard Napieralski)于1893年在Basle Chemical Works研究生物碱时发现的[1]。
很多研究者[2-3]对这一反应的机理进行了探索。Fodor等[2]在1972年提出了该反应的机理:N-(3,4-二甲氧基苯乙基)苯甲酰胺1在PCl5的作用下形成氯代的中间体2后,发生消除反应形成腈鎓离子3,最后环合得到6,7-二甲氧基-1-苯基-3,4-二氢异喹啉4(Scheme 1)。Fodor还表明在反应过程中添加路易斯酸(ZnCl2,SnCl4等)可提高环合的速率。这是由于路易斯酸促进了中间体2中氯的离去,加速了反应进程。
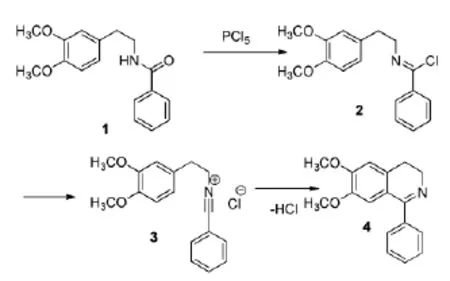
Scheme 1
1 Bischler-Napieralski反应形成六元环结构在异喹啉类药物及中间体合成中的应用
二氢异喹啉和四氢异喹啉类化合物是一类具有多样生物活性的化合物,具有抗肿瘤[4]、抗病毒[5]、抗过敏[6]、抗精神病[7]等活性,吸引了许多研究者的关注。Bischler-Napieralski反应是形成二氢异喹啉和四氢异喹啉类化合物六元含氮环的最常用方法。该方法底物简单易得,反应性好,多应用于工业化生产。以下简单介绍合成六元杂环化合物的Bischler-Napieralski反应在异喹啉类药物及中间体合成中的应用。
1.1 屈他维林的合成
屈他维林为一类解痉药,主要用于治疗胃肠道痉挛,泌尿道痉挛,子宫痉挛,胆绞痛,肾绞痛等疾病。Weijlard等[8]在1949年将Bischler-Napieralski反应应用在了屈他维林的合成中(Scheme 2)。以N-(3,4-二乙氧基苯乙基)-2-(3,4-二乙氧基苯基)乙酰胺5为原料,经POCl3氯代后,反应生成了氯代中间体,该中间体发生消除反应形成腈鎓离子,随后环合生成具有六元环结构的屈他维林6,产率高达97%。该方法底物简单易得,反应性好,可应用于屈他维林的工业化生产。国内生产该药的公司有浙江普洛康裕制药有限公司,赛诺菲(杭州)制药有限公司和扬州制药有限公司。企业应用了该条路线来生产屈他维林。
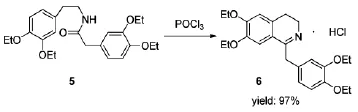
Scheme 2
1.2 去甲乌药碱中间体的合成
去甲乌药碱(Higenamine)属于苄基异喹啉类生物碱,可从附子番荔枝和小叶买麻藤等植物中提取得到。具有提高心脏能动性,治疗慢性心律不齐,提高心率,平喘等药理作用。Pyo等[9]在2008年报道了不对称合成(R)-(+)-and(S)-(-)-去甲乌药碱的方法,其中间体8的合成应用了Bischler-Napieralski环合反应(Scheme 3)。以N-(3,4-二甲氧基苯乙基)-2-(4-甲氧基苯基)乙酰胺7为原料,经POCl3氯代环合后生成了具有六元环结构的去甲乌药碱中间体8,产率高达98%(Scheme 3)。
1.3 TRPM8拮抗剂中间体的合成
TRPM8(Transient receptor potential melastatin type 8)拮抗剂对疼痛病症,过动症和膀胱疼痛综合征的治疗具有重要的意义。Horne等[10]在2014年报道了TRPM8拮抗剂(四氢异喹啉类化合物)12的合成方法,其中间体11的合成同样应用了Bischler-Napieralski反应(Scheme 4)。由于该中间体11的异喹啉苯环上没有供电基团,加大了环合的难度,因此使用POCl3/P2O5的混合体系,以促进反应的顺利进行。这是由于[2,11]这个混合体系具有更强的脱水性,更好地促进了腈鎓离子的形成,提高了反应活性。
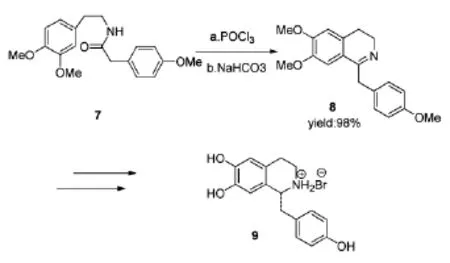
Scheme 3
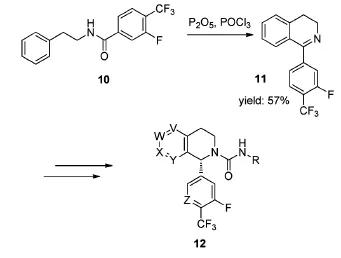
Scheme 4
1.4 GPR103拮抗剂中间体的合成
GPR103拮抗剂可降低食欲,对抗肥胖,从而减少肥胖引起的糖尿病和心血管等疾病的发生。Georgsson等[12]在2014年报道了GPR103拮抗剂15的合成方法,其中间体14的合成同样应用了Bischler-Napieralski反应(Scheme 5)。该中间体14的异喹啉苯环上只有一个供电基团,供电性减弱,增加了环合的难度,因此使用了(COCl)2/Fe-Cl3的混合体系,以促使反应的顺利进行。这个方法最早是由Larsen等[13]报道的。该混合体系使用了路易斯酸,提高了反应活性,促进了环合反应。(COCl)2/FeCl3混合体系参与的Bischler-Napieral-ski反应的机理与PCl5参与反应的机理有所不同(Scheme 6):草酰氯与酰胺13环合形成2-氯恶唑烷-4,5-二酮A,路易斯酸FeCl3促使氯离去,形成中间体B,随后发生分子内亲电取代反应,形成中间体C,最后在MeOH/H2SO4的作用下形成3,4-二氢异喹啉类化合物14。
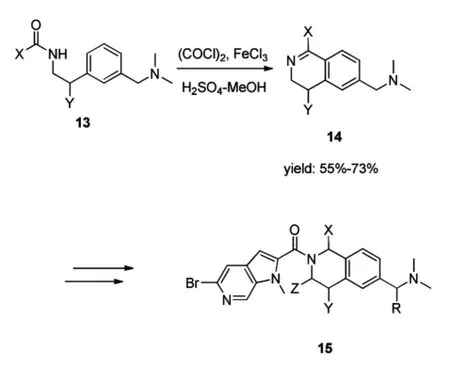
Scheme 5
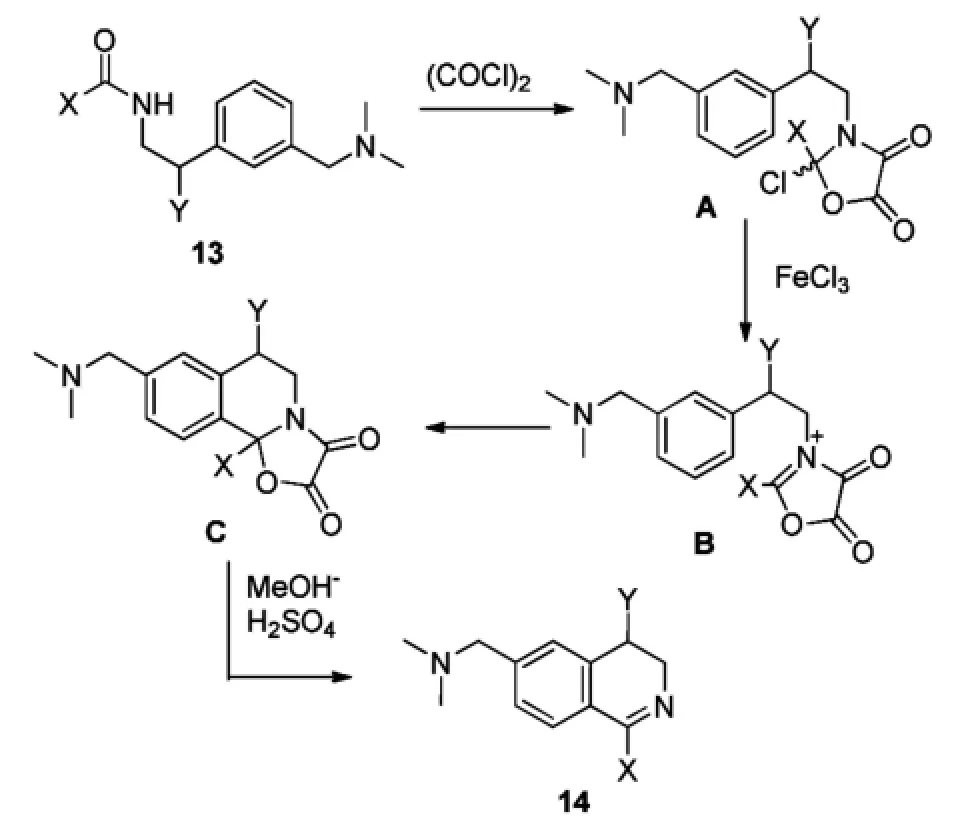
Scheme 6
1.5 双异喹啉类化合物中间体的合成
双异喹啉类化合物具有潜在抗肿瘤活性。Jaiswal等[14]在2014年合成了一系列具有抗乳腺癌活性的该类化合物(Scheme 7)。以化合物16为原料,在PCl5/Zn(OTf)2混合体系作用下,成功合成了双异喹啉类化合物的中间体17,产率为35%~90%。其中路易斯酸Zn(OTf)2促进了环合反应,加速了反应的进行。
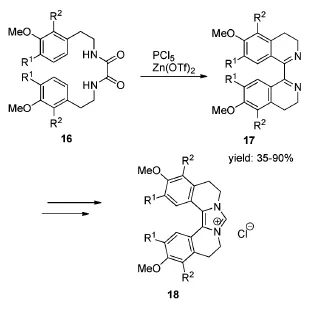
Scheme 7
2 Bischler-Napieralski反应形成五元及七元环结构的应用拓展
Bischler-Napieralski反应在合成异喹啉类化合物中得到了较好的应用,近年来,有许多研究者对Bischler-Napieralski反应的底物进行改进,并取得了一定的进展,使其反应不局限于六元杂环化合物的合成,还可用于合成五元及七元杂环化合物,这对于医药化工领域有着非常重要的意义。以下简单介绍Bschler-Napieralski反应在具有生物活性的五元及七元杂环化合物合成中的应用。
夏天无为罂粟科植物伏生紫堇的干燥块茎,有活血活络,行气止痛,祛风除湿的作用。临床上主要用于中风偏瘫,头痛,跌扑损伤,风湿痹痛,腰腿疼痛等疾病。夏天无的主要有效成分为生物碱类,包括muramine 22a和protopine 22b。Bischler-Napieralski反应一直都局限于六元杂环化合物的合成,Wadar等[15]在2007年将Bischler-Napieralski环合反应成功地应用到了muramine和protopine的五元环中间体20的合成中(Scheme 7)。但是该中间体的产率分别只有27%和26%,大部分底物转化成了副产物。目标中间体20和副产物21的比例为2:3。该五元环中间体的合成,Wadar等尝试了POCl3,P2O5和POCl3/ P2O5这三个体系,实验结果表明POCl3/P2O5混合体系具有更强的脱水性,更好地促进了腈鎓离子的形成,提高了反应活性。
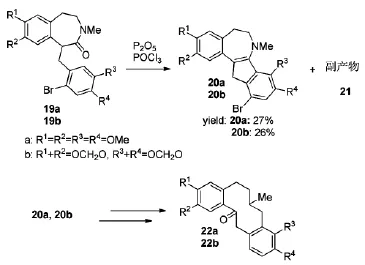
Scheme 8
Adachi等[16]在2014年也将Bischler-Napieralski环合反应成功地应用到五元杂环化合物(具生物活性的异吲哚啉类化合物)的合成中(Scheme 8)。以苄基氨基甲酸酯23为原料,使用P2O5在室温条件下,得到了五元杂环化合物24。由于异丙基在反应中为易于离去的基团,反应可顺利进行。其可能的机理是:首先P2O5(其结构一般认为是P4O10呈四面体结构)与氨基甲酸酯结合形成中间体Ⅰ,随后脱去一分子丙烯,得到异氰酸酯Ⅱ,最后异氰酸酯环合生产γ-内酰胺24(Scheme 9)。

Scheme 9
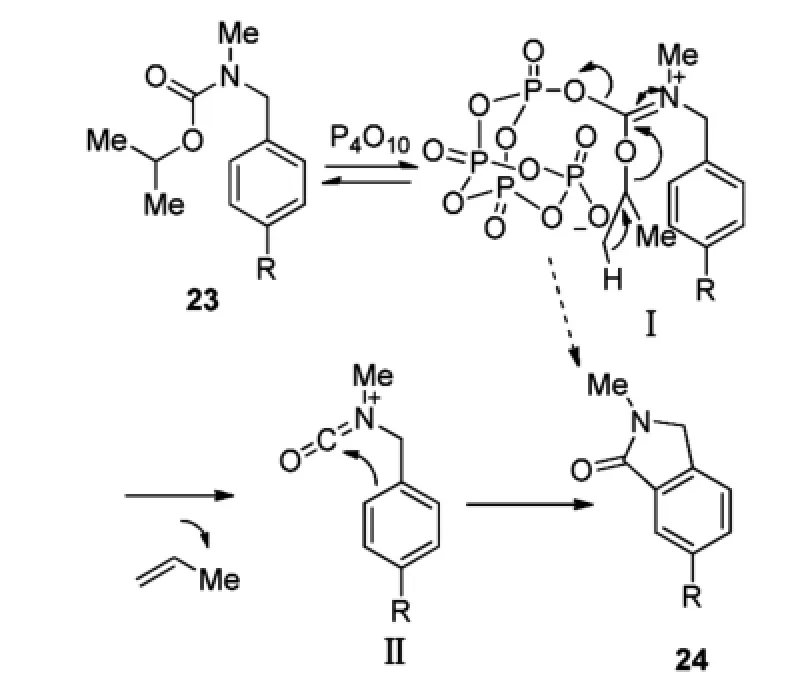
Scheme 10
Trigonoliimines B 26为从云南的大戟科三宝木属物的叶片中分离得到的吲哚类生物碱。三宝木属植物中所含的生物碱具有高效杀菌,防腐,止泻和化痰等药理作用。Buyck等[17]在2012年以环丁砜为溶剂,成功地应用Bischler-Napieralski环合反应形成了Trigonoliimines B的关键结构七元环,产率51%(Scheme 11)。值得注意的是,该反应在POCl3/甲苯体系以及POCl3/P2O5/甲苯体系中,均得不到目标七元环化合物,只有当反应溶剂为环丁砜时,反应才能顺利进行。
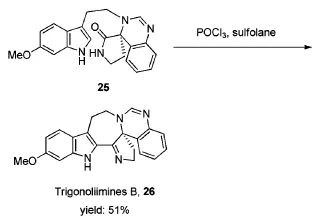
Scheme 11
3 总结
综上所述,Bischler-Napieralski反应可高效地应用于异喹啉类药物及中间体的合成。正是由于Bischler-Napieralski反应具有如此良好的反应性及广泛的应用性,我们希望将其更多地应用于工业化生产,因此可开发绿色无污染的氯代试剂来合成其它具有生物活性的杂环化合物,同时探索该反应对不同底物更广泛的适用性,这对医药化工领域具有重要的意义。
[1]Bischler A,Napieralski B.A new method for the synthesis of isoquinolines[J].Chem.Ber.,1893,26:1903-1908.
[2]Fodor G,Gal J,Phillips B A.Mechanism of the Bischler-Napieralski reaction[J].Angew.Chem.Int.Ed.Engl.,1972, 11(10):919-920.
[3]Gal J,Weinkam R J,Castagnoli Jr.N,et al.Synthesis of cis-and trans-1-(3,4-dimethoxybenzyl)-3,7-dimethyl-5,8-dimethoxy-1,2,3,4-tetrahydroxyisoquinoline.Observations on the Mechanism of the Bischler-Napieralski Reaction[J].J.Org.Chem.,1974,39(3):418-421.
[4]Mohler M L,Kang G S,Hong S S,et al.Discovery of antiglioma activity of biaryl 1,2,3,4-tetrahydroisoquinoline derivatives and conformationally flexible analogues[J]. J.Med.Chem.,2006,49:5845-5848.
[5]Cheng P,Huang N,Jiang Z Y,et al.1-Aryl-tetrahydroisoquinoline analogs as active anti-HIV agent in vitro[J]. Bioorg.Med.Chem.Lett.,2008,18:2475?2478.
[6]Georgiev V S,Carlson R P,Van Inwegen R G,et al. Drug-induced modifications of the immune response.1. substituted 1-phenylisoquinolines[J].J.Med.Chem.,1979, 22(4):348-352.
[7]Suckling C J,Murphy J A,Khalaf A I,et al.M4 agonists/ 5HT7 antagonists with potential as antischizophrenic drugs: serominic compounds[J].Bioorg.Med.Chem.Lett.,2007,17: 2649-2655.
[8]Weijlard J,Swanezy E F,Tashjian E.The preparation of 6, 7-diethoxy-1-(3',4'-diethoxybenzyl)-isoquinoline[J].J. Am.Chem.Soc.,1949,71:1889-1890.
[9]Pyo M K,Lee D H,Kim D H,et al.Enantioselective synthesis of(R)-(+)-and(S)-(-)-higenamine and their analogues with effects on platelet aggregation and experimental animal model of disseminated intravascular coagulation[J]. Bioorg.Med.Chem.Lett.,2008,18:4110-4114.
[10]Horne D.B.,Tamayo N.A.,Bartberger M.D.,et al.Optimization of potency and pharmacokinetic properties of tetrahydroisoquinoline transient receptor potential melastatin 8(TRPM8)antagonists[J]J.Med.Chem.,2014,57:2989-3004.
[11]Wang X,Tan J,Grozinger K.A significantly improved condition for cyclization of phenethylcarbamates to n-alkylated 3,4-dihydroisoquinolones[J]Tetrahedron Lett.,1998,39: 6609-6612.
[12]Georgsson J,Bergstrom F,Nordqvist A,et al.GPR103 antagonists demonstrating anorexigenic activity in vivo:design and development of pyrrolo[2,3-c]pyridines that mimic the C-terminal Arg-Phe Motif of QRFP26[J]J.Med. Chem.,2014,57:5935-5948.
[13]Larsen R D,Reamer R A,Corley E G,et al.A modified bischler-napieralski procedure for the synthesis of 3-aryl-3,4-dihydroisoquinolines[J]J.Org.Chem.,1991,56:6034 -6038.
[14]Jaiswal A S,Hirsch-Weil D,Proulx E R,et al.Anti-tumor activity of novel biisoquinoline derivatives against breast cancers[J].Bioorg.Med.Chem.Lett.,2014,24:4850-4853.
[15]Wada Y,Kaga H,Uchiito S,et al.On the synthesis of protopine alkaloids[J].J.Org.Chem.,2007,72:7301-7306.
[16]Adachi S,Onozuka M,Yoshida Y,et al.Smooth isoindolinone formation from isopropyl carbamates via bischlernapieralski-type cyclization[J].Org.Lett.,2014,16:358-361.
[17]Buyck T,Wang Q,Zhu J.A concise total synthesis of(±)-trigonoliimine B[J].Org.Lett.,2012,14(5):1338-1341.
The Application of Bischler-Napieralski Reaction in Synthesis of Biologically Active Heterocyclic Compounds
JIN Yu-ting
(Department of Pharmacy,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
We review the progress on the most commonly used procedure for synthesizing biologically active dihydroisoquinolines and tetrahydroisoquinolines-Bischler-Napieralski reaction.The reaction was usually applied to the industrial production because the substrates with good reactivity are simple and can be obtained easily.We introduce the different chlorinating reagents that can be applied to the Bischler-Napieralski reaction,and summarize researchers'efforts on expanding the new application for synthesis of five-membered and seven-membered ring heterocyclic compounds with biological activities.
Bischler-Napieralski reaction;biological activities;heterocyclic compounds;chlorinating reagents
1006-4184(2015)8-0018-04
2015-02-13
金玉婷(1989-),女,浙江杭州人,在读硕士研究生,研究方向:药物中间体合成。E-mail:jinyutingyouji@163.com。

